肝母细胞瘤(hepatoblastoma, HB)是小儿最常见的肝脏恶性肿瘤,占小儿肝脏恶性肿瘤的50%~79%[1]。HB是可治愈的小儿恶性肿瘤,早期诊断和治疗可以显著提高其生存率[2]。但HB瘤体生长迅速,大多数患儿就诊时已处于Ⅱ期及以上,甚至远处转移,预后较差[3]。凭借彩超、CT等影像学辅助检查方法均无法做到肝母细胞瘤的早期诊断。蛋白质组学技术如表面增强激光解吸电离飞行时间质谱(surface-enhanced laser desorption/ionization-time of flight, SELDI-TOF-MS)、高效液相色谱技术(high performance liquid chromatography, HPLC)和基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry, MALDI-TOF-MS)在肿瘤中的应用主要是寻找并鉴定可作为肿瘤早期诊断工具的相关标记物[4]。在恶性肿瘤病人的血清样本中,可检测到因局部或系统炎症反应产生的一些蛋白质,这些炎症因子或炎性蛋白大部分都是恶性肿瘤生物学标记物的干扰因素[5]。故在进行恶性肿瘤生物学标记物的检测时,应当排除这些炎症反应带来的干扰。
本研究对HB患儿、全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)患儿及正常儿童血清进行检测,在排除炎症因子的干扰下,筛选出准确度更高的肝母细胞瘤血清生物学标记物。
1 资料与方法 1.1 研究对象本研究血清样本(2012年12月至2014年12月)均在我院收集,清晨空腹状态下采集静脉血,室温静置1 h,3 000 r/min离心20 min,取上清-80℃冰箱保存待用。HB组患儿30例,均经病理确诊,其中男19例、女11例,年龄2~70个月,平均40±16个月,采样前未接受任何治疗;SIRS组患儿20例,男12例、女8例,年龄6~84个月,平均47±20个月;正常组儿童20例,男10例、女10例,年龄6~72个月,平均38±18个月。3组的年龄、性别构成比差异无显著性(P > 0.05)。
1.2 SELDI-TOF-MS筛选血清差异性蛋白质弱阳离子磁珠(MB-WCX)处理血清样本后,设置SELDI-TOF-MS参数:最高分子量为30 000Da,最佳状态为2 000~20 000 Da、最佳激光强度为190、最佳灵敏度为7。将结合好待测样品的蛋白质芯片装入SELDI-TOF-MS中进行检测,对血清差异性蛋白质进行筛选。在Bioprocessor平台分析,得到样本中蛋白质的质合比(m/z)及其对应的蛋白质峰值,将m/z差异 < 0.3%的归为同一类。对所得数据进行Wilcoxon秩和检验,分析HB组与正常组之间的数据,得到m/z相同、对应峰值不同的差异性蛋白质;同时分析正常组与炎症组之间的数据,得到m/z相同、对应峰值不同的差异性炎症蛋白质,排除炎症因子对HB组与正常组结果的干扰。
1.3 MALDI-TOF-MS鉴定目标蛋白质SDS-PAGE分离出目标蛋白质后,酶解目标蛋白质,抽取上清液。使用Nano HPLC将上清液打板在蛋白芯片上,将蛋白芯片装入MALDI-TOF-MS,检测酶解后的的肽段,应用Mascot搜索软件,在SwissProt数据库中查找相匹配的蛋白。
1.4 RT-PCR和ELISA验证目标蛋白质的表达提取HB组和正常组血清的RNA,使用Revert Aid First Strand cDNA Synthesis Kit,以RNA为模板合成first-strand cDNA。在Real-time PCR过程中使用Scientific Maxima SYBR Green qPCR Master Mixes检测两组的first-strand cDNA扩增情况,分析目标蛋白质表达。PCR过程中目标蛋白载脂蛋白A-Ⅰ(Apo A-Ⅰ)的引物:Forward ACAGCGTGACCTCCACCTT;Reverse CTTGCTCATCTCCTGCCTCA。PCR反应使用两步法,计算目标蛋白基因/β-actin的比值。
ELISA检测HB组和正常组血清中Apo A-Ⅰ蛋白质表达。首先配制Apo A-Ⅰ冻干标准品,两组各取10个血清样品进行检测。酶标仪调整到450 nm,读出各孔吸光值,根据标准品的吸光值绘制出标准曲线,计算待测样品的实际浓度。
1.5 统计学分析使用SPSS 17.0软件进行统计学处理。计量资料用均数±标准差(x±s)表示,统计学处理采用t检验、Wilcoxon秩和检验。P < 0.05为差异有统计学意义。
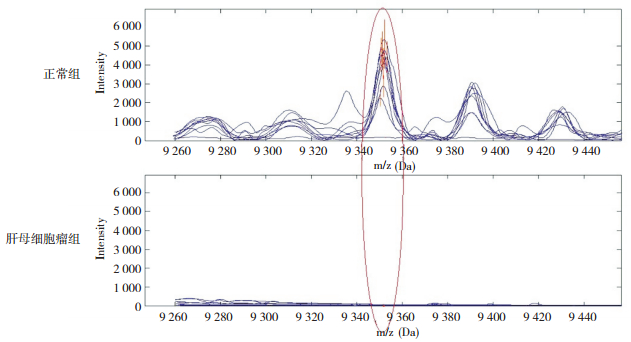
2 结果 2.1 HB组与正常组的筛选结果HB组和正常组质谱数据经过标准化处理,得到各自的m/z及其峰值,采用Wilcoxon秩和检验对两组数据进行分析,得到差异性峰值10个:HB组高表达的蛋白质峰值有4个,低表达的蛋白质峰值有6个。经过SVM筛选出Youden指数最高的组合模型,得到m/z 9 348 Da的蛋白标记物,该标记物在HB组的表达强度(29±20)低于正常组(2 037±882),差异有统计学意义(t=2.8841,P < 0.05)。见图 1。
|
图 1 肝母细胞瘤组与正常组的筛选结果 质合比峰值9 348Da的蛋白质(红色椭圆形标示)在肝母细胞瘤组低表达;在正常组高表达。 |
2.2 炎症组与正常组的筛选结果
炎症组与正常组的质谱数据经过统计学分析,得到差异性峰值10个:炎症组高表达的峰值6个,低表达的4个。经过SVM筛选出Youden指数最高的组合模型,得到m/z 5 833Da的蛋白质标记物,它在炎症组表达强度(1 283±943)高于正常组(78±75;t=2.9891,P < 0.01)。见图 2。

|
图 2 炎症组与正常组的筛选结果 质合比峰值5 833Da的蛋白质(红色椭圆形标示)在炎症组高表达,在正常组低表达。 |
2.3 排除炎症因子的干扰
应用SELDI-TOF-MAS分别在HB组与正常组、炎症组与正常组得到差异性峰值,通过比较,m/z为9 348Da的蛋白质标记物在炎症组未找到相似值,表明m/z 9 348Da的蛋白质为肝母细胞瘤血清生物学标记物。
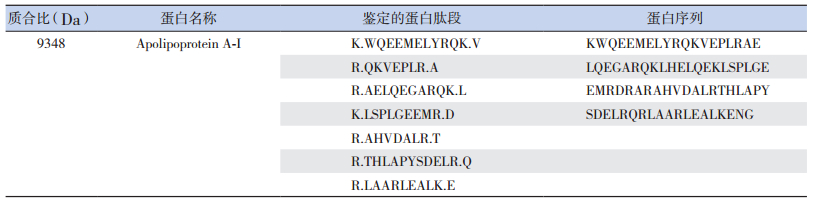
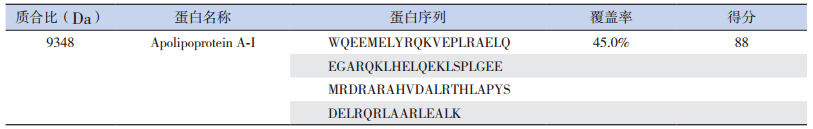
2.4 目标蛋白质的鉴定凝胶电泳分离血清标本中m/z 9 348Da的目标蛋白质后,于胶体上显示目标条带,根据筛选所得峰值结果,切除相应目标条带,进行酶解,应用MALDI-TOF-TOF对酶解后的蛋白质片段进行质谱分析,获得各种蛋白质片段的氨基酸序列(表 1),将这些蛋白质片段的氨基酸序列进行匹配重组,获得完整的氨基酸序列(表 2)。应用Mascot搜索软件,在SwissProt数据库中查找与之相匹配的蛋白质,结果显示m/z 9 348Da的蛋白质与Apo A-Ⅰ的覆盖率为45.0%,匹配得分88分。
| 表 1 基质辅助激光解吸电离飞行时间质谱分析目标蛋白质片段的氨基酸序列 |
| 表 2 目标蛋白质的完整序列 |
2.5 RT-PCR和ELISA验证Apo A-Ⅰ的表达
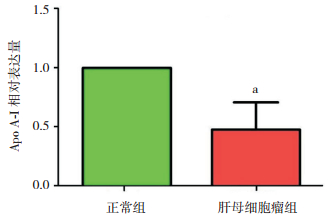
为了验证MALDI-TOF-TOF鉴定的目标蛋白质,选取HB组及正常组各15例,使用实时荧光定量PCR对其血清标本的Apo A-Ⅰ基因进行检测。Real-time PCR分析显示,Apo A-Ⅰ基因在肿瘤组低表达,在正常组高表达;通过相对定量2-△△CT方法计算,正常组表达量设为1,HB组表达量则为0.5±0.2,差异有统计学意义(P < 0.05)。见图 3。
|
图 3 Real-time PCR检测Apo A-I基因表达 a示与正常组比较,P < 0.05(PCR数据使用2-△△CT法分析,故正常组表达量为1 |
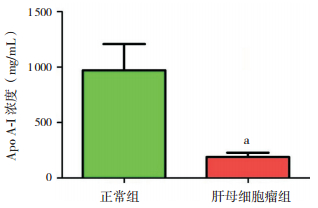
同时,本研究从肿瘤组及正常组各选取15例血清标本,使用ELISA法进行Apo A-Ⅰ蛋白表达检测,HB组Apo A-Ⅰ蛋白质浓度[(0.19±0.04)mg/mL)]低于正常组[(1.00±0.24)mg/mL],差异有统计学意义(P < 0.05)。见图 4。
|
图 4 ELISA检测Apo A-Ⅰ蛋白质浓度 a示与正常组比较,P < 0.05。 |
3 讨论
蛋白质组学研究的目标是发现新的肿瘤标记物,将之应用于癌症发生发展机制研究,并为肿瘤防治提供最有效的手段。目前蛋白质组学已实现对复杂的蛋白质类物质进行定性和定量的研究。已有多种方法成功检测出肾母细胞瘤、卵巢癌、前列腺癌、胰腺癌、结肠癌和乳腺癌等肿瘤的特异性标记物。血清蛋白质标记物可以提高肿瘤性疾病的早期诊断率以及治疗的安全性。
众多的炎症因子或炎性蛋白促进了肿瘤的发生发展,同时肿瘤的发生发展亦进一步诱导炎症反应,两者之间形成错综复杂的联系[6-7]。炎症因子或炎性蛋白成为肾母细胞瘤等肿瘤的特异性蛋白标记物的干扰因素[5],如血清高水平的IL-10、IL-1、IL-6、TNF-α与肾癌、结肠癌、口腔癌等有关[8-10]。为克服此类难题,我们在进行肿瘤特异性标记物的研究时,需进一步排除炎症因子或炎性蛋白的干扰。
Apo A-Ⅰ是Apo A的一个亚类,HDL中最重要的结构蛋白,Apo A家族中最多的组分,占HDL的80%~90%。人类的Apo A-Ⅰ分子量为28 kDa,是由243个氨基酸残基组成的多肽,主要由肝脏合成,部分由小肠合成,广泛表达于所有组织中。Apo A-Ⅰ参与脂类代谢的多个步骤,并影响人体的代谢和慢性疾病的发展过程。Apo A-Ⅰ可稳定脂蛋白的结构, 调节脂蛋白的代谢,其结构与含量的异常可引起血脂代谢紊乱,并引发高血压、胰岛素抵抗等多种病理变化。研究发现,早期卵巢癌血清中存在特异性生物学标记物Apo A-Ⅰ,经验证这种标记物能够作为早期卵巢癌的诊断指标[11]。使用这种标记物干预卵巢癌裸鼠模型,能够提高裸鼠的生存率[12]。以此为基础,该机构设计了一组长度为18个氨基酸的短肽,称之为Apo A-Ⅰ模拟肽[13],这组模拟肽包含几种亚型(2F,3F,4F,5F,6F和7F),它们的螺旋结构与Apo A-Ⅰ相同,都能够衍生抗氧化和结合油脂。进一步研究发现[14],名为L-4F的Apo A-Ⅰ模拟肽通过调节缺氧诱导因子的表达,抑制血管内皮生长因子和肿瘤血管的生成,诱导卵巢癌细胞的凋亡,达到治疗卵巢癌的目的。Apo A-Ⅰ已经作为早期卵巢癌的血清生物学标记物,那么它是否有可能用于儿童肝母细胞瘤的早期诊断呢?
我们应用SELDI-TOF-MS技术,对HB患儿、炎症患儿及正常儿童血清进行检测,排除炎症因子和炎性蛋白的干扰后,筛选出m/z峰值为9 348Da的肝母细胞瘤血清蛋白质生物标记物,并发现此种蛋白质在肝母细胞瘤患儿低表达,在正常儿童高表达。SDS-PAGE技术分离血清中的目标蛋白质,获得m/z 9 348Da的目标蛋白质;酶解该蛋白质得到相关肽段,通过MALDI-TOF-MS技术鉴定这些肽段的序列,在SwissProt数据库中进行比对分析,与之相匹配的蛋白质是Apo A-Ⅰ。通过RT-PCR检测术前肝母细胞瘤患儿和正常儿童血清中Apo A-Ⅰ基因的表达,以及ELISA技术检测两者血清中Apo A-Ⅰ蛋白表达,进一步验证了Apo A-Ⅰ在肝母细胞瘤患儿低表达,在正常儿童高表达。由此可见,Apo A-Ⅰ能够作为肝母细胞瘤的血清蛋白质生物标记物,这种生物标记物对于肝母细胞瘤的早期诊断可能有着重大的意义。
本研究筛选、确定了Apo A-Ⅰ可能作为HB的血清特异性蛋白质标记物,尚需要进一步的临床实践证实其特异性与敏感性,并进一步研究Apo A-Ⅰ与肝母细胞瘤发生发展的关系,以确定Apo A-Ⅰ在肝母细胞瘤发病机制中的作用。
| [1] | Xiong XL, Qin H, Yan SQ, et al. Expression of glypican-3 is highly associated with pediatric hepatoblastoma:a systemic analysis[J]. Asian Pac J Cancer Prev , 2015, 16 (3) : 1029–1031. DOI:10.7314/APJCP.2015.16.3.1029 |
| [2] | Ismail H, Broniszczak D, Kaliciński P, et al. Changing treatment and outcome of children with hepatoblastoma:analysis of a single center experience over the last 20 years[J]. J Pediatr Surg , 2012, 47 (7) : 1331–1339. DOI:10.1016/j.jpedsurg.2011.11.073 |
| [3] | Baertschiger RM, Ozsahin H, Rougemont AL, et al. Cure of multifocal panhepatic hepatoblastoma:is liver transplantation always necessary[J]. J Pediatr Surg , 2010, 45 (5) : 1030–1036. DOI:10.1016/j.jpedsurg.2010.01.038 |
| [4] | Silberring J, Ciborowski P. Biomarker discovery and clinical proteomics[J]. Trac-Trend Anal Chem , 2010, 29 (2) : 128–140. DOI:10.1016/j.trac.2009.11.007 |
| [5] | Kelly-Spratt KS, Pitteri SJ, Gurley KE, et al. Plasma proteome profiles associated with inflammation, angiogenesis, and cancer[J]. PLoS One , 2011, 6 (5) : e19721. DOI:10.1371/journal.pone.0019721 |
| [6] | Chechlinska M, Kowalewska M, Nowak R. Systemic inflammation as a confounding factor in cancer biomarker discovery and validation[J]. Nat Rev Cancer , 2010, 10 (1) : 2–3. DOI:10.1038/nrc2782 |
| [7] | Hou JM, Zhao X, Tian L, et al. Immunotherapy of tumors with recombinant adenovirus encoding macrophage inflammatory protein 3b induces tumor-specific immune response in immunocompetent tumor-bearing mice[J]. Acta Pharmacol Sin , 2009, 30 (3) : 355–363. DOI:10.1038/aps.2009.4 |
| [8] | Yoo KH, Lee DG, Won KY, et al. Expression of CC chemokine receptor 5 in clear cell renal cell carcinoma and its clinical significance[J]. Oncol Lett , 2015, 9 (5) : 2085–2089. |
| [9] | van Grevenstein WM, Hofland LJ, van Rossen ME, et al. Inflammatory cytokines stimulate the adhesion of colon carcinoma cells to mesothelial monolayers[J]. Dig Dis Sci , 2007, 52 (10) : 2775–2783. DOI:10.1007/s10620-007-9778-4 |
| [10] | Kotowicz B1, Kaminska J, Fuksiewicz M, et al. Clinical significance of serum CA-125 and soluble tumor necrosis factor receptor type I in cervical adenocarcinoma patients[J]. Int J Gynecol Cancer , 2010, 20 (4) : 588–592. DOI:10.1111/IGC.0b013e3181d5c27a |
| [11] | Zhang J, Guo F, Wang L, et al. Identification of apolipoprotein C-I as a potential Wilms' tumor marker after excluding inflammatory factors[J]. Int J Mol Sci , 2014, 15 (9) : 16186–16195. DOI:10.3390/ijms150916186 |
| [12] | Su F, Kozak KR, Imaizumi S, et al. Apolipoprotein A-Ⅰ (apoA-Ⅰ) and apoA-Ⅰ mimetic peptides inhibit tumor development in a mouse model of ovarian cancer[J]. Proc Natl Acad Sci U S A , 2010, 107 (46) : 19997–20002. DOI:10.1073/pnas.1009010107 |
| [13] | Zhang J, Hu Q, Guo F, et al. Screening and identification of post-traumatic stress-related serum factors in children with Wilms' tumors[J]. Oncol Lett , 2016, 11 (2) : 1299–1304. |
| [14] | Gao F, Chattopadhyay A, Navab M, et al. Apolipoprotein A-Ⅰ mimetic peptides inhibit expression and activity of hypoxia-inducible factor-1α in human ovarian cancer cell lines and a mouse ovarian cancer model[J]. J Pharmacol Exp Ther , 2012, 342 (2) : 255–262. DOI:10.1124/jpet.112.191544 |
 2016, Vol. 18
2016, Vol. 18