急性髓细胞白血病(acute myeloid leukemia, AML)为髓系前体细胞恶性克隆增殖性肿瘤,在临床表现、细胞遗传学、分子遗传学、治疗反应和预后方面均呈现高度异质性。目前国内外公认细胞遗传学和分子生物学异常为AML分型诊断和分层治疗的重要依据,但相当部分儿童AML并无特异性的细胞或分子遗传学标志。因此,如何对儿童AML进行更精细的危险度分组以指导个体化治疗对于进一步提高AML预后具有重要临床意义。
肾母细胞瘤基因1(Wilms tumor gene 1, WT1)定位于染色体11p13,最早从Wilms瘤细胞中被克隆,与Wilms瘤发生、发展密切相关[1-2]。国内外研究表明,WT1高表达为很大一部分AML患者的常见分子生物学异常[3-5]。WT1作为一种泛白血病基因,其表达水平在指导AML治疗、预测复发和预后评估方面的临床应用价值已在国外得到高度重视[6-8],但国内关于AML患儿WT1表达及临床意义方面的研究较少。本研究采用实时荧光定量PCR方法检测儿童AML的WT1表达水平,研究其变化规律,探讨与AML患儿化疗反应和预后的关系。
1 材料与方法 1.1 研究对象收集2009年4月至2016年1月于四川大学华西第二医院确诊的45例儿童AML病例,不包括急性早幼粒细胞白血病(AML-M3)。本组AML病例均于我院儿童血液肿瘤科接受正规化疗,并有完整的随访资料。本研究获得医院伦理委员会批准及监护人书面知情同意。
1.2 主要试剂淋巴细胞分离液购自天津灏洋生物制品科技有限责任公司。Trizol试剂购自北京康为世纪生物科技有限公司。Takara逆转录试剂盒购自日本Takara生物有限公司。荧光定量PCR体系购自北京优尼康生物科技有限公司。WT1基因引物及探针由上海Invitrogen公司设计及合成。
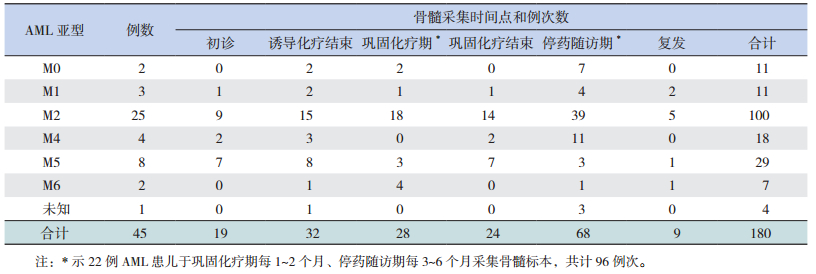
1.3 标本采集采集45例AML患儿不同时间点骨髓标本并检测WT1表达水平,共180例次。AML病例组各亚型骨髓标本采集时间点和例次数见表 1。9例复发患儿中的1例为随访截止点确诊复发,5例复发患儿放弃治疗后死亡,3例复发后姑息化疗、带瘤生存(期间未规律进行WT1检测)。
| 表 1 AML患儿各亚型骨髓采集时间点和例次数 |
1.4 WT1基因检测
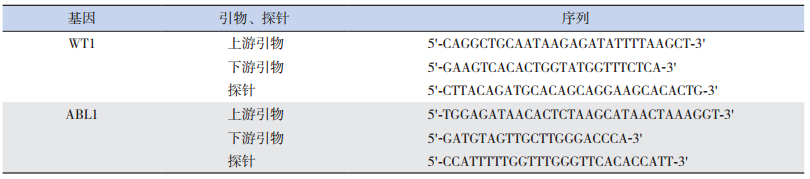
采集EDTA抗凝骨髓标本1~2 mL。淋巴细胞分离液密度梯度离心法分离骨髓单个核细胞。采用Trizol试剂提取细胞总RNA后逆转录制备cDNA。WT1目标基因和ABL1内参基因引物及探针序列见表 2。WT1和ABL1基因扩增产物长度分别为120 bp和129 bp。荧光定量PCR反应体系:Taqman Fast Master Mix(5×)4 μL,上游引物0.5 μL,下游引物0.5 μL,荧光探针1 μL,cDNA模板5 μL,灭菌去离子水9 μL。反应条件:95℃变性10 min,然后进行45个PCR循环(95℃变性10 s,60℃退火60 s)。根据WT1和ABL1各自荧光定量PCR反应的Ct值,对照各自相应的标准曲线,计算其拷贝数,WT1相对表达量=(WT1拷贝数/ABL1拷贝数)×104。诱导化疗结束时WT1表达水平的下降程度以log(初诊时WT1相对表达量/诱导化疗结束时WT1相对表达量)表示[9-10]。
| 表 2 WT1及ABL1的引物及探针序列 |
1.5 治疗方案及疗效评估
AML治疗参照英国医学研究委员会AML15诊疗方案[11]。疗效评估[12]:骨髓原始和幼稚细胞 < 5%定义为完全缓解(complete remission, CR);原始和幼稚细胞≥5%,但 < 25%定义为部分缓解;原始和幼稚细胞≥25%定义为未缓解;CR后骨髓原始和幼稚细胞≥25%定义为复发(本研究未纳入孤立性髓外复发病例)。
1.6 随访随访截止至2016年2月1日,中位随访时间20个月(1~82个月)。总生存期为确诊之日至随访终点或任何原因所致死亡的时间。无病生存期为CR之日至复发或任何原因死亡的时间。
1.7 统计学分析采用SPSS 22.0统计学软件进行相关统计学处理。非正态分布计量资料采用中位数(范围)表示,多组间比较采用Kruskal-Wallis方法,两组比较采用Mann-Whitney检验。生存分析采用Kaplan-Meier生存分析进行,Log-rank检验分析AML各阶段WT1表达水平与生存率的关系。P < 0.05为差异具有统计学意义。
2 结果 2.1 AML患儿初诊时WT1表达水平与临床特征和诱导缓解状况的关系19例患儿初诊时WT1的中位表达量为1 525(50~29 407)。AML初诊时WT1相对表达量与性别、年龄、外周血白细胞总数、染色体核型及诱导化疗后的缓解状况均无明确相关性;如以AML患儿初诊时骨髓幼稚细胞比例的中位值60%作为截断值,骨髓幼稚细胞比例 > 60%者WT1表达水平较高(P=0.017);M2病例组初诊时WT1中位表达量低于非M2病例组(P=0.043)。见表 3。
| 表 3 AML初诊时WT1表达水平与临床特征及诱导缓解状况的关系[中位数(范围)] |
2.2 WT1表达水平与AML疾病状态的相关性
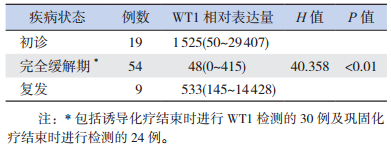
初诊及复发的WT1表达量均高于缓解期(P < 0.01);WT1中位表达量在初诊与复发时的差异无统计学意义(P=0.772)。见表 4。
| 表 4 AML不同疾病状态下WT1表达水平的比较[中位数(范围)] |
2.3 WT1表达水平的动态变化与复发的关系
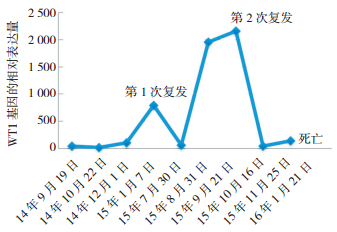
本研究对22例AML患儿的WT1表达水平进行动态检测(13例自初诊时开始,9例从诱导化疗结束后开始),其中3例AML骨髓复发。复发病例在持续缓解期WT1表达量维持在相对稳定的低水平,但骨髓复发2~3个月前WT1表达量即呈上升趋势,其中2例复发时WT1表达量(分别为161和3 650)升高至初诊水平(191和2 542)。另1例AML患儿两次骨髓复发,第2次复发时WT1相对表达量(2 160)较首次复发时(788)升高2.7倍,见图 1。
|
图 1 1例两次复发的AML患儿WT1表达水平变化 |
2.4 WT1表达水平与预后的关系
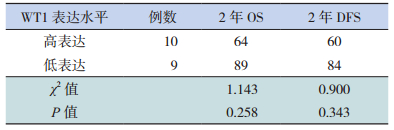
以AML患儿初诊时WT1中位表达量(1 525)为截断值,将AML患儿分为高、低表达组,高表达组和低表达组的2年总生存率(overall survival,OS)及无病生存率(disease-free survival, DFS)分别为64%和60%,89%和84%,差异无统计学意义(P > 0.05),见表 5。
| 表 5 AML患儿初诊时WT1高、低表达组的2年OS和DFS比较(%) |
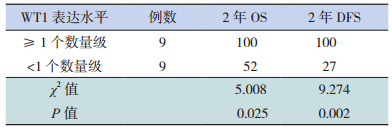
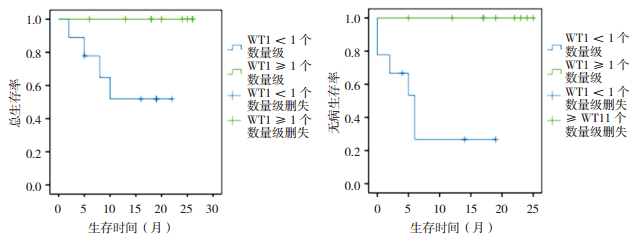
18例AML患儿在初诊和诱导化疗结束时均进行了WT1表达水平的检测。诱导化疗结束时WT1表达下降程度的中位值为1个数量级,下降程度≥1个数量级患儿的2年OS和DFS均高于下降程度 < 1个数量级患儿,差异具有统计学意义(P < 0.05),见表 6、图 2。
| 表 6 诱导化疗结束时WT1表达水平下降程度与生存情况的关系(%) |
|
图 2 诱导化疗结束时不同WT1下降程度的AML患儿生存曲线 |
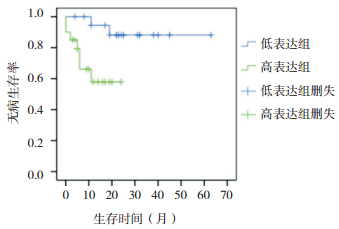
以诱导化疗结束的WT1中位表达量(49)为截断值分为高、低表达组。高表达组的2年DFS(58%)低于低表达组(86%)(χ2=5.263,P=0.022),见图 3;其2年OS与低表达组的差异(67% vs 86%)无统计学意义(χ2=2.597,P=0.107)。以巩固化疗结束时WT1中位表达量(53)为截断值分为高、低表达组,WT1高表达和低表达组的2年OS(73%,92%)及DFS(64%,83%)差异均无统计学意义(P > 0.05)。
|
图 3 AML患儿诱导化疗结束时WT1高、低表达组的无病生存曲线 |
3 讨论
WT1在不同AML亚型,以及相同AML亚型不同个体之间的表达情况均存在较大差异。国内外相关研究表明,WT1表达水平以AML-M3最高,其它亚型AML的WT1表达量各家报道不一[13-14];而AML1-ETO融合基因阳性M2病例的WT1表达水平明显低于其它AML亚型[15]。本研究未纳入AML-M3,但结果也表明,AML-M2病例组WT1表达水平最低;而且初诊时WT1的表达水平与骨髓幼稚细胞百分比具有明确相关性,与性别、年龄、外周血白细胞总数、染色体核型及第1疗程诱导是否缓解无关。
此外,本研究发现初诊及复发AML病例组WT1的表达水平高于完全缓解期病例组。动态监测22例AML患儿WT1表达水平,发现骨髓复发2~3个月前WT1表达量即呈上升趋势。我们推测,WT1表达水平与白血病肿瘤细胞负荷程度有关,因此,了解WT1基因表达水平的动态变化有助于AML的疗效评估和复发预测。
多数研究表明,初诊时WT1高表达为成人AML独立的不良预后因素[16-17],但对于初诊时WT1表达水平与儿童AML预后的关系仍无统一意见。Rodrigues等[18]对41名初诊时完成WT1表达水平检测的AML患儿进行随访,结果显示WT1高表达的AML患儿总生存率更高。而Noronha等[19]对155名AML患儿的研究显示,初诊时WT1表达量与长期生存率无明确相关性。本研究结果也表明初诊时WT1表达水平与预后无关。因此,需要扩大样本量进行长期随访研究以进一步明确初诊时WT1表达水平与儿童AML长期预后的关系。
微小残留病(minimal residual disease, MRD)水平检测在指导儿童白血病个体化治疗、预后评估和复发预测方面具有重要临床价值。对于初诊时具有特定非随机性细胞遗传学异常和/或分子生物学异常的AML病例,临床上通过动态监测这些异常是否恢复进行预后评估和复发预测。但对于很大一部分没有特定细胞遗传学和/或分子生物学异常的AML病例,WT1作为一种泛白血病标记基因即具有重要的临床应用价值。Shibasaki等[9]对48名成人AML的研究显示,诱导化疗和巩固化疗结束时WT1表达量的降低程度如较初诊时大于2个数量级,则预后良好。本研究同样显示,诱导化疗结束时WT1表达量下降程度 < 1个数量级的病例其2年OS和DFS均显著低于下降程度≥1个数量级病例。Nomdedéu等[20]分析了584名成人AML患者各时间点WT1表达水平与预后的关系,发现诱导及巩固化疗结束时WT1持续高表达者预后不良。本研究未发现AML患儿巩固化疗结束时WT1表达水平与预后具有明确相关性。结合国外学者的研究结果,我们认为,诱导化疗阶段有效杀灭白血病细胞的程度是诱导化疗结束时WT1下降程度的决定性因素,诱导化疗结束时WT1表达水平可一定程度上反映AML白血病细胞对化疗的敏感性。因此,诱导化疗结束为检测WT1表达水平的一个重要时间节点。
综上,WT1表达与儿童AML预后密切相关,但能否将WT1作为AML分型诊断和分层治疗的依据需进一步研究,但我们相信通过不断深入的研究,最终能够阐明WT1在AML中的作用机制,为临床治疗提供更多的依据。
| [1] | Lee SB, Haber DA. Wilms tumor and the WT1 gene[J]. 2001, 264(1):74-99. |
| [2] | Qi XW, Zhang F, Wu H, et al. Wilms' tumor 1(WT1) expression and prognosis in solid cancer patients:a systematic review and meta-analysis[J]. Sci Rep , 2015, 5 : 8924. DOI:10.1038/srep08924 |
| [3] | Kramarzova K, Stuchly J, Willasch A, et al. Real-time PCR quantification of major Wilms tumor gene 1(WT1) isoforms in acute myeloid leukemia, their characteristic expression patterns and possible functional consequences[J]. Leukemia , 2012, 26 (9) : 2086–2095. DOI:10.1038/leu.2012.76 |
| [4] | Lyu X, Xin Y, Mi R, et al. Overexpression of Wilms tumor 1 gene as a negative prognosic indicator in acute myeloid leukemia[J]. PLoS One , 2014, 9 (3) : e92470. DOI:10.1371/journal.pone.0092470 |
| [5] | Kitamura K, Nishiyama T, Ishiyama K, et al. Clinical usefulness of WT1 mRNA expression in bone marrow detected by a new WT1 mRNA assay kit for monitoring acute myeloid leukemia:a comparison with expression of WT1 mRNA in peripheral blood[J]. Int J Hematal , 2016, 103 (1) : 53–62. DOI:10.1007/s12185-015-1882-1 |
| [6] | Miyawaki S, Hatsumi N, Tamaki T, et al. Prognostic potential of detection of WT1 mRNA level in peripheral blood in adult acute myeloid leukemia[J]. Leuk Lymphoma , 2010, 51 (10) : 1855–1861. DOI:10.3109/10428194.2010.507829 |
| [7] | Lasa A, Carricondo M, Estivill C, et al. WT1 monitoring in core binding factor AML:comparison with specific chimeric products[J]. Leuk Res , 2009, 33 (12) : 1643–1649. DOI:10.1016/j.leukres.2009.03.046 |
| [8] | Pozzi S, Geroldi S, Tedone E, et al. Leukemia relapse after allogeneic transplants for acute myeloid leukemia:predictive role of WT1 expression[J]. Br J Haematol , 2013, 160 (4) : 503–509. DOI:10.1111/bjh.2013.160.issue-4 |
| [9] | Shibasaki Y, Seki Y, Tanaka T, et al. The association of level of reduction of Wilms' tumor gene 1 mRNA transcript in bone marrow and outcome in acute myeloid leukemia patients[J]. Leuk Res , 2015, 39 (6) : 667–671. DOI:10.1016/j.leukres.2015.03.021 |
| [10] | Rossi G, Minervini MM, Melillo L, et al. Predictive role of minimal residual disease and log clearance in acute myeloid leukemia:a comparison between multiparameter flow cytometry and Wilm's tumor 1 levels[J]. Ann Hematol , 2014, 93 (7) : 1149–1157. |
| [11] | Burnett AK, Hills RK, Milligan D, et al. Identification of patients with acute myeloblastic leukemia who benefit from the addition of gemtuzumab ozogamicin:results of the MRC AML15 trial[J]. J Clin Oncol , 2011, 29 (4) : 369–377. DOI:10.1200/JCO.2010.31.4310 |
| [12] | Cheson BD, Cassileth PA, Head DR, et al. Report of the National Cancer Institute-sponsored workshop on definitions of diagnosis and response in acute myeloid leukemia[J]. J Clin Oncol , 1990, 8 (5) : 813–819. |
| [13] | 万鼎铭, 边志磊, 刘延方, 等. 急性髓系白血病骨髓WT1基因的表达与预后的关系[J]. 郑州大学学报(医学版) , 2014, 49 (3) : 386–390. |
| [14] | 刑冲云, 高申孟, 梁彬, 等. 实时荧光定量PCR检测急性髓系白血病患者WT1基因表达及其临床意义[J]. 温州医学院学报 , 2011, 41 (6) : 527–530. |
| [15] | Ommen HB, Nyvold CG, Braendstrup K, et al. Relapse prediction in acute myeloid leukemia patients in complete remission using WT1 as a molecular marker:development of a mathematical model to predict time from molecular to clinical relapse and define optimal sampling intervals[J]. Br J Haematol , 2008, 141 (6) : 782–791. DOI:10.1111/j.1365-2141.2008.07132.x |
| [16] | Kim HJ, Choi EJ, Sohn HJ, et al. Combinatorial molecular marker assays of WT1, survivin, and TERT at initial diagnosis of adult acute myeloid leukemia[J]. Eur J Haematol , 2013, 91 (5) : 411–422. DOI:10.1111/ejh.12167 |
| [17] | Luo S, Yu K, Yan QX, et al. Analysis of WT1 mutations, expression levels and single nucleotide polymorphism rs16754 in de novo non-M3 acute myeloid leukemia[J]. Leuk Lymphoma , 2014, 55 (2) : 349–357. DOI:10.3109/10428194.2013.791985 |
| [18] | Rodrigues PC, Oliveira SN, Viana MB, et al. Prognostic significance of WT1 gene expression in pediatric acute myeloid leukemia[J]. Pediatr Blood Cancer , 2007, 49 (2) : 133–138. DOI:10.1002/(ISSN)1545-5017 |
| [19] | Noronha SA, Farrar JE, Alonzo TA, et al. WT1 expression at diagnosis does not predict survival in pediatric AML:a report from the Children's Oncology Group[J]. Pediatr Blood Cancer , 2009, 53 (6) : 1136–1139. DOI:10.1002/pbc.v53:6 |
| [20] | Nomdedéu JF, Hoyos M, Carricondo M, et al. Bone marrow WT1 levels at diagnosis, post-induction and post-intensification in adult de novo AML[J]. Leukemia , 2013, 27 (11) : 2157–2164. DOI:10.1038/leu.2013.111 |
 2016, Vol. 18
2016, Vol. 18