肾母细胞瘤是儿童常见的腹部恶性肿瘤,高居儿童腹部肿瘤的第2位,小儿恶性肿瘤的第5位。在所有儿童恶性肿瘤中,肾母细胞瘤发病率约6%,95%以上的儿童肾脏肿瘤为肾母细胞瘤[1]。目前肾母细胞瘤的发病机制尚不完全清楚,越来越多的研究证实免疫机制在肿瘤发病中的作用。近年研究已证实,许多实体性肿瘤(如胃癌、肺癌、肝癌等)中均发现调节性T细胞(regulatory T cells, Treg)水平异常,并且Treg水平改变与肿瘤进展及预后相关[2],同时研究表明自然杀伤T细胞(natural killer T cells, NKT)在抑制自身免疫性疾病、风湿性疾病、传染性疾病、移植耐受,及抗感染、抗肿瘤中发挥重要作用,而其在肿瘤免疫调节中的作用日益受到重视[3-4]。但Treg和NKT在肾母细胞瘤的免疫发病机制中的研究甚少,因此关于肾母细胞瘤患儿外周血中Treg和NKT的表达研究在儿童肾母细胞瘤诊疗方面有重要意义,对于临床肿瘤免疫治疗也必将有重要的指导作用。本研究将CD4+CD25+CD127low T细胞占CD4+ T细胞比例作为Treg水平,CD3+CD16+CD56+ T细胞占CD3+ T细胞的比例作为NKT水平,检测肾母细胞瘤患儿外周血Treg和NKT表达水平,根据Treg和NKT的表达变化,初步探讨肾母细胞瘤的发生发展,为肾母细胞瘤诊疗提供新的思路和方法,使肿瘤免疫治疗得到更好的临床应用。
1 资料与方法 1.1 研究对象选取2015年11月至2016年7月就诊于重庆医科大学附属儿童医院泌尿外科的肾母细胞瘤住院患儿21例作为病例组,其中男7例,女14例,平均年龄3.7±3.4岁,均经术后病理学确诊。另选取于本院体检的健康儿童21例为健康对照组,其中男9例,女12例,平均年龄4.2±3.5岁。依据年龄不同将病例组患儿分为 < 3岁组(n=11)和≥3岁组(n=10)。本研究获得医院医学伦理委员会批准及家长知情同意。
1.2 主要仪器及试剂FITC标记的鼠抗人CD4单克隆抗体、APC标记的鼠抗人CD25单克隆抗体、PE标记的鼠抗人CD127单克隆抗体、FITC标记的鼠抗人CD3单克隆抗体、APC标记的鼠抗人CD16单克隆抗体、PE标记的鼠抗人CD56单克隆抗体,以及同型对照单克隆抗体(美国EB公司);人血红细胞裂解液(中国Biotopped公司);FACS Calibur型流式细胞仪(美国BD公司)。
1.3 标本收集与检测采集两组儿童清晨空腹外周静脉血2 mL于肝素锂抗凝管中,室温保存,8 h内进行免疫荧光染色处理。取流式管4支,分别标记Treg、Treg同型对照、NKT、NKT同型对照。每管分别加入50 μL抗凝全血和相应抗体各2.5 μL,室温、避光孵育30 min;孵育结束后,每管分别加入1 mL红细胞裂解液,充分混匀,裂解15 min;裂解完成后,4℃、4 500 r/min离心10 min,弃上清;再加入1 mL PBS洗涤,离心5 min,弃上清;每管加入200 μL PBS重悬,待测。流式细胞仪检测CD4+CD25+CD127low T细胞和CD3+CD16+CD56+ T细胞,以CD4+CD25+CD127low T细胞占CD4+ T细胞百分比作为Treg水平,CD3+CD16+CD56+ T细胞占CD3+ T细胞的百分比作为NKT水平。
1.4 统计学分析采用SPSS 17.0统计学软件对数据进行统计学分析。服从正态分布的计量资料用均数±标准差(x±s)表示,两组间比较采用两独立样本t检验。不服从正态分布的计量资料采用中位数(四分位间距)[P50(P25,P75)]表示,两组间比较采用Mann-Whitney U检验。采用Spearman相关系数法进行相关性分析。P < 0.05为差异有统计学意义。
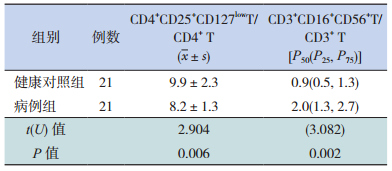
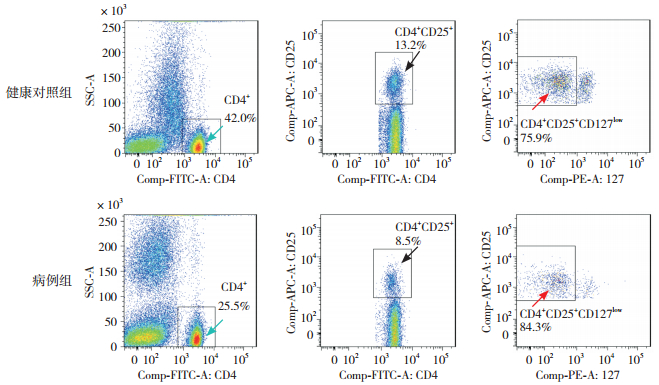
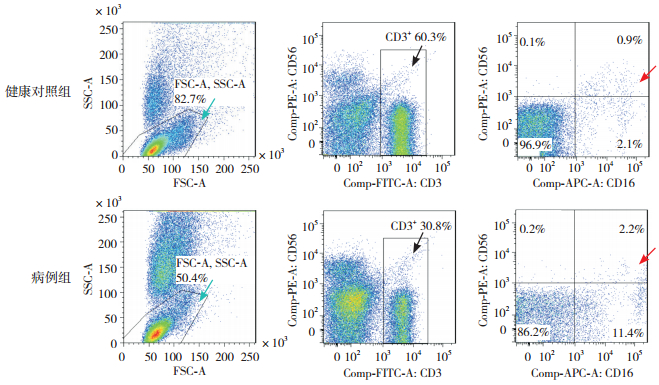
2 结果 2.1 两组儿童外周血中Treg和NKT水平比较病例组患儿外周血Treg水平低于健康对照组,差异有统计学意义(P < 0.05)(图 1,表 1)。病例组患儿外周血NKT水平高于健康对照组,差异有统计学意义(P < 0.05)(图 2,表 1)。
|
图 1 流式细胞术检测两组儿童外周血中Treg水平 注:绿色箭头所示为CD4+ T细胞;黑色箭头所示为CD4+CD25+ T细胞占CD4+ T细胞百分比;红色箭头所示为CD4+CD25+CD127low T细胞占CD4+CD25+ T细胞百分比,结果以CD4+CD25+CD127low T细胞占CD4+ T细胞百分比代表Treg水平。 |
| 表 1 两组儿童外周血Treg和NKT水平比较(%) |
|
图 2 流式细胞术检测两组儿童外周血中NKT水平 注:绿色箭头所示为淋巴细胞;黑色箭头所示为CD3+ T细胞;红色箭头所示为CD3+CD16+CD56+ T细胞占CD3+ T细胞百分比,结果以CD3+CD16+CD56+ T细胞占CD3+ T细胞百分比代表NKT水平。 |
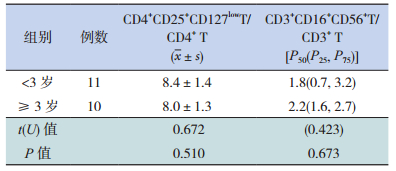
2.2 病例组不同年龄段患儿外周血Treg和NKT水平比较
不同年龄段肾母细胞瘤患儿外周血Treg和NKT的表达水平比较差异均无统计学意义(P > 0.05),见表 2。
| 表 2 不同年龄段患儿外周血Treg和NKT水平比较(%) |
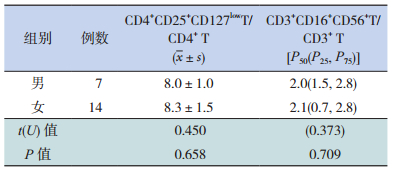
2.3 病例组不同性别患儿外周血Treg和NKT水平比较
不同性别肾母细胞瘤患儿外周血Treg和NKT的表达水平比较差异无统计学意义(P > 0.05),见表 3。
| 表 3 不同性别患儿外周血Treg和NKT水平比较(%) |
2.4 病例组患儿外周血中Treg和NKT水平相关性分析
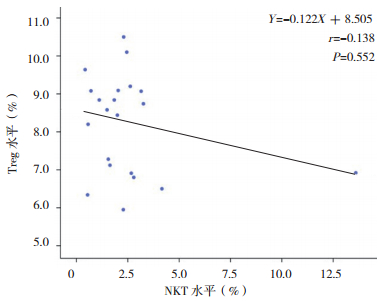
Treg水平和NKT水平无明显相关性(r=-0.138,P=0.552),见图 3。
|
图 3 Treg水平和NKT水平相关性分析图 |
3 讨论
Treg是具有免疫负调控功能的T细胞亚群,在维持自身免疫耐受的同时,也可能阻止机体对自体同源肿瘤细胞的免疫,导致肿瘤的免疫抑制及免疫逃逸[5]。Treg有许多分子标志物,如Foxp3、CTLA-4、GITR、CD127,其中Foxp3被公认为Treg的特异性标志。但许多活化的和不具有抑制功能的细胞也表达Foxp3,且不清楚是否所有表达Foxp3的T细胞都具有抑制功能[6]。CD127作为Treg的另一标志物,在Treg中低表达,Hartigan-O'Connor等[7]用CD4、CD25、CD127三色抗体标记发现,人类、鼠及短尾猴外周血存在群体清晰的CD4+CD25+CD127low T细胞,它们高表达Foxp3和CTLA-4,并且发现其具有抑制性、低增殖性和对T细胞受体信号的低反应性。因此,检测CD4+CD25+CD127low T细胞水平可以准确识别Treg。
NKT是肿瘤免疫研究的另一个热点,它是既能表达T细胞受体αβ链,又能表达NK细胞受体(如NK1.1)的T淋巴细胞亚群,其细胞表面的分子表型以CD3+、CD16+和CD56+为特征[8-9]。近年来NKT的抗肿瘤效应日益受到国内外学者的重视,体外实验及肿瘤动物模型的研究显示,NKT可通过发挥细胞毒效应杀伤肿瘤细胞,尤其在血液性肿瘤如非霍奇金淋巴瘤、白血病等[10-11],可见NKT在肿瘤免疫中有重要作用。
本研究结果表明,肾母细胞瘤患儿外周血中Treg水平较健康对照组显著降低,NKT水平较健康对照组显著升高,这种改变与患儿的性别、年龄无明显相关性。
肾母细胞瘤患儿外周血中Treg水平降低,这种改变和成人恶性肿瘤不同[2, 12],可能是由于肾母细胞瘤是一种胚胎性肿瘤,与成人恶性肿瘤组织来源不同,同时儿童的免疫系统尚未成熟,肿瘤作为一个异物很容易对儿童的免疫系统产生抑制作用,从而导致Treg水平降低。Treg主要是通过直接细胞接触或分泌调节性细胞因子主动抑制自身免疫细胞的活化,由于患儿Treg水平降低,使机体对效应T细胞的抑制作用减弱,不能有效防御自身免疫反应的发生。同时,由于Treg减少,其分泌的细胞因子也会明显降低,如IL-10、转化生长因子β(TGF-β)[13],从而导致免疫平衡失调,促进肾母细胞瘤的发生发展。由此推断儿童肾母细胞瘤的发病与自身免疫的失衡有重要关系,这种机制与成人肿瘤的发病机制有明显差异,而肾母细胞瘤患儿外周血Treg水平降低证实了这种差异存在的可能性。同时,Treg水平的改变导致自身免疫失衡可能是儿童肾母细胞瘤发病的原因之一,但是目前仍缺少相关研究的报道,需要进一步研究探讨。
肾母细胞瘤患儿外周血中NKT水平增高,反映了机体抗肿瘤的免疫反应增强[14]。研究发现,NKT在抗肿瘤免疫中起重要作用,它们不仅能直接杀伤肿瘤细胞,还能够产生大量细胞因子,如干扰素-γ(IFN-γ)、IL-2、IL-4、IL-13、IL-17、TGF-β等[15],可促使CD4+ T淋巴细胞发生不同方向的细胞分化,参与多种疾病的免疫调节如自身免疫性疾病、肿瘤性疾病、感染及过敏性疾病等[16-18]。肾母细胞瘤患儿外周血NKT水平增高,表明在肾母细胞瘤肿瘤微环境中也可能存在上述现象,细胞免疫功能促进激活NKT,NKT发挥了抗肿瘤的功能[19]。因此推断在肾母细胞瘤发病之后,患儿体内的细胞免疫功能激活,NKT水平增高发挥了肿瘤免疫作用,一定程度上影响了肾母细胞瘤的发展,但是由于NKT水平低下,其抗肿瘤效应比较局限,提示增加肾母细胞瘤中的NKT水平,可能有助于增强患儿的抗肿瘤效应。
本研究结果显示,Treg水平降低和NKT水平增高无明显相关性。但是有研究发现[20],在过敏性哮喘患者中NKT表达NKp30和NKp46受体水平增加,穿孔素和颗粒酶B的表达也增加,其细胞毒性增强,对抗Treg功能,而非过敏性哮喘患者没有以上表现,表明NKT能够抑制Treg功能以控制疾病免疫反应。本研究中肾母细胞瘤患儿外周血NKT水平增高伴随Treg水平降低,表明在肾母细胞瘤中可能也存在上述现象,NKT有抑制Treg的作用,两者可能存在相互作用[21]。
综上所述,Treg和NKT参与了儿童肾母细胞瘤的发生和发展,Treg和NKT是反映肾母细胞瘤患儿免疫功能状态的较好指标,检测患儿外周血中Treg和NKT水平有助于病情监测,对于疾病的发展和预后有重要价值。同时,改变两种细胞水平的临床治疗方法可能对肾母细胞瘤有治疗效果,但是其中的机制有待进一步研究。
| [1] | Pastore G, Znaor A, Spreafico F, et al. Malignant renal tumours incidence and survival in European children (1978-1997):report from the Automated Childhood Cancer Information System project[J]. Eur J Cancer , 2006, 42 (13) : 2103–2114. DOI:10.1016/j.ejca.2006.05.010 |
| [2] | Lin YC, Mahalingam J, Chiang JM, et al. Activated but not resting regulatory T cells accumulated in tumor microenvironment and correlated with tumor progression in patients with colorectal cancer[J]. Int J Cancer , 2013, 132 (6) : 1341–1350. DOI:10.1002/ijc.27784 |
| [3] | Bendelac A, Savage PB, Teyton L. The biology of NKT cells[J]. Annu Rev Immunol , 2007, 25 : 297–336. DOI:10.1146/annurev.immunol.25.022106.141711 |
| [4] | Rijavec M, Volarevic S, Osolnik K, et al. Natural killer T cells in pulmonary disorders[J]. Respir Med , 2011, 105 Suppl 1 : S20–S25. |
| [5] | Sakaguchi S, Miyara M, Costantino CM, et al. FOXP3+ regulatory T cells in the human immune system[J]. Nat Rev Immunol , 2010, 10 (7) : 490–500. DOI:10.1038/nri2785 |
| [6] | Allan SE, Passerini L, Bacchetta R, et al. The role of 2 FOXP3 isoforms in the generation of human CD4+ Tregs[J]. J Clin Invest , 2005, 115 (11) : 3276–3284. DOI:10.1172/JCI24685 |
| [7] | Hartigan-O'Connor DJ, Poon C, Sinclair E, et al. Human CD4+ regulatory T cells express lower levels of the IL-7 receptor alpha chain (CD127), allowing consistent identification and sorting of live cells[J]. J Immunol Methods , 2007, 319 (1-2) : 41–52. DOI:10.1016/j.jim.2006.10.008 |
| [8] | Joshi SK, Lang ML. Fine tuning a well-oiled machine:Influence of NK1.1 and NKG2D on NKT cell development and function[J]. Int Immunopharmacol , 2013, 17 (2) : 260–266. DOI:10.1016/j.intimp.2013.05.022 |
| [9] | Das R, Tripathy A. Increased expressions of NKp44, NKp46 on NK/NKT-like cells are associated with impaired cytolytic function in self-limiting hepatitis E infection[J]. Med Microbiol Immunol , 2014, 203 (5) : 303–314. DOI:10.1007/s00430-014-0338-1 |
| [10] | Gibson SE, Swerdlow SH, Felgar RE. Natural killer cell subsets and natural killer-like T-cell populations in benign and neoplastic B-cell proliferations vary based on clinicopathologic features[J]. Hum Pathol , 2011, 42 (5) : 679–687. DOI:10.1016/j.humpath.2010.07.023 |
| [11] | Hus I, Staroslawska E, Bojarska-junak A, et al. CD3+/CD16+CD56+ cell numbers in peripheral blood are correlated with higher tumor burden in patients with diffuse large B-cell lymphoma[J]. Folia Histochem Cytobiol , 2011, 49 (1) : 183–187. DOI:10.5603/FHC.2011.0025 |
| [12] | Schreiber TH, Wolf D, Bodero M, et al. Tumor antigen specific iTreg accumulate in the tumor microenvironment and suppress therapeutic vaccination[J]. Oncoimmunology , 2012, 1 (5) : 642–648. DOI:10.4161/onci.20298 |
| [13] | Reduta T, Stasiak-Barmuta A, Laudańska H. CD4+CD25+ and CD4+CD25high regulatory T cells in disseminated and localized forms of allergic contact dermatitis:relation to specific cytokines[J]. Folia Histochem Cytobiol , 2011, 49 (2) : 255–262. DOI:10.5603/FHC.2011.0035 |
| [14] | Exley MA, Lynch L, Varghese B, et al. Developing understanding of the roles of CD1d-restricted T cell subsets in cancer:reversing tumor-induced defects[J]. Clinical Immunol , 2011, 140 (2) : 184–195. DOI:10.1016/j.clim.2011.04.017 |
| [15] | Obata F, Subrahmanyam PB, Vozenilek AE, et al. Natural killer T (NKT) cells accelerate Shiga toxin type 2(Stx2) pathology in mice[J]. Front Microbiol , 2014, 6 : 262. |
| [16] | Tan JQ, Xiao W, Wang L, et al. Type I natural killer T cells:naturally born for fighting[J]. Acta Pharmacol Sin , 2010, 31 (9) : 1123–1132. DOI:10.1038/aps.2010.119 |
| [17] | Brennan PJ, Brigl M, Brenner MB. Invariant natural killer T cells:an innate activation scheme linked to diverse effector functions[J]. Nat Rev Immunol , 2013, 13 (2) : 101–117. DOI:10.1038/nri3369 |
| [18] | 杨德娟, 韩波. IL-21及其受体在自身免疫性疾病中的作用[J]. 中国当代儿科杂志 , 2016, 18 (5) : 466–471. |
| [19] | 王晓梦, 于津浦, 李慧, 等. IL-2+IL-15组合培养方案对乳腺癌患者外周血中NK细胞体外扩增的效果[J]. 中国肿瘤生物治疗杂志 , 2013, 20 (6) : 654–660. |
| [20] | Nguyen KD, Vanichsarn C, Nadeau KC. Increased cytotoxicity of CD4+ invariant NKT cells against CD4+CD25hiCD127lo-regulatory T cells in allergic asthma[J]. Eur J Immunol , 2008, 38 (7) : 2034–2045. DOI:10.1002/(ISSN)1521-4141 |
| [21] | Terabe M, Berzofsky JA. The immunoregulatory role of type I and type Ⅱ NKT cells in cancer and other diseases[J]. Cancer Immunol Immunother , 2014, 63 (3) : 199–213. DOI:10.1007/s00262-013-1509-4 |
 2016, Vol. 18
2016, Vol. 18