呼吸窘迫综合征(RDS)是早产儿需要辅助通气的主要原因,其导致的气压伤、容量伤、吸入氧浓度过高、时间过长及炎症反应激活等均可引起肺的损伤[1],故近年来主张早期应用肺表面活性物质(PS)、产房内经鼻持续气道正压给氧(NCPAP)支持以及肺保护性通气策略等措施以减少肺损伤的发生。此外,咖啡因的使用也越来越受关注,它不仅能有效治疗早产儿呼吸暂停(AOP),还有助于撤离呼吸机,减少支气管肺发育不良(BPD)、动脉导管开放(PDA)的发生[2],机械通气的RDS早产儿越早给予咖啡因治疗益处越大[3]。欧美在早产儿呼吸管理方面已进入了咖啡因时代,97年时欧洲仅50%的NICU在超低出生体重儿的治疗中使用咖啡因,而到2011年则达到96.8%[4]。咖啡因进入国内临床应用的时间较晚,目前研究多集中在AOP方面,而它早期应用能否对早产儿的肺产生影响、减少早产儿对呼吸机的需求?现国内尚无该方面的报道。因此,本研究拟通过前瞻性临床对照分析比较早期应用咖啡因对RDS早产儿在呼吸机参数的需求、呼吸机撤离及相关并发症等方面的影响。
1 资料与方法 1.1 研究对象2014年1月至2016年2月本院新生儿科收治的生后早期因RDS需气管插管机械通气的早产儿59例,采用随机数字表法分为咖啡因组(n=30)和对照组(n=29)。咖啡因组患儿于生后12~24 h内开始予咖啡因治疗,对照组患儿在计划拔管前4~6 h开始予咖啡因治疗(目的在于防治AOP)。
纳入标准:(1)孕周27~33+6周,出生体重 < 1 500 g,生后早期因RDS需气管插管辅助通气;(2)符合RDS诊断标准[5]。
排除标准:(1)合并有先天性畸形(如先天性心脏病、膈疝、高度怀疑先天性呼吸系统畸形等)及先天代谢性疾病等;(2)其他非RDS、非先天性疾病但严重影响呼吸的疾病(如严重感染性休克、严重窒息、Ⅲ级及以上颅内出血等);(3)未达到相应评估时间前放弃治疗者。
本研究获得医院药事及伦理委员会批准及家属书面知情同意。
1.2 呼吸机管理策略(1)气管插管机械通气指征:确诊RDS患儿伴有呼吸困难表现;血气提示呼吸衰竭;早期NCPAP通气下吸入氧浓度(FiO2) > 50%,血气仍提示呼吸衰竭或有频繁AOP者[5-6]。
(2)机械通气策略:应用德国Stephan呼吸机SIMV模式通气,参数设置采用肺保护性通气策略[7]:即采用最低的气道压力、最低的FiO2,使经皮血氧饱和度(SpO2)维持在90%~95%之间(除外因护理操作如吸痰、动静脉穿刺等需短暂提高FiO2的情况),目标血气控制在:血pH > 7.25,PCO2维持在45~60 mm Hg,PO2维持在50~70 mm Hg之间。
(3)拔管及撤机指征:患儿自主呼吸良好,呼吸机吸气峰压(PIP)≤15 cm H2O,呼气末正压(PEEP)≤4 cm H2O,FiO2≤35%以下[5],拔管后无明显呼吸困难,血气在控制目标内。拔管后常规予NCPAP通气(压力5~7 cm H2O,FiO2 25%~40%),至气道压力≤3 cm H2O,FiO2 < 30%,自主呼吸良好,无严重AOP发生可撤离。
1.3 PS的应用及其他常规治疗两组所有患儿均在生后6 h内给予PS 200 mg/kg(固尔苏,凯西制药公司)进行替代治疗,根据病情必要时可在12 h后再次使用,剂量同前;其余如抗感染、维持有效循环灌注及静脉营养等对症支持治疗。
1.4 咖啡因使用方法咖啡因组于生后12~24 h开始应用枸橼酸咖啡因(凯西制药公司)静脉推注,首次剂量20 mg/kg,24 h后以每日8 mg/kg维持,对照组在计划拔管前4~6 h开始应用咖啡因,剂量同咖啡因组。
1.5 相关并发症的定义及诊断:(1)PDA:有血流动力学影响的PDA可通过心脏超声诊断,需满足以下标准:①证实存在左向右分流;②LA/AO比值 > 1.3;③导管直径 > 1.5 mm;④心室舒张期主动脉存在双向分流[8]。
(2)BPD:是指任何氧依赖( > 21%)超过28 d的新生儿,如胎龄 < 32周,根据纠正胎龄(PMA)36周或出院时需FiO2分为:轻度(未用氧)、中度(FiO2 < 30%)、重度(FiO2≥30%或需机械通气)。如胎龄≥32周,根据生后56 d或出院时需FiO2分为上述轻、中、重度[5]。
(3)AOP:指呼吸停止时间 > 20 s,伴有心率减慢 < 100次/min或出现青紫、血氧饱和度降低和肌张力低下[5]。
(4)呼吸机相关性肺炎(VAP):根据美国疾病预防和控制中心(CDC)定义[9],VAP指原无肺部感染的患儿,在气管导管辅助呼吸48 h后发生肺部感染,或原有肺部感染,机械通气治疗48 h以上发生新的肺部感染。
1.6 观察指标:(1)一般资料:性别、胎龄、出生体重、RDS分期、产前激素应用及是否合并感染(如患儿外周血白细胞明显升高/低下、CRP增高、痰或血标本病原学培养阳性或产前母亲感染证据)等;
(2)呼吸机参数:最高PIP、PEEP及FiO2的值,插管通气、NCPAP及需氧的时间;
(3)并发症:PDA、BPD、气漏综合征(如气胸、纵膈气肿等)及VAP等;
(4)AOP:拔管后首次AOP发生的时间(h)、拔管第1~2 d、第5~7 d发生AOP的平均次数。
1.7 统计学分析运用SPSS 20.0统计软件进行分析,计量资料以均数±标准差(x±s)表示,组间比较采用t检验;计数资料以率(%)表示,组间比较采用卡方检验。P < 0.05为差异有统计学意义。
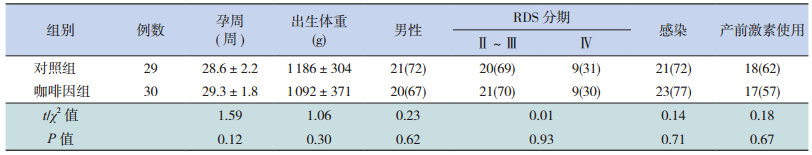
2 结果 2.1 一般资料两组患儿在胎龄、体重及性别组成、RDS分期(X线)、产前激素应用情况及是否合并感染等方面的差异均无统计学意义(P > 0.05),此外,两组所有患儿均于生后6 h内应用PS替代治疗。见表 1。
| 表 1 两组一般资料的比较[(x±s)或n(%)] |
2.2 呼吸机应用情况
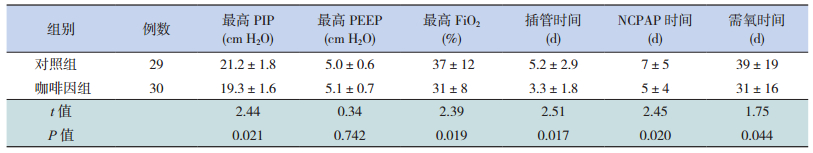
咖啡因组最高PIP和最高FiO2均明显低于对照组(P < 0.05),两组最高PEEP值差异无统计学意义(P=0.742);咖啡因组平均插管时间、拔管后NCPAP时间和需氧时间均明显短于对照组,差异有统计学意义(P < 0.05)。见表 2。
| 表 2 两组呼吸机使用及参数情况的比较(x±s) |
2.3 并发症及AOP情况
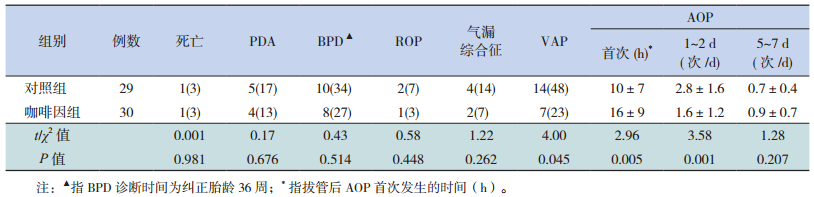
两组病死率、PDA、ROP、气漏综合征及纠正胎龄36周时BPD的发生率比较差异均无统计学意义(P > 0.05),咖啡因组VAP的发生率低于对照组(P=0.045);咖啡因组拔管后首次AOP发生时间晚于对照组(P=0.005),拔管后第1~2天AOP的发生次数明显少于对照组(P=0.001),至第5~7天时两组AOP的发生次数差异无统计学意义(P=0.207)。见表 3。
| 表 3 两组并发症及拔管后AOP情况比较[(x±s)或n(%)] |
3 讨论
咖啡因与氨茶碱同为甲基黄嘌呤类药物,但咖啡因有每日单次给药、生物利用度高、中枢浓度高、起效快、安全剂量范围大及不良反应小等优点[10-11],成为国外治疗AOP的首选。咖啡因的药理作用包括:刺激延髓呼吸中枢,增加化学感受器对O2、CO2的敏感性;增强呼吸肌功能;扩张支气管,降低气道助力,增加分钟通气量;提高儿茶酚胺分泌,增强心脏输出功能;具有利尿作用及神经保护等[2]。Dobson等[12]报道生后早期( < 3 d)应用咖啡因能够减少早产儿机械通气的时间,降低BPD的发生。Patel等[13]的研究也发现,早期咖啡因治疗能使机械通气时间缩短12 d,且不论早期或晚期使用,大部分病人能在使用后4~5 d内成功拔管,这表明咖啡因在短期内就有改善肺功能的作用。
研究报道咖啡因治疗仅6 h,早产儿肺内的功能残气量、呼/吸气末的最大压力均有明显的升高,同时气道阻力降低,肺顺应性好转,RDS患儿所需呼吸机的PIP也较咖啡因应用前下降[14];生后1 h内应用咖啡因,能使患RDS的早产狒狒在12~24 h时对呼吸机参数的PIP及FiO2的需求下降,24 h时血气指标也有明显好转,同时观察到咖啡因治疗组24 h内尿量增加两倍[15]。本研究发现,早期(生后12~24 h)应用咖啡因能够降低RDS早产儿对呼吸机参数的需求,最高PIP的水平明显降低,咖啡因组拔管时间提前、NCPAP时间和呼吸机总时间缩短。这种作用的机制尚不明确,推测可能是通过利尿、调整液体平衡状态,改善肺部的顺应性、增强呼吸中枢的驱动力及呼吸肌力量等方面起作用[2, 13]。
高浓度氧产生的氧自由基也可引起肺损伤,高氧可破坏肺泡结构,影响肺血管发育,生命早期的高氧暴露与远期的肺损伤和呼吸道感染有密切关系[16]。以往认为早产儿的最佳FiO2是使SpO2维持在88%~93%之间,但更多的研究表明使SpO2维持在90%~95%之间对早产儿远期的预后更加有利[17]。本研究发现,早期咖啡因应用能减少RDS早产儿对氧的需求,无论是在机械通气时的需氧浓度上还是在总需氧时间上均较对照组明显降低。动物研究发现,咖啡因能够减轻高氧暴露引起的肺部炎症反应,使肺组织白细胞介素、趋化因子以及前炎症细胞因子等的表达明显减少[18];同时还能减轻高氧介导的肺泡结构的损伤[19]。此外,咖啡因能够通过增加化学感受器对低氧血症的敏感性,刺激呼吸,增加分钟通气量,这或许降低了机体对氧的需求。
目前新生儿VAP的诊断尚无统一标准,各地报道的VAP发生率不一,荟萃分析显示NICU的VAP发生率为42.8%(95% CI 39.8%~45.9%)[20]。本研究中,咖啡因组VAP的发生率明显降低,这可能与减少气管插管及机械通气的时间有关。也有研究表明咖啡因能减轻肺部炎性渗出,使肺泡灌洗液中的中性粒细胞的数量减少[18, 21],可能是通过阻断2型-腺苷受体参与的肺炎症渗出及肺泡重构等起作用[22]。可见,机械通气早期辅助应用咖啡因能减少插管时间,减轻肺部炎性渗出及肺结构损伤,从而减少VAP的发生。
Schmidt等[23]报道,咖啡因治疗能使PDA的干预率明显低于安慰剂组(29% vs 38%),BPD的发生率也明显降低(36.3% vs 43.2%)。另一项Meta分析也表明,早期应用咖啡因不论是总体死亡率、BPD的发生率或BPD和死亡率均明显低于晚期应用[24]。本研究中两组BPD、PDA以及ROP的发生率差异均无统计学意义,这与文献报道[23]不一致,可能是本研究对象的平均孕周、体重均较大,BPD和PDA的发生率相对较低,这也提示在孕周更小、体重更低的早产儿中早期应用咖啡因的益处或许更明显;且BPD的发生还与后期多种因素有关(如营养、感染等等);另外,本研究的样本数量小,效果还有待更多的病例待进一步证实。
研究显示咖啡因对AOP的预防作用明显优于氨茶碱[25]。本研究中,两组患儿均在拔管前使用咖啡因,但早期咖啡因组拔管后首次AOP的发生时间明显延长,拔管第1、2天时AOP的次数明显减少,随着体内的咖啡因血药浓度趋于稳定,第5~7天时两组AOP的发生情况无差别。可见,早期应用咖啡因对拔管后AOP的预防作用可能更强。
综上可见,早期应用咖啡因治疗能够降低RDS早产儿对呼吸机参数的需求,有助于更早拔管、撤离呼吸机,减少VAP,更好地预防AOP的发生。国外报道还能减少BPD的发生,这或许值得临床推广应用,但确切的疗效仍需更多的病例及多中心的临床对照研究证实。
| [1] | Carvalho CG, Silveira RC, Procianoy RS. Ventilator-induced lung injury in preterm infants[J]. Rev Bras Ter Intensiva , 2013, 25 (4) : 319–326. |
| [2] | Abdel-Hady H, Nasef N, Shabaan AE, et al. Caffeine therapy in preterm infants[J]. World J Clin Pediatr , 2015, 4 (4) : 81–93. DOI:10.5409/wjcp.v4.i4.81 |
| [3] | Davis PG, Schmidt B, Roberts RS, et al. Caffeine for apnea of prematurity trial:benefits may vary in subgroups[J]. J Pediatr , 2010, 156 (3) : 382–387. DOI:10.1016/j.jpeds.2009.09.069 |
| [4] | Gerull R, Manser H, Küster H, et al. Increase of caffeine and decrease of corticosteroids for extremely low-birthweight infants with respiratory failure from 1997 to 2011[J]. Acta Paediatr , 2013, 102 (12) : 1154–1159. DOI:10.1111/apa.2013.102.issue-12 |
| [5] | 邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学[M].第4版. 北京: 人民卫生出版社, 2011 . |
| [6] | Gharehbaghi MM, Peirovifar A, Ghojazadeh M. Risk factors contributing to the failure of surfactant administration with INSURE method[J]. J Pioneer Med Sci , 2014, 4 (2) : 55–59. |
| [7] | Habre W. Neonatal ventilation[J]. Best Pract Res Clin Anaesthesiol , 2010, 24 (3) : 353–364. DOI:10.1016/j.bpa.2010.02.020 |
| [8] | Lago P, Bettiol T, Salvadori S, et al. Safety and efficacy of ibuprofen versus indomethacin in preterm infants treated for patent ductus arteriosus:a randomised controlled trial[J]. Eur J Pediatr , 2002, 161 (4) : 202–207. DOI:10.1007/s00431-002-0915-y |
| [9] | Geffers C, Baerwolff S, Schwab F, et al. Incidence of healthcare-associated infections in high-risk neonates:results from the German surveillance system for very-low-birthweight infants[J]. J Hosp Infect , 2008, 68 (3) : 214–221. DOI:10.1016/j.jhin.2008.01.016 |
| [10] | Abu Jawdeh EG, O'Riordan M, Limrungsikul A, et al. Methylxanthine use for apnea of prematurity among an international cohort of neonatologists[J]. J Neonatal Perinatal Med , 2013, 6 (3) : 251–256. |
| [11] | Picone S, Bedetta M, Paolillo P. Caffeine citrate:when and for how long. A literature review[J]. J Matern Fetal Neonatal Med , 2012, 25 Suppl 3 : 11–14. |
| [12] | Dobson NR, Patel RM, Smith PB, et al. Trends in caffeine use and association between clinical outcomes and timing of therapy in very low birth weight infants[J]. J Pediatr , 2014, 164 (5) : 992–998. DOI:10.1016/j.jpeds.2013.12.025 |
| [13] | Patel RM, Leong T, Carlton DP, et al. Early caffeine therapy and clinical outcomes in extremely preterm infants[J]. J Perinatol , 2013, 33 (2) : 134–140. DOI:10.1038/jp.2012.52 |
| [14] | Kassim Z, Greenough A, Rafferty GF. Effect of caffeine on respiratory muscle strength and lung function in prematurely born, ventilated infants[J]. Eur J Pediatr , 2009, 168 (12) : 1491–1495. DOI:10.1007/s00431-009-0961-9 |
| [15] | Yoder B, Thomson M, Coalson J. Lung function in immature baboons with respiratory distress syndrome receiving early caffeine therapy:a pilot study[J]. Acta Paediatr , 2005, 94 (1) : 92–98. DOI:10.1080/08035250410023160 |
| [16] | Domm W, Misra RS, O'Reilly MA. Affect of early life oxygen exposure on proper lung development and response to respiratory viral infections[J]. Front Med (Lausanne) , 2015, 2 : 55. |
| [17] | Darlow BA, Marschner SL, Donoghoe M, et al. Randomized controlled trial of oxygen saturation targets in very preterm infants:two year outcomes[J]. J Pediatr , 2014, 165 (1) : 30–35. DOI:10.1016/j.jpeds.2014.01.017 |
| [18] | Weichelt U, Cay R, Schmitz T, et al. Prevention of hyperoxia-mediated pulmonary inflammation in neonatal rats by caffeine[J]. Eur Respir J , 2013, 41 (4) : 966–973. DOI:10.1183/09031936.00012412 |
| [19] | Nagatomo T, Jiménez J, Richter J, et al. Caffeine prevents hyperoxia-induced functional and structural lung damage in preterm rabbits[J]. Neonatology , 2016, 109 (4) : 274–281. DOI:10.1159/000442937 |
| [20] | Tan B, Xian-Yang X, Zhang X, et al. Epidemiology of pathogens and drug resistance of ventilator-associated pneumonia in Chinese neonatal intensive care units:a meta-analysis[J]. Am J Infect Control , 2014, 42 (8) : 902–910. DOI:10.1016/j.ajic.2014.05.007 |
| [21] | Chavez-Valdez R, Wills-Karp M, Ahlawat R, et al. Caffeine modulates TNF-alpha production by cord blood monocytes:the role of adenosine receptors[J]. Pediatr Res , 2009, 65 (2) : 203–208. DOI:10.1203/PDR.0b013e31818d66b1 |
| [22] | Rivkees SA, Wendler CC. Adverse and protective influences of adenosine on the newborn and embryo:implications for preterm white matter injury and embryo protection[J]. Pediatr Res , 2011, 69 (4) : 271–278. DOI:10.1203/PDR.0b013e31820efbcf |
| [23] | Schmidt B, Roberts RS, Davis P, et al. Long-term effects of caffeine therapy for apnea of prematurity[J]. N Engl J Med , 2007, 357 (19) : 1893–1902. DOI:10.1056/NEJMoa073679 |
| [24] | Park HW, Lim G, Chung SH, et al. Early caffeine use in very low birth weight infants and neonatal outcomes:A systematic review and Meta-analysis[J]. J Korean Med Sci , 2015, 30 (12) : 1828–1835. DOI:10.3346/jkms.2015.30.12.1828 |
| [25] | Skouroliakou M, Bacopoulou F, Markantonis SL. Caffeine versus theophylline for apnea of prematurity:a randomised controlled trial[J]. J Paediatr Child Health , 2009, 45 (10) : 587–592. DOI:10.1111/jpc.2009.45.issue-10 |
 2016, Vol. 18
2016, Vol. 18