枫糖尿病(maple syrup urine disease, MSUD)为氨基酸代谢病的一种,又称支链酮酸尿症,是由于催化亮氨酸、异亮氨酸和缬氨酸的支链α-酮酸脱氢酶(branched chain alpha-ketoacid dehydrogenase,BCKDH)复合体功能缺陷,使得支链氨基酸(branched chain amino acids,BCAA)转氨形成的相应支链α-酮酸(branched chain alpha-ketoaeid, BCKA)不能进行氧化脱羧,导致体内的BCAA和BCKA异常增高。BCAA如亮氨酸、异亮氨酸、缬氨酸大量蓄积对脑组织产生神经毒性作用,导致脑白质病变;而BCKA可从尿及体液中排出,因而出现类似枫糖浆的气味。MSUD于1954年由Menkes等[1]最早报道,国外统计其发病率为1/12万~1/50万不等[2],国内相关报道不多[3],特别是双胎同时发病者未见报道。本研究对枫糖尿病双胎新生儿的临床资料进行分析,并对患儿及其父母进行相关基因测序分析,寻找发病的分子遗传学证据。
1 资料与方法 1.1 研究对象病例1:患儿,女,汉族,8 d,双胎之大,因腹胀、拒乳1 d入院。患儿为第3胎第2产,胎龄37+4周,剖宫产出生,出生体重2 800 g,出生无窒息史,脐带、羊水、胎盘无异常。生后2 h开始配方奶喂养。
父母亲均24岁,农民,非近亲婚配,身体健康。
体格检查:T 36.5℃,P 128次/min,R 38次/min,体重2 740 g。足月新生儿貌,刺激反应差。颜面部、躯干部皮肤轻微黄染,前囟平软。心肺听诊无异常。腹膨隆,肝肋下2.0 cm、剑突下2.0 cm,质软,肠鸣音4次/min,四肢肌张力高,吸吮反射、觅食反射、拥抱反射减弱。
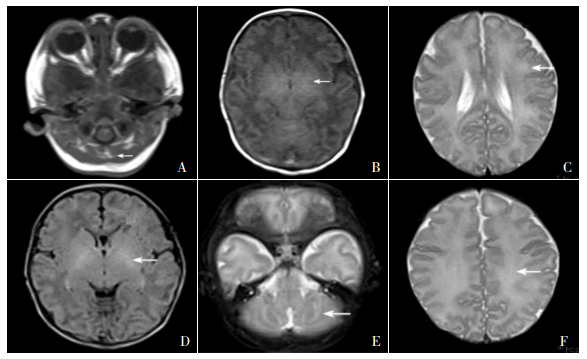
辅助检查:血常规WBC 24.5×109/L(正常值:10~15×109/L)、淋巴细胞比率35.5%、中性粒细胞比率58.9%,HGB 180 g/L(正常值:145~220 g/L)、PLT 326×109/L(正常值:125~350×109/L)。尿常规:酮体2+、pH 6.0。粪常规正常。肝肾功能、心肌酶、血糖及电解质均正常,血气分析提示代偿性代谢性酸中毒。脑脊液检查正常。血酮体5.20 mg/dL(正常值:0~3.12 mg/dL)。X片提示肺炎,肠腔积气、扩张。头部MRI:双侧小脑半球齿状核、脑干、基底节区及双侧放射冠至皮质区对称性异常信号:代谢性脑病可能性大(图 1A~C)。入院第2天采血行串联质谱检测,显示亮氨酸为3 471μmol/L(正常值: < 375 μmol/L)、缬氨酸561μmol/L(正常值: < 325 μmol/L)。
|
图 1 双胎患儿头部MRI 图 1A~C:双胎之大第9天头部MRI。双侧小脑半球齿状核(图 1A)、基底节区(图 1B)、双侧放射冠至皮层区(图 1C)对称性片状等T1、略长T2异常信号(箭头所示),边缘模糊。图 1D~F:双胎之小第10天头部MRI。基底节丘脑(图 1D)、双小脑半球(图 1E)、放射冠(图 1F)对称性片状长T1低信号、长T2高信号(箭头所示)。 |
治疗经过:入院后予配方奶喂养、控制感染,第2天出现反复抽搐,呼吸浅慢,尿液有枫糖浆气味,予苯巴比妥钠镇静,甘露醇降颅压,神经节苷脂营养脑细胞等治疗;结合血串联质谱检测结果,入院第3天临床诊断为枫糖尿病,予去除BCAA的特殊配方奶粉喂养及维生素B1口服,病情无改善;入院第5天患儿家长要求放弃治疗,出院后死亡。
病例2:患儿,男,8 d,因拒乳、发热5 h入院。患儿为第3胎第2产,胎龄37+4周剖宫产出生,系双胎之小,出生体重2 130 g,生后无窒息史,脐带、羊水、胎盘无异常。患儿生后2 h开始配方奶喂养,入院前5h出现拒乳、嗜睡、发热。体格检查:T 37.4℃,P 130次/min,R 42次/min,体重2 300 g。足月新生儿貌,刺激反应差,颜面部、躯干部皮肤轻微黄染,前囟平软。心肺听诊无异常。腹略膨隆,肝肋下1.5 cm、质软,肠鸣音5次/min。肌张力可,吸吮反射、觅食反射、拥抱反射减弱。
辅助检查:血常规正常。尿常规:酮体3+、pH 6.0。粪常规正常。肝肾功能、心肌酶、血糖及电解质均正常。血碳酸氢盐10.5 mmol/L(正常值:22~27 mmol/L),提示代谢性酸中毒。血酮体9.5 mg/dL(正常值:0~3.12mg/dL);血氨69 μmol/L(正常值:9~33 μmol/L)。头部MRI:双侧半卵圆中心、放射冠、基底节、丘脑、脑干及双小脑半球对称性异常信号,考虑代谢性疾病(图 1D~F)。入院第2天采血行串联质谱检测,显示亮氨酸2 971.6 μmol/L(正常值: < 375 μmol/L)、缬氨酸500 μmol/L(正常值 < 325 μmol/L),均显著升高。
治疗经过:入院后予配方奶喂养及控制感染、补液等对症支持等治疗,第2天体温正常并发现尿液有枫糖浆气味;结合血串联质谱检测结果,于第3天临床诊断为枫糖尿病,给予去除BCAA的特殊配方奶粉喂养及维生素B1口服,病情无改善;入院第5天患儿家长要求放弃治疗,出院后患儿死亡。
追问病史:家系第1胎,男,生后7 d因拒乳、呕吐、嗜睡、惊厥于当地医院住院,生后13 d死亡;血串联质谱检测显示:亮氨酸3 478 μmol/L(正常值: < 375 μmol/L)、缬氨酸600μmol/L(正常值: < 325 μmol/L),均显著升高,支持枫糖尿病。家系第2胎于母亲妊娠早期流产。
1.2 基因组DNA提取取得患儿父母知情同意,采集双胎患儿及其父母外周血各2 mL,乙二胺四乙酸钠(EDTA)抗凝,采用Gentra Puregene Blood Kit(Qiagen公司生产)提取基因组DNA,提取后使用Nanodrop 2000蛋白核酸分析仪检测DNA浓度及纯度,确保DNA总量大于2 500 ng,A260/A280在1.8~2.0再进行后续实验。
1.3 分子遗传学检测进行枫糖尿病相关基因(BCKDHA,BCKDHB,DBT,DLD)的外显子编码区直接基因测序,并与参考序列做对比。4个基因参考序列分别为BCKDHA:NM_000709.3与NC_000019.9;BCKDHB:NM_000056.3与NC_000006.11;DBT:NM_001918.2与NC_0000001.10;DLD:NG_008045.1与NM_000108.4。
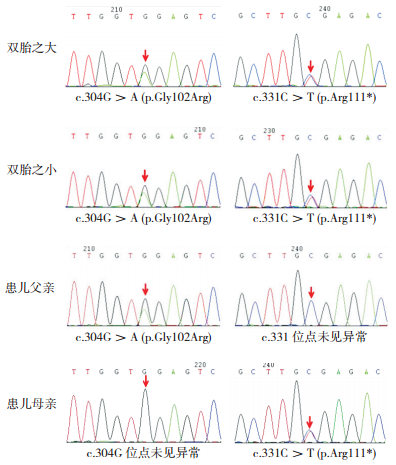
2 结果基因测序结果显示,双胎患儿在BCKDHB基因均发现2个突变:错义突变c.304G > A(p.Gly102Arg)和无义突变c.331C > T(p.Arg111*),均为杂合子,且c.304G > A(p.Gly102Arg)为国际上未报道过的新突变,在ESP6500、dbSNP、千人基因组数据库和HGMD数据库里均未见报道;而在BCKDHA,DBT和DLD基因的编码区未发现突变。对患儿父母的样本进行BCKDHB基因的c.304G、c.331C位点测序,发现患儿父亲携带了错义突变c.304G > A(p.Gly102Arg),患儿母亲携带了无义突变c.331C > T(p.Arg111*),均为杂合突变。见图 2。
|
图 2 双胎患儿及其父母基因测序结果 双胎患儿在BCKDHB基因发现错义突变c.304G>A(p.Gly102Arg)和无义突变c.331C>T(p.Arg111*);患儿父亲在BCKDHB基因发现错义突变c.304G>A(p.Gly102Arg),患儿母亲在BCKDHB基因发现无义突变c.331C>T(p.Arg111*)。箭头示突变位点。 |
3 讨论
MSUD是一种相对少见的氨基酸代谢病,主要分5型:经典型(新生儿型)、中间型、间歇型、维生素B1反应型、二氢脂酰脱氢酶缺乏型。新生儿期发病者常为经典型,患儿出生时大都正常,生后12~24 h出现尿液或汗液枫糖浆味,2~3 d出现酮兴奋和哺乳困难,4~5 d出现嗜睡、角弓反张、惊厥等脑病表现,如未得到及时治疗可于7~10 d出现昏迷、中枢性呼吸衰竭、死亡。中间型临床表现与经典型相同、但症状较轻,可以在新生儿期出现尿枫糖浆味和轻微症状,也可以由其他疾病诱发。间歇型常在应激情况下而诱发,发作时临床表现与经典型相似。维生素B1反应型症状较轻,对维生素B1治疗有反应。二氢脂酰脱氢酶缺乏型患儿出生时表现正常,可引起新生儿期酸中毒、肌张力低下、进行性共济失调和严重的神经受损症状和体征,多在儿童期死亡。MSUD患儿体内的BCAA如亮氨酸、异亮氨酸、缬氨酸蓄积,对脑组织产生神经毒性而导致脑白质病变,颅脑MRI影像表现为脑发育不良、脑皮质较薄、脑室三角区白质信号异常,在新生儿期起病者头颅MRI会呈特异性脑水肿表现[4],对疑诊患者尽早行MRI检查有助于早期诊断。
质谱分析技术是疾病筛查及确诊的有效手段,为早期发现新生儿代谢性疾病提供了有效的检测手段[5]。MSUD患者血BCAA水平明显增高,而经典型患儿血亮氨酸水平明显增高。通过串联质谱方法检测血滤纸片中氨基酸水平可早期筛查MSUD[6];而BCKA可从尿及体液中排出,使尿2-羟基异戊酸、2-酮异戊酸、2-酮-3-甲基戊酸、2-酮-异己酸及乙酰甘氨酸显著高,通过气相色谱-质谱技术(GCMS)检测尿有机酸,如显著升高即可诊断为MSUD[7]。该家系第1胎生后7d出现拒乳、嗜睡、惊厥,串联质谱检测显示亮氨酸及缬氨酸显著升高,提示枫糖尿病。该双胎患儿亦在出生后7~8d出现拒乳、喂养困难、反应差,尿液枫糖浆气味,代谢性酸中毒,尿酮体阳性,颅脑MRI示脑白质病变、提示代谢性疾病,血串联质谱检测显示亮氨酸、缬氨酸均显著升高,故临床诊断为MSUD。
MSUD是一种常染色体隐性遗传病,患者的父母往往均携带致病的突变基因,他们的子女有25%的可能成为患者。BCKDH属线粒体大分子多酶复合物,含3个催化单位(4个蛋白质分子):支链α-酮酸脱羧酶(E1)、双氢脂酰转环酶(E2)、二氢脂酰胺脱氢酶(E3),其中E1是一个杂四聚体,由2个亚单位E1α和E1β亚基组成。此外,BCKDH复合物两个特殊调节酶,特异性激酶和特异性磷酸酶,通过可逆性磷酸化调节BCKD复合物活性。这样至少有6个遗传位点编码,任何位点的编码基因都可能发生突变导致BCKD多酶复合体活性减低,从而导致MSUD的发生[8]。根据基因突变将枫糖尿病分为:Ⅰ A型(编码E1α亚基的BCKDHA基因突)、Ⅰ B型(编码E1β亚基的BCKDHB基因突变)、Ⅱ型(编码E2亚基的DBT基因突变)、Ⅲ型(编码E3亚基的DLD基因突变),Ⅳ和Ⅴ则被保留作为特异性激酶和磷酸酶基因突变型[9]。迄今已在BCKDH上发现了150多种突变[10],以BCKDHA、BCKDHB基因突变最常见,且不同种族存在不同的热点突变,发病率最高的门诺派教徒社区最常见的突变为BCKDHA基因c.1312T > A(p.Y393N),该突变预计携带率高达10%[11]。国内沈云琳等[3]报道了1例经典型MUSD患儿的2个新BCKDHB基因突变:c.580C > T(p.Leu194Phe)和c.597T > G(p.Ser199Arg)。本研究双胎患儿在BCKDHB基因上均发现2个杂合突变:c.304G > A(p.Gly102Arg)和c.331C > T(p.Arg111*),其中c.304G > A(p.Gly102Arg)为错义突变,来自于患儿父亲,翻译产物蛋白质的第102位氨基酸由甘氨酸转变为精氨酸,经初步生物信息学分析(LRT、PolyPhen-2)显示Gly102位点在进化上保守、可能致病,但生物信息学分析结果仅供参考[12];c.331C > T(p.Arg111*)为无义突变,来自于患儿母亲,翻译产物蛋白质的第111位氨基酸残基由精氨酸变为终止密码子,该突变预计会导致所编码的蛋白质发生截短,使E1β亚基发生空间构象变化、氨基酸酸碱度变化等诸多改变,进而影响脱氢酶的活性,从而致病,有文献报道为致病突变[13]。本研究结果显示,双胎患儿基因突变存在于BDKDHB基因上,确诊为MSUD Ⅰ B型。
本病目前尚无特异而有效的治疗措施,治疗目的在于迅速排出体内的支链氨基酸及代谢产物,中枢神经系统受损的程度取决于治疗是否及时[14]。经典型MSUD最佳治疗时机是出生7d以内,早期治疗者1/3的患儿智力评分可达正常,而出生14d以后开始治疗者预后差[15]。腹膜透析是有效的治疗方法,同时限制蛋白和支链氨基酸入量,静脉补充足够的热量防止机体分解产生更多的氨基酸,给予大剂量维生素B1(硫胺素),采取适量母乳和去除BCAA的特殊奶粉混合喂养[16],并定期监测血氨基酸浓度以调整饮食的比例。已有在MSUD哺乳动物模型中开展肝细胞移植的研究,MSUD肝脏移植后不需限制饮食,但受到供体来源、费用、手术风险和并发症的限制,肝细胞移植则较好地克服了以上缺点[17]。该双胎患儿明确诊断后立即给予特殊配方奶粉、同时给予维生素B1治疗,但患儿家长要求放弃治疗,放弃后死亡。
MSUD是致死、致残的遗传性疾病,治疗困难,预后不良。患者多在新生儿期发病,病情危重,早期诊断、尽早进行饮食和治疗干预对治疗至关重要。对于新生儿期不明原因的喂养困难、嗜睡、反应差、惊厥、甚至昏迷以及有异常尿液气味等,应尽早行颅脑MRI检查,进行血串联质谱的筛查有利于MSUD的早期诊断;对MSUD患者进行基因诊断,可以预测疾病的严重程度,有助于开展遗传咨询工作。
| [1] | Menkes JH, Horst PL, Craig JM. A new syndrome:progressive familial infantile cerebral dysfunction associated with an unusual urinary substance[J]. Pediatrics , 1954, 14 (5) : 462–467. |
| [2] | Strauss KA, Mazariegos GV, Sindhi R. Elective liver transplantation for the treatment of classical maple syrup urine disease[J]. Am J Transplant , 2006, 6 (3) : 557–564. DOI:10.1111/j.1600-6143.2005.01209.x |
| [3] | 沈云琳, 龚小慧, 颜景斌, 等. 新生儿枫糖尿病一例及其基因突变分析[J]. 中华儿科杂志 , 2015, 53 (1) : 66–70. |
| [4] | Sato T, Muroya K, Hanakawa J, et al. Neonatal case of classic maple syrup urine disease:Usefulness of 1H-MRS in early diagnosis[J]. Pediatr Int , 2014, 56 (1) : 112–115. DOI:10.1111/ped.12211 |
| [5] | Lavin LR, Higby N, Abramo T. Newborn screening:What does the emergency physician need to know[J]. Pediatr Emerg Care , 2015, 31 (9) : 661–667. DOI:10.1097/PEC.0000000000000549 |
| [6] | Burrage LC, Nagamani SC, Campeau PM, et al. Branched-chain amino acid metabolism:from rare Mendelian diseases to more common disorders[J]. Hum Mol Genet , 2014, 23 (R1) : R1–8. DOI:10.1093/hmg/ddu123 |
| [7] | Alodaib A, Carpenter K, Wiley V, et al. An improved ultra performance liquid chromatography-tandem mass spectrometry method for the determination of alloisoleucine and branched chain amino acids in dried blood samples[J]. Ann Clin Biochem , 2011, 48 (Pt5) : 468–470. |
| [8] | Skvorak KJ. Animal models of maple syrup urine disease[J]. J Inherit Metab Dis , 2009, 32 (2) : 229–246. DOI:10.1007/s10545-009-1086-z |
| [9] | Mitsubuchi H, Nobukuni Y, Hayashida Y, et al. Gene analysis of maple syrup urine disease (MSUD)[J]. Rinsho Byori , 1993, 41 (5) : 484–491. |
| [10] | Fernández-Guerra P, Navarrete R, Weisiger K, et al. Functional characterization of the novel intronic nucleotide change c.288+9C>T within the BCKDHA gene:understanding a variant presentation of maple syrup urine disease[J]. J Inherit Metab Dis , 2010, 33 (Suppl 3) : S191–198. |
| [11] | Puffenberger EG. Genetic heritage of the old order mennonites of southeastern Pennsylvania[J]. Am J Med Genet C Semin Med Genet , 2003, 121C : 18–31. DOI:10.1002/(ISSN)1096-8628 |
| [12] | Scaini G, Jeremias IC, Morais MO, et al. DNA damage in an animal model of maple syrup urine disease[J]. Mol Genet Metab , 2012, 106 (2) : 169–174. DOI:10.1016/j.ymgme.2012.04.009 |
| [13] | Flaschker N, Feyen O, Fend S, et al. Description of the mutations in 15 subjects with variant forms of maple syrup urine disease[J]. J Inherit Metab Dis , 2007, 30 (6) : 903–909. DOI:10.1007/s10545-007-0579-x |
| [14] | 蒋丰智, 崔其亮, 江剑辉. 家族性枫糖尿病1例临床诊治体会[J]. 中国当代儿科杂志 , 2009, 11 (7) : 599–600. |
| [15] | Páez Rojas PL, Suarez Obando F. Genetic and metabolic urgencies in the neonatal intensive care unit:maple syrup urine disease[J]. Nutr Hosp , 2015, 32 (1) : 420–425. |
| [16] | Simon E, Wendel U, Schadewaldt P. Maple syrup urine disease-treatment and outcome in patients of Turkish descent in Germany[J]. Turk J Pediatr , 2005, 47 (1) : 8–13. |
| [17] | Skvorak KJ, Paul HS, Dorko K, et al. Hepatocyte transplantation improves phenotype and extends survival in a murine model of intermediate maple syrup urine disease[J]. Mol Ther , 2009, 17 (7) : 1266–1273. DOI:10.1038/mt.2009.99 |
 2016, Vol. 18
2016, Vol. 18


 , 李粹, 徐玮玮, 牛峰海, 张娣
, 李粹, 徐玮玮, 牛峰海, 张娣