2. 军事医学科学院微生物和流行病学研究所病原微生物生物安全重点实验室, 北京 100071
妊娠不满37周的分娩称为早产(preterm birth, PTB),PTB又分为自发性早产(spontaneous preterm birth, SPTB)和治疗性早产(therapeutic preterm birth, TPTB)两种,其中约70%的PTB为SPTB,而SPTB中约50%是胎膜早破(premature rupture of membranes, PROM)导致的[1]。全球每年约有1 500万的早产儿出生,在美国PTB的发生率为12%~13%[2],我国PTB的发生率约为5%~15%[3],并且呈逐年增加的趋势。PTB已成为一个涉及全球范围的临床医学和公众健康难题。目前,SPTB的病因和发病机制仍不十分明确。SPTB具有家族聚集性、种族差异性和复发性[4-5];关联研究也显示, 许多与感染、炎症和先天免疫反应相关的基因多态性是SPTB发生的危险因素[6-7],可见遗传因素在SPTB的发生机制中具有重要作用。目前,国内外关于SPTB的关联研究一般样本量较小,并且由于基因的单核苷酸多态性(single nucleotide polymorphisms, SNP)存在种族差异,国外的研究结果也不一定适用于中国人群。因此,在中国人群中进行遗传因素在SPTB发生中的作用的大样本的研究显得尤为重要。
肿瘤坏死因子α(TNF-α)基因长12 kb,位于6p21.3的主要组织相容性复合体(MHC)Ⅲ类区域,接近HLA-B的着丝粒处,其多态性区域包括6个微随体和位于启动子区域的多个SNP位点,与多种PTB相关的围产期并发症(支气管肺发育不良、脑白质损伤、脑室周围白质软化、脑室周围出血等)的发生风险或严重状态相关联[8-10],提示它们可能影响启动子的转录活性,这与TNF-α的差异表达相关。TNF-α G-308A位点是启动子区域重要的功能性SNP位点之一,与G等位基因相比,-308A具有更强的启动子转录活性(6~7倍以上),与TNF-α表达量的增加有关。多年来,TNF-α基因启动子区域的SNP位点与SPTB遗传易感性的关联性研究也主要集中在这一多态性位点上。本研究拟通过病例-对照研究探讨TNF-α基因启动子区域的G-308A位点与SPTB的关联性,为早产的早期预测和临床治疗提供有用的遗传标记。
1 资料与方法 1.1 研究对象收集2009年1月至2011年5月我院早产儿监护病房的SPTB新生儿569例作为病例组,收集673例同期足月儿监护病房的新生儿作为对照组;2014年3~9月间补充收集184例病例组样本,8例对照组样本。共收集病例组样本753例,对照组样本681例。两组新生儿均为来自北京及其周边地区在遗传学上无关联的汉族人;均排除胎儿畸形、宫内生长受限、胎儿窘迫、先兆子癎、结缔组织病、外伤、出血及任何可能需要进行引产的围产期并发症。
病例组纳入标准:单胎妊娠;胎龄 < 37周。病例组按照是否合并PROM,分为有PROM组和无PROM两个亚组。临床检查孕妇阴道有液体流出,阴道液酸碱度测定pH > 6.5,且显微镜检查阴道液涂于玻片上观察到羊齿状结晶可诊断为PROM。按照SPTB新生儿出生时胎龄的大小,又可分为3个亚组:超早产组(胎龄≤28周)、极早产组(胎龄≤32周)和轻度早产组(胎龄33~36周);超早产组和极早产组合并组成重度早产组(胎龄≤32周)[11-12]。
对照组纳入标准:单胎妊娠;胎龄≥37周;孕妇无SPTB和PROM病史。
1.2 流行病学资料的收集通过查阅病历和问卷调查等方法收集研究对象的流行病学资料。
1.3 标本的采集处理和DNA的制备本研究获得中国人民解放军陆军总医院伦理委员会批准,征得研究对象监护人知情同意后,采集每个研究对象外周静脉血2 mL,加入EDTA抗凝管中,应用北京Tiangen公司的TIANamp Blood血液基因组DNA提取试剂盒(目录号:DP318)提取全血基因组DNA。
1.4 TNF-α G-308A位点基因分型采用Sequenom公司的Genotyping Tools以及MassARRAY Assay Design软件设计TNF-α G-308A位点的引物序列,用于PCR扩增和进行单碱基延伸。5 μL PCR反应体系包括:10×PCR Buffer 0.5 μL,25 mM MgCl2 0.4 μL,25 mM dNTPMix 0.1 μL,5 U/μL HotStar Taq酶0.1/μL,上下游引物各0.5 μL,50 ng/μL DNA模板1 μL,其余用去离子水补充。PCR反应条件为:94℃预变性4 min;94℃变性20 s,56℃退火30 s,72℃延伸1 min,重复45个循环;72℃末延伸3 min;4℃保存。PCR产物用碱性磷酸酶(shrimp alkaline phosphatase, SAP)对上述PCR扩增产物进行处理。SAP处理反应液(SAP Mix)(2 μL)的配制包括10×SAP Buffer 0.17 μL,17 U/μL的SAP酶0.3 μL,其余用去离子水补充。7 μL SAP处理反应体系包括:5 μL PCR产物和2 μL SAP Mix。SAP处理条件为:37℃ 40 min;85℃ 5 min;4℃保存。随后进行单碱基延伸反应,树脂纯化,芯片点样。最后采用MALDI-TOF分析点样后的芯片,用Sequenom TYPER 4.0软件对检测结果进行SNP分型,输出分型结果。
1.5 统计学分析采用SPSS 16.0软件包进行统计学分析与处理。采用Arlequin软件检验哈-温遗传平衡(Hardy-Weinberg equilibrium),确定研究对象的群体代表性。检验病例组和对照组研究对象基线资料的同质性时,计数资料采用χ2检验或Fisher精确概率检验进行分析;呈非正态分布的计量资料用中位数(四分位间距)[P50(P25,P75)]表示,采用Mann-Whitney U检验进行分析。采用χ2检验分析病例组和对照组在单个等位基因、基因型及遗传模式中的分布频率。通过logistic回归分析矫正母亲年龄和婴儿性别后,对每个基因的SNP位点与SPTB发生的关联性进行风险评估,用所得的比值比(OR)及其95%的置信区间(CI)表示风险强度。所有的统计检验均为双侧概率,P < 0.05被认为有统计学意义。
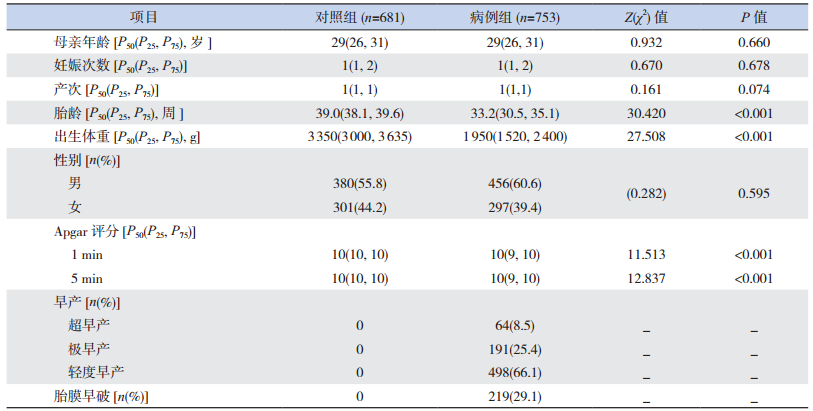
2 结果 2.1 病例组和对照组基本资料的比较病例组和对照组在母亲年龄、妊娠次数、产次和新生儿性别的比较中差异无统计学意义,但两组在胎龄、出生体重、1 min及5 min Apgar评分方面的比较差异有统计学意义(表 1)。
| 表 1 病例组和对照组基本资料的比较 |
2.2 两组TNF-α G-308A位点等位基因和基因型频率分布比较
除去对照组基因分型失败的10个样本和病例组基因分型失败的26个样本外,对照组和病例组的实际样本量分别为671例和727例。病例组和对照组基因型分布均符合哈-温遗传平衡定律(P > 0.05),具有良好的群体代表性。两组的TNF-α G-308A位点等位基因和基因型分布频率见表 2。在所有样本中,病例组和对照组等位基因G、A分布频率之间的差异无统计学意义(χ2=0.87,P=0.35);GG、GA、AA基因型构成比之间的差异也无统计学意义(χ2=0.92,P=0.64)。通过logistic回归分析校正母亲年龄和胎儿性别后,分析共显性(GA vs GG,AA vs GG)、显性(GA+AA vs GG)、隐性(AA vs GG+GA)、超显性(GA vs GG+AA)和加性(A等位基因递增)5种遗传模式,发现TNF-α G-308A位点与SPTB的遗传易感性不相关(P > 0.05)。见表 2。
| 表 2 TNF-α G-308A位点的等位基因和基因型频率[n(%)] |
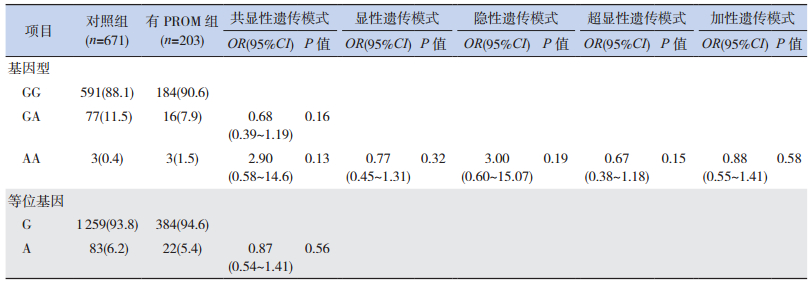
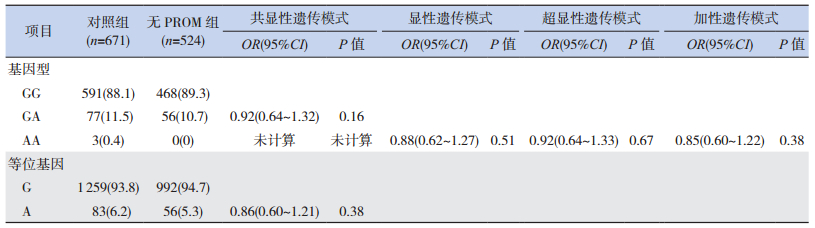
2.3 有无PROM病例组与对照组TNF-α G-308A位点等位基因和基因型频率分布比较
有无PROM病例组与对照组的等位基因A、G频率和GG、GA、AA基因型构成比之间的差异均无统计学意义(P > 0.05)。无PROM组基因分型结果中不含AA基因型,因此,隐性遗传模式(AA vs GG+GA)未计算。通过logistic回归分析校正母亲年龄和胎儿性别后,分析共显性(GA vs GG,AA vs GG)、显性(GA+AA vs GG)、超显性(GA vs GG+AA)、加性(A等位基因递增)等遗传模式,发现TNF-α G-308A位点与合并和不合并PROM的遗传易感性均不相关(表 3~4)。
| 表 3 有PROM病例组和对照组TNF-α G-308A位点的等位基因和基因型频率[n(%)] |
| 表 4 无PROM病例组和对照组TNF-α G-308A位点的等位基因和基因型频率[n(%)] |
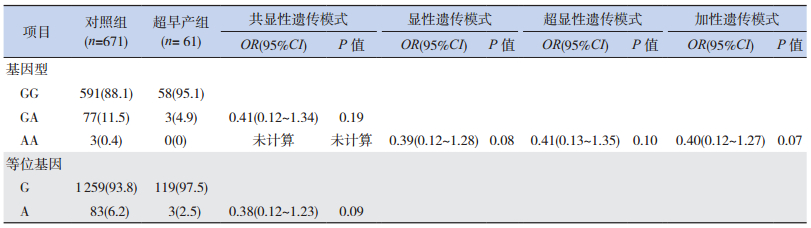
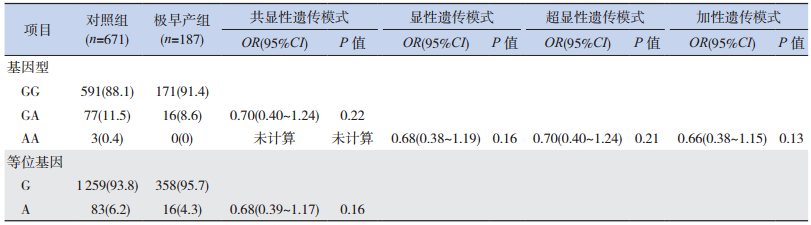
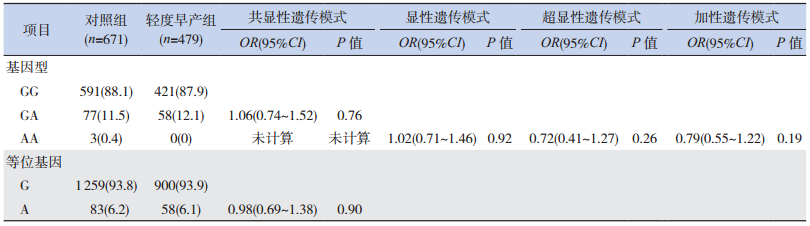
2.4 3个SPTB亚组与对照组TNF-α G-308A位点等位基因和基因型频率分布的比较
不同胎龄的3个亚组(超早产组、极早产组、轻度早产组)分别与对照组比较,各亚组与对照组的等位基因A、G频率和GG、GA、AA基因型构成比之间的差异均无统计学意义(P > 0.05)。各亚组基因分型结果显示不含AA基因型,因此,各亚组隐性遗传模式(AA vs GG+GA)未计算。通过logistic回归分析校正母亲年龄和胎儿性别后,分析共显性(GA vs GG,AA vs GG)、显性(GA+AA vs GG)、超显性(GA vs GG+AA)和加性(A等位基因递增)遗传模式,发现TNF-α G-308A位点与超早产、极早产和轻度早产的遗传易感性均不相关(表 5~7)。
| 表 5 超早产组和对照组TNF-α G-308A位点的等位基因和基因型频率[n(%)] |
| 表 6 极早产组和对照组TNF-α G-308A位点的等位基因和基因型频率[n(%)] |
| 表 7 轻度早产组和对照组TNF-α G-308A位点的等位基因和基因型频率[n(%)] |
3 讨论
本研究探讨了中国人群中TNF-α基因启动子区域的G-308A多态性位点与SPTB遗传易感性之间的关联性。在所有样本中,病例组和对照组之间TNF-α G-308A位点的A、G等位基因的分布频率和GG、GA、AA基因型的构成比均相似,说明此多态性位点与SPTB的患病风险无显著的遗传学关联。并通过是否合并PROM将病例组进行分层分析,与对照组进行比较后发现,上述等位基因和基因型在有或无PROM病例组和对照组之间的分布频率也相似,说明此多态性位点与是否合并PROM的SPTB的患病风险均无显著的遗传学关联。进一步根据出生胎龄的不同将病例组分成3个亚组(超早产、极早产和轻度早产组),发现3个亚组与对照组在上述等位基因和基因型的分布频率上均相似,说明此多态性位点与各胎龄早产儿的患病风险均无显著的遗传学关联。
TNF-α是一种主要由活化的单核细胞、巨噬细胞和淋巴细胞分泌的,具有多种生物学效应的炎症细胞因子。炎症介质学说在PTB特别是感染所致PTB发病机制的研究中占据重要地位。感染及随后发生的宿主炎症性反应可导致羊膜、蜕膜和子宫肌层释放大量的TNF-α。同革兰阴性菌的内毒素一样,TNF-α可使蜕膜、羊膜和绒毛膜合成和分泌前列腺素E、内皮素、促肾上腺皮质激素释放激素,引起子宫收缩;还可以诱导绒毛膜和宫颈细胞分泌金属蛋白酶-8,降解子宫下段细胞外基质中的胶原,促进宫颈成熟和胎膜破裂[13]。另外,即使没有明显的感染发生,PTB孕妇孕中期的羊水中,TNF-α的表达量就已经显著升高。同时,TNF-α作为Th1细胞因子家族的成员之一,当孕妇外周血淋巴细胞、羊水、胎盘、绒毛膜、蜕膜组织中的TNF-α表达量显著升高时,可发生Th1细胞因子偏移现象,使母亲-胎儿之间的免疫耐受解除。也就是说TNF-α的过度表达可提前启动分娩,因而,TNF-α在SPTB及PROM的发病机制中可能具有重要作用[14]。
多年来,TNF-α基因启动子区域的SNP位点与SPTB遗传易感性的关联性研究也主要集中在TNF-α G-308A这一多态性位点上,但研究结果却出现了明显的不一致。2001年,Aidoo等[15]分析了1 048名西肯尼亚新生儿TNF-α G-308A位点的等位基因和基因型分布频率,发现携带-308A等位基因的新生儿发生SPTB的风险显著升高。与之相反,Yilmaz等[16]的研究显示,在土耳其人群中,-308A等位基因在足月分娩的母亲和足月新生儿中的分布频率显著增高,提示-308A与足月分娩相关。但是,当携带-308GA基因型的母亲怀有-308GG基因型的胎儿时,发生PTB的风险会显著升高。另外,Macones等[17]在病例-对照研究(包括125名SPTB或PROM孕妇和250名足月生产孕妇)中发现,-308A等位基因携带者发生SPTB的风险升高,而且,TNF-α对于细菌感染性阴道炎具有高反应性,患有细菌性阴道炎并携带-308A等位基因的妇女,发生SPTB的风险更高。2003年,陈大方等[18]首次在中国人群中分析了来自安徽省安庆市的54个早产家系和79个足月分娩家系TNF-α G-308A多态性与PTB的关联性,指出TNF-α G-308A等位基因与PTB相关。本研究结果显示TNF-α G-308A位点与SPTB的患病风险无显著的遗传学关联,与陈大方等[18]的研究结果不一致。分析可能的原因是:(1)研究对象纳入范围及地域不同:本研究纳入了胎龄≤28周的超早产儿,且为来自北京及其周边地区的汉族人群;(2)样本量不同:本研究样本量是陈大方等[18]研究的10倍。
本研究显示TNF-α G-308A位点与SPTB的患病风险无显著的遗传学关联,可能的原因有以下几点:首先,此SNP位点在不同种族人群中等位基因和基因型的分布频率不同,本研究的研究对象是中国人群,与其他相关研究中的人群存在种族上的明显差异;其次,母亲-胎儿作为双向互动的整体,两者基因的SNP均会影响SPTB的患病风险,而本研究没有考虑母亲基因的SNP对SPTB的患病风险的影响;再次,SPTB属于多基因调控的具有复杂性状的疾病,TNF-α基因启动子区域内含有多个功能性SNP位点,这些位点之间的相互作用也可以影响个体发生SPTB的风险;最后,已经证明环境因素与此位点之间具有协同作用,同样可以影响个体对SPTB的易感性。因此,两者之间缺乏关联是可以解释的。
| [1] | Damus K. Prevention of preterm birth:a renewed national priority[J]. Curr Opin Obstet Gynecol , 2008, 20 (6) : 590–596. DOI:10.1097/GCO.0b013e3283186964 |
| [2] | Winkvist A, Mogren I, Hogberg U. Familial patterns in birth characteristics:impact on individual and population risks[J]. Int J Epidemiol , 1998, 27 (2) : 248–254. DOI:10.1093/ije/27.2.248 |
| [3] | 张建平.异常妊娠[M]//谢幸, 苟文丽.妇产科学.第8版.北京:人民卫生出版社, 2013:47-63. |
| [4] | Di Renzo GC, Giardina I, Rosati A, et al. Maternal risk factors for preterm birth:a country-based population analysis[J]. Eur J Obstet Gynecol Reprod Biol , 2011, 159 (2) : 342–346. DOI:10.1016/j.ejogrb.2011.09.024 |
| [5] | Hamilton BE, Martin JA, Ventura SJ. Births:preliminary data for 2012[J]. Natl Vital Stat Rep , 2013, 62 (3) : 1–20. |
| [6] | Goldenberg RL, Culhane JF, Iams JD, et al. Epidemiology and causes of preterm birth[J]. Lancet , 2008, 371 (9606) : 75–84. DOI:10.1016/S0140-6736(08)60074-4 |
| [7] | Weissenbacher T, Laubender RP, Witkin SS, et al. Diagnostic biomarkers of pro-inflammatory immune-mediated preterm birth[J]. Arch Gynecol Obstet , 2013, 287 (4) : 673–685. DOI:10.1007/s00404-012-2629-3 |
| [8] | Nelson KB, Dambrosia JM, Iovannisci DM, et al. Genetic polymorphisms and cerebral palsy in very preterm infants[J]. Pediatr Res , 2005, 57 (4) : 494–499. DOI:10.1203/01.PDR.0000156477.00386.E7 |
| [9] | Strassberg SS, Cristea IA, Qian D, et al. Single nucleotide polymorphisms of tumor necrosis factor-alpha and the susceptibility to bronchopulmonary dysplasia[J]. Pediatr Pulmonol , 2007, 42 (1) : 29–36. DOI:10.1002/(ISSN)1099-0496 |
| [10] | Nuk M, Orendi K, Rosenberger S, et al. Genetic variations in fetal and maternal tumor necrosis factor-alpha and interleukin 10:is there an association with preterm birth or periventricular leucomalacia?[J]. J Perinatol , 2012, 32 (1) : 27–32. DOI:10.1038/jp.2011.37 |
| [11] | Wang Y, Zhang XA, Yang X, et al. A MCP-1 promoter polymorphism at G-2518A is associated with spontaneous preterm birth[J]. Mol Genet Genomics , 2015, 290 (1) : 289–296. DOI:10.1007/s00438-014-0921-6 |
| [12] | Wang Y, Yang X, Zheng Y, et al. The SEPS1 G-105A polymorphism is associated with risk of spontaneous preterm birth in a Chinese population[J]. PLoS One , 2013, 8 (6) : e65657. DOI:10.1371/journal.pone.0065657 |
| [13] | Bowen JM, Chamley L, Keelan JA, et al. Cytokines of the placenta and extra-placental membranes:roles and regulation during human pregnancy and parturition[J]. Placenta , 2002, 23 (4) : 257–273. DOI:10.1053/plac.2001.0782 |
| [14] | Romero R, Espinoza J, Kusanovic JP, et al. The preterm parturition syndrome[J]. BJOG , 2006, 113 (Suppl 3) : 17–42. |
| [15] | Aidoo M, McElroy PD, Kolczak MS, et al. Tumor necrosis factor-alpha promoter variant 2(TNF2) is associated with pre-term delivery, infant mortality, and malaria morbidity in western Kenya:Asembo Bay Cohort Project IX[J]. Genet Epidemiol , 2001, 21 (3) : 201–211. DOI:10.1002/(ISSN)1098-2272 |
| [16] | Yilmaz Y, Verdi H, Taneri A, et al. Maternal-fetal proinflammatory cytokine gene polymorphism and preterm birth[J]. DNA Cell Biol , 2012, 31 (1) : 92–97. DOI:10.1089/dna.2010.1169 |
| [17] | Macones GA, Parry S, Elkousy M, et al. A polymorphism in the promoter region of TNF and bacterial vaginosis:preliminary evidence of gene-environment interaction in the etiology of spontaneous preterm birth[J]. Am J Obstet Gynecol , 2004, 190 (6) : 1504–1508. DOI:10.1016/j.ajog.2004.01.001 |
| [18] | 陈大方, 胡永华, 吴白燕, 等. 肿瘤坏死因子α/G308A多态性与早产的关联性研究[J]. 北京大学学报(医学版) , 2003, 35 (4) : 377–381. |
 2016, Vol. 18
2016, Vol. 18