2. 苏州大学附属儿童医院检验科, 江苏 苏州 215003
肺炎支原体(mycoplasma pneumoniae, MP)是小儿呼吸道感染的重要病原体之一,10%~40%的儿童社区获得性肺炎是由MP引起的[1]。近年来的研究表明,MP感染并不局限于学龄期儿童,婴幼儿的患病率也呈上升的趋势[2]。MP也是引起喘息发作的重要病原,MP既可引起或诱发支气管哮喘急性发作,又可加重气道高反应性,甚至导致重症或难治性哮喘[3]。50%以上的喘息症状发生在3岁以前[4],因此婴幼儿喘息的疾病负担较高。近年来有报道,MP感染所致喘息的儿童存在着T淋巴细胞亚群紊乱及过敏体质[5],而MP感染伴喘息的婴幼儿是否存在与哮喘类似的免疫机制紊乱及过敏体质,目前国内外研究相对较少。因此我们对2009年1月至2014年12月我院住院治疗的MP感染伴喘息的婴幼儿T淋巴细胞亚群及过敏原水平进行了回顾性分析,以期为临床预防及治疗MP感染引起的婴幼儿喘息提供合理依据。
1 资料与方法 1.1 研究对象2009年1月至2014年12月苏州大学附属儿童医院呼吸科住院的下呼吸道感染婴幼儿中,选择血清MP-IgM阳性和/或鼻咽抽吸物(nasopharyngeal aspirates, NPA)MP-DNA阳性并且入院时既往喘息发作 < 3次的690例作为单纯MP感染组,并根据入院时肺部听诊有无喘鸣音分两组:有喘鸣音者为MP喘息组(354例)、无喘鸣音者为MP非喘息组(336例);选取同期住院、喘息发作≥3次的277例婴幼儿为反复喘息组[6](包括哮喘和喘息性支气管炎)。MP感染诊断参照《诸福棠实用儿科学》[7]。排除标准:营养不良、免疫功能缺陷、先天性心脏病史,喉气管异物、气管软骨发育不全、支气管外肿大的淋巴结或肿瘤压迫等引起的喘鸣。
本研究获得苏州大学医学伦理委员会批准及患儿家属知情同意。
1.2 NPA多病原学检测患儿入院次日清晨喂奶前,用吸痰管负压诱导吸取1~2 mL分泌物,移入无菌生理盐水试管中,将标本涂片镜检:鳞状上皮细胞 < 10个/低倍视野、白细胞 > 25个/低倍镜视野的为合格标本。
合格NPA标本振荡混匀后分为3份,30 min内送检。1份送细菌培养;1份采用直接免疫荧光法检测7种常见呼吸道病毒:呼吸道合胞病毒,腺病毒,流感病毒A、B型,副流感病毒l、2、3型;1份应用聚合酶链反应法(PCR)检测鼻病毒、偏肺病毒、博卡病毒。
1.3 NPA中MP-DNA的检测NPA标本震荡、离心,去上清,加入裂解液提取DNA,进行PCR扩增,引物及探针来自广州达安基因股份有限公司。探针结合序列位于上游引物与下游引物之间。在特异性杂交荧光探针的5'端结合荧光发光基团(FAM),在3'端结合荧光吸收基团(TAMRA)。将样品(标本和质控品)上清液2 μL或直接加入阳性定量参考品于反应管中,12 000 r/min,离心300 s,放入Icycleriq荧光定量PCR仪样品槽(美国BIO-RAD公司)。PCR反应条件:93℃预变性2 min;93℃变性45 s,55℃退火60 s,10个循环;93℃变性30 s,55℃退火45 s,30个循环。荧光采集点设置为55℃退火45 s阶段。荧光定量PCR的结果以Ct值显示,结果判定:(1)Ct值 < 38为阳性;(2)Ct值38~ < 39需复测;(3)Ct值≥39为阴性。
1.4 半定量法检测血清MP-IgM患儿入院当天采集非抗凝静脉血1~2 mL,离心,取血清10 μL加入抗原包被的微孔板中。室温(18℃~25℃)孵育30 min后加入100 μL过氧化物酶标记的抗人IgM抗体,室温孵育30 min后加入100 μL色原/底物液避光温育15 min,加入100 μL终止液至每一微孔。酶标仪450 nm波长处测吸光度D值,计算样本D值/标准品D值比值,判定MP-IgM结果: < 0.8为阴性,0.8~1.1为可疑, > 1.1为阳性;第一次MP-IgM检测为可疑者,1~2周后复查,如增高1.5倍或以上也可诊断为MP急性感染[8]。
1.5 T淋巴细胞亚群检测每100 μL肝素抗凝静脉血加入花青藻红素-5(PE-CY5)抗体标记的抗CD3+抗体、抗CD19+抗体,异硫氰酸荧光素(FITC)标记的抗CD4+抗体、抗CD23+抗体、抗CD25+抗体,藻红朊(PE)标记的抗CD8+抗体各20 μL,轻轻混匀后暗室下孵育,然后加入溶血素裂解红细胞,轻轻混匀后再次暗室下孵育,离心、洗涤后采用美国Beckman Coulter Gallios流式细胞仪进行检测。试剂盒由法国Immunotech公司提供。
1.6 过敏原检测取静脉血2 mL(采血前1周无抗过敏药物使用史),离心后取血清,使用Pharmacia UniCAP System(Unicap100)荧光酶联免疫法进行食入性过敏原(鸡蛋、牛奶、小麦、花生、黄豆和鱼虾类等)及吸入性过敏原(尘螨、花粉、动物皮毛、霉菌和蟑螂等)检测,以IgE≥0.35 kU/L作为阳性。
1.7 统计学分析采用SPSS 20.0统计软件进行数据处理。计数资料以百分率(%)表示,组间比较采用卡方检验或Fisher确切概率法;正态分布计量资料以均数±标准差(x±s)表示,经过方差齐性检验,组间比较采用方差分析。P < 0.05为差异有统计学意义。
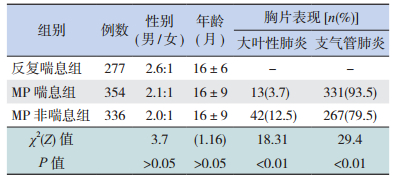
2 结果 2.1 三组患儿一般情况比较690例MP感染患儿中,354例有喘息,喘息发生率达51.3%(354/690)。MP喘息组354例,男233例、女121例,男女之比为2.1:1,平均年龄16±9个月;MP非喘息组336例,男224例、女112例,男女之比为2:1,平均年龄16±9个月。反复喘息组277例,男201例、女76例,男女之比为2.64:1,平均年龄16±6个月,其中47例感染MP(17%)。3组患儿性别、年龄构成比差异无统计学意义(P > 0.05)。MP喘息患儿中93.5%(331/354)的胸部X片表现为支气管肺炎,3.7%(13/354)表现为大叶性肺炎;而MP非喘息组79.5%(267/336)的胸部X片表现为支气管肺炎,12.5%(42/336)表现为大叶性肺炎。胸片表现为支气管肺炎的以MP喘息组较多、胸片示大叶性肺炎的以MP非喘息组较多(P < 0.01)。见表 1。
| 表 1 三组患儿一般情况比较 |
2.2 三组患儿T淋巴细胞亚群比较
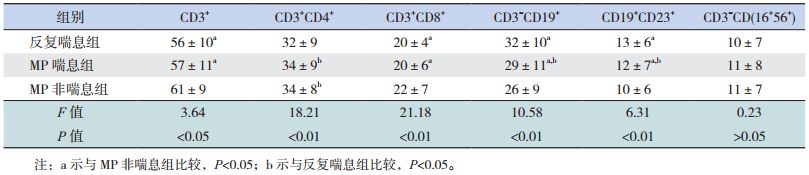
CD3+及CD3+CD8+淋巴细胞百分比在MP喘息组和反复喘息组均低于MP非喘息组(P < 0.05),而在MP喘息组和反复喘息组间的差异无统计学意义(P > 0.05);MP喘息组和非喘息组的CD3+CD4+淋巴细胞百分比差异无统计学意义(P > 0.05),但均高于反复喘息组(P < 0.05);MP喘息组和反复喘息组CD3-CD19+及CD19+CD23+淋巴细胞百分比均明显高于MP非喘息组(P < 0.05),以反复喘息组最高(P < 0.05);CD3-CD(16+56+)淋巴细胞百分比在3组之间的差异无统计学意义(P > 0.05)。见表 2。
| 表 2 三组患儿淋巴细胞亚群检测结果(x±s,%) |
2.3 三组患儿过敏原检测结果
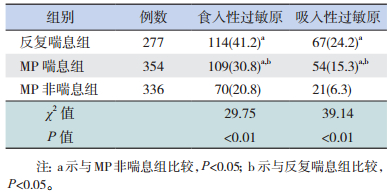
3组患儿的过敏原总阳性率为45.0%(435/967),其中食入性过敏原阳性率(30.3%)高于吸入性过敏原(14.7%)(χ2=67.62,P < 0.01)。反复喘息组、MP喘息组的食入性和吸入性过敏原阳性率高于MP非喘息组,以反复喘息组最高,差异具有统计学意义(P < 0.01)。见表 3。
| 表 3 三组患儿过敏原检测结果[n(%)] |
3 讨论
婴幼儿喘息性疾病主要由感染、寒冷刺激、过敏等各种因素引起,MP是小儿社区获得性呼吸道感染的重要病原之一,也是导致喘息发生的重要病原。多项研究[9-10]发现,急性喘息患儿中MP检出率仅次于呼吸道合胞病毒。本研究显示MP感染导致婴幼儿喘息的发生率高达51.3%。MP感染亦是引起儿童哮喘急性发作的重要诱因,本研究反复喘息组17%存在MP感染,与Watson[11]报道的5%~30%的喘息症状及哮喘发作与MP感染有关相一致,进一步证实了MP是引起儿童急性喘息尤其是反复喘息的重要病原体。因此建议对于喘息急性发作或反复喘息的患儿常规进行非典型病原体检查,以进行早期合理的治疗。
目前关于MP感染相关喘息的机制尚未完全明确,气道上皮细胞吸附学说是目前公认的MP感染急性期剧烈刺激性咳嗽和喘息发生的病理生理学机制[12]。逐渐增多的证据显示免疫炎症损伤也是MP感染相关喘息的分子生物学机制之一[13],T细胞扮演了免疫保护和免疫损伤的双重角色。MP起到丝裂原作用,可使淋巴细胞多克隆化,引起细胞增殖及破坏正常T细胞亚群比例。Th细胞在哮喘的发生和发展过程中起重要的调节作用,Th1/Th2失衡是哮喘的基本病理生理机制。研究发现,MP感染也可引起Th1/Th2细胞比例失调,导致Th2细胞因子占优势,并可刺激转化生长因子-β1、血管内皮生长因子、内皮素-1、肿瘤坏死因子-α、嗜酸细胞阳离子蛋白等多种参与哮喘气道重塑过程的细胞因子和炎症介质释放[14-16]。CD3+是成熟T细胞的特征性标志。本研究反复喘息组和MP喘息组患儿的CD3+淋巴细胞百分比均低于非喘息组,提示喘息患儿总T淋巴细胞处于抑制状态,细胞免疫功能整体下降,对MP清除能力可能也随之下降。而CD4+、CD8+淋巴细胞是细胞免疫核心部分,CD4+T细胞经刺激后大量增殖分化成为Th1、Th2、Th3、Th17、Th22等细胞,Th1可辅助CD8+T细胞免疫过程,CD8+T淋巴细胞又称细胞毒性T淋巴细胞,过敏原特异的CD8+T淋巴细胞起到抑制炎症、降低气道高反应性、抑制IL-4、IgE的分泌合成从而恢复Th1/Th2免疫平衡的保护作用;Th2细胞参与体液免疫,可通过刺激B淋巴细胞增值促进IgE释放;B淋巴细胞可分泌多种免疫球蛋白和抗体,介导机体免疫应答[12]。本研究MP喘息组和反复喘息组的CD3+CD4+和CD3+CD8+淋巴细胞百分比较MP非喘息组降低,推测喘息患儿CD4+淋巴细胞降低以Th1类免疫应答为主,导致CD8+T细胞免疫应答反应降低。CD3-CD19+为B淋巴细胞标志,CD19+CD23+是B淋巴细胞激活和分化的标志,具有触发IgE介导的I型变态反应功能[17]。本研究MP喘息组和反复喘息组的CD3-CD19+及CD19+CD23+淋巴细胞百分比均明显高于MP非喘息组,提示喘息患儿B淋巴细胞处于高激活状态,Th2类细胞因子表达释放增强,IgE合成分泌增加,即变态反应程度加强,从而导致Th1/Th2失衡,这与国内外研究相似[18-19]。罗晓明[17]还发现CD19+CD23+淋巴细胞表达增高可出现在婴幼儿哮喘及最终发展为哮喘的婴幼儿喘息的早期,提示CD19+CD23+淋巴细胞对婴幼儿喘息预后的预测可能有重要价值。本研究还发现MP非喘息组胸片表现为大叶性肺炎的比例较MP喘息组高,推测可能与MP感染后不同的免疫反应导致肺部损伤的病理及临床表现不同有关。
近年来有学者提出了5岁以下儿童喘息发展为持续性哮喘的预测指数[6, 20]:即过去1年有3次以上喘息发作,具有1项主要指标或2项次要指标。主要指标:(1)患者父母有哮喘病史;(2)有特应性皮炎病史;(3)有吸入变应原致敏的依据。次要指标:(1)有食物变应原致敏的依据;(2)外周血嗜酸性粒细胞≥4%;(3)与感冒无关的喘息。符合以上条件者有75%在6~13岁时有哮喘症状,不具备以上条件者发生哮喘的机会 < 5%。提示过敏体质是影响婴幼儿喘息发生和转归的重要因素。Yeh等[21]研究显示:MP感染的喘息患儿发展为哮喘的风险性是非MP感染患儿的3.35倍,伴有特应性疾病(过敏性性鼻炎、特应性皮疹、过敏性结膜炎等)的患儿是MP感染致喘息的高危人群。本研究显示,反复喘息组和MP感染喘息组患儿的食入性过敏原和吸入过敏原阳性率均高于非喘息组,并以反复喘息组婴幼儿阳性率最高,证实了婴幼儿喘息发生与过敏密切相关,这与多项研究报道一致[10, 22-23]。
综上所述,细胞免疫功能紊乱、过敏体质在肺炎支原体感染伴喘息婴幼儿的发病机制中起着重要的作用,MP感染引发的喘息与支气管哮喘可能存在共同发病机制。应加强对MP感染所致的婴幼儿喘息进行监控,阻断其细胞免疫功能紊乱及反复喘息的进程,对特应性体质的MP感染喘息婴幼儿进行早期干预,减少以后反复喘息发作甚至哮喘的发生仍是目前研究的重要课题。
| [1] | Jain S, Williams DJ, Arnold SR, et al. Community-acquired pneumonia requiring hospitalization among U.S. children[J]. N Engl J Med , 2015, 372 (9) : 835–845. DOI:10.1056/NEJMoa1405870 |
| [2] | Harris M, Clark J, Coote N, et al. British Thoracic Society guidelines for the management of community acquired pneumonia in children:update 2011[J]. Thorax , 2011, 66 (Suppl 2) : ii1–23. |
| [3] | Wood PR, Hill VL, Burks ML, et al. Mycoplasma pneumoniae in children with acute and refractory asthma[J]. Ann Allergy Asthma Immunol , 2013, 110 (5) : 328–334. DOI:10.1016/j.anai.2013.01.022 |
| [4] | Martinez FD. Development of wheezing disorders and asthma in preschool children[J]. Pediatrics , 2002, 109 (2 Suppl) : 362–367. |
| [5] | Choi IS, Byeon JH, Yoo Y, et al. Increased serum interleukin-5 and vascular endothelial growth factor in children with acute mycoplasma pneumonia and wheeze[J]. Pediatr Pulmonol , 2009, 44 (5) : 423–428. DOI:10.1002/ppul.v44:5 |
| [6] | 中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 儿童支气管哮喘诊断与防治指南[J]. 中华儿科杂志 , 2008, 46 (10) : 745–753. |
| [7] | 申昆玲, 江载芳.其他微生物所致肺炎[M]//胡亚美, 江载芳.诸福棠实用儿科学.第7版.北京:人民卫生出版社, 2002:1204-1205. |
| [8] | Guo Q, Li HY, Zhou YP, et al. Associations of radiological features in Mycoplasma pneumoniae pneumonia[J]. Arch Med Sci , 2014, 10 (4) : 725–732. |
| [9] | 吕婕, 范亚可, 董晓艳, 等. 伴喘息症状的肺炎患儿临床及病原学研究[J]. 中国当代儿科杂志 , 2005, 7 (3) : 259–260. |
| [10] | 严永东, 王宇清, 陈正荣, 等. 婴幼儿喘息与呼吸道病毒、肺炎支原体、肺炎衣原体感染及过敏的关系[J]. 苏州大学学报(医学版) , 2009, 29 (3) : 577–579. |
| [11] | Watson ME Jr, Storch GA. Recurrent Mycoplasma pneumoniae infection in a human immunodeficiency virus-positive child[J]. Pediatr Infect Dis J , 2008, 27 (11) : 1037–1038. DOI:10.1097/INF.0b013e318178276b |
| [12] | 孙红, 孙红妹. 肺炎支原体直接损伤及其免疫学致病机制研究进展[J]. 中华微生物学和免疫学杂志 , 2015, 35 (1) : 65–68. |
| [13] | 陈广道, 陈爱欢. 儿童肺炎支原体感染相关喘息的研究进展[J]. 中华儿科杂志 , 2012, 50 (10) : 756–759. |
| [14] | Esposito S, Blasi F, Arosio C, et al. Importance of acute Mycoplasma pneumoniae and Chlamydia pneumoniae infections in children with wheezing[J]. Eur Respir J , 2000, 16 (6) : 1142–1146. |
| [15] | Chung HL, Kim SG, Shin IH. The relationship between serum endothelin (ET)-1 and wheezing status in the children with Mycoplasma pneumoniae pneumonia[J]. Pediatr Allergy Immunol , 2006, 17 (4) : 285–290. DOI:10.1111/pai.2006.17.issue-4 |
| [16] | 何学华, 李云, 易红玲. 肺炎支原体肺炎患儿血清T-IgE和ECP检测及临床意义[J]. 中国当代儿科杂志 , 2003, 5 (5) : 475–476. |
| [17] | 罗晓明, 杜立中, 周馥英, 等. 外周血CD23表达阳性B淋巴细胞对婴幼儿喘息预后的早期预测作用[J]. 中国实用儿科杂志 , 2004, 19 (1) : 16–18. |
| [18] | Bodhankar S, Sun X, Woolard MD, et al. Interferon gamma and interleukin 4 have contrasting effects on immunopathology and the development of protective adaptive immunity against mycoplasma respiratory disease[J]. J Infect Dis , 2010, 202 (1) : 39–51. DOI:10.1086/653013 |
| [19] | 倪慧萍, 季伟, 陈正荣, 等. 肺炎支原体肺炎患儿T淋巴细胞亚群表达及临床意义[J]. 江苏医药 , 2012, 38 (22) : 2705–2707. |
| [20] | Pedersen SE, Hurd SS, Lemanske RF Jr, et al. Global strategy for the diagnosis and management of asthma in children 5 years and younger[J]. Pediatr Pulmonol , 2011, 46 (1) : 1–17. DOI:10.1002/ppul.21321 |
| [21] | Yeh JJ, Wang YC, Hsu WH, et al. Incident asthma and Mycoplasma pneumoniae:A nationwide cohort study[J]. J Allergy Clin Immunol , 2016, 137 (4) : 1017–1023. |
| [22] | 陈彩霞, 单晔, 葛蕾, 等. 婴幼儿喘息与呼吸道合胞病毒肺炎支原体感染及过敏的关系[J]. 中国实用儿科杂志 , 2007, 22 (12) : 908–910. |
| [23] | 盛冬青, 李世艳, 孙新民. 支原体肺炎患儿的喘息症状、气道高反应性与过敏史、血清总IgE水平的关系探讨[J]. 华中医学杂志 , 2000, 24 (6) : 314–315. |
 2016, Vol. 18
2016, Vol. 18