2009年3月下旬至4月中旬,墨西哥、美国等多国接连暴发新型甲型H1N1型流感(简称甲流),疫情迅速在全球蔓延,随后呈季节性流感。关于成人甲流已有较为深入的研究,但对于儿童流感尤其是甲流患儿的流感病毒核酸持续时间研究较少,临床医师在甲流儿童抗病毒治疗疗程的选择上存在困惑。本文以2016年1月至2016年4月深圳市儿童医院感染科收治的90例确诊甲流患儿为研究对象,对其临床特点、治疗经过、病毒核酸持续时间和转归进行回顾性分析,探讨甲流病毒核酸持续时间与临床特征及抗病毒治疗时机的相关性,以期为甲流患儿的抗病毒治疗提供理论依据。
1 资料与方法 1.1 研究对象收集2016年1月至2016年4月深圳市儿童医院感染科收治的90例甲流患儿临床资料。甲流诊断及疗效判断参照《流行性感冒诊断与治疗指南(2011年版)》以及《儿童流感诊断与治疗专家共识(2015年版)》[1-2],所有病例甲流病毒核酸PCR检测均阳性。其中男64例、女26例;年龄1个月至10岁,平均[36(1,120)]个月。
1.2 甲流病毒核酸检测采用中山大学达安基因股份有限公司的甲型流感病毒核酸检测试剂盒,于入院当天对患儿鼻咽拭子标本进行甲流病毒核酸检测,并每日监测,直至核酸转阴。
1.3 统计学分析采用SPSS 17.0统计学软件进行数据处理。正态分布的计量资料以均数±标准差(x±s)表示,非正态分布的计量资料以中位数(四分位间距)[P50(P25,P75)]表示;如方差齐,组间比较采用方差分析和t检验;如方差不齐,行秩和检验。P < 0.05为差异有统计学意义。
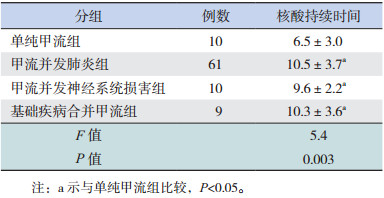
2 结果 2.1 一般资料90例患儿分为单纯甲流组(10例);甲流并发肺炎组(61例);甲流并神经系统损害组(10例)例,其中脑炎4例、热性惊厥6例;基础疾病合并甲流组(9例),基础疾病分别为粒细胞缺乏症2例,肾病综合征2例,川崎病2例、麻疹、百日咳、结节性硬化症各1例。
前5位临床症状主要为发热(89/90,99%)、咳嗽(89/90,99%)、流涕(69/90,77%)、气促(26/90,29%)和肌痛(23/90,26%),发热以高热为主。
经治疗,90例患儿均显效或痊愈出院。
2.2 甲流患儿病毒核酸持续时间比较单纯甲流组病毒核酸持续时间短于甲流并发肺炎组、甲流并发神经系统损害组及基础疾病合并甲流组(P < 0.05);甲流并发肺炎组、甲流并发神经系统损害组及基础疾病合并甲流组之间的病毒核酸持续时间的差异均无统计学意义(P > 0.05)。见表 1。
| 表 1 90例甲流患儿病毒核酸持续时间比较(x±s, d) |
2.3 抗流感病毒药物使用时机与病毒核酸及发热持续时间的关系
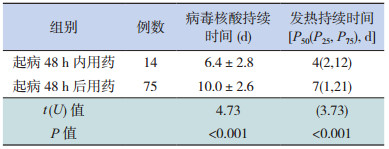
起病48 h内用药的患儿病毒核酸持续时间和体温恢复正常所需时间均短于48 h以后用药患儿,差异有统计学意义(P < 0.05),见表 2。
| 表 2 抗流感病毒药物的使用时机与病毒核酸及体温持续时间的关系 |
2.4 发热与甲流病毒核酸持续时间的相关性
89例发热患儿中,4例(4%)在体温正常前1~2 d病毒核酸转阴;11例(12%)在体温正常当天转阴;74例(83%)在体温正常后1~9 d(平均3.0±1.8 d)转阴,也就是83%的体温恢复正常的甲流患儿病毒核酸仍呈阳性。
3 讨论全球每年有5%~10%的成人和20%~30%的儿童发生流感[3]。甲流是由A型流感病毒引起的急性呼吸道传染病,大部分可治愈,但也可出现肺炎、脑炎或心肌炎等严重并发症,甚至死亡[4]。
本研究分析了经PCR核酸检测确诊的90例甲流患儿临床资料,前5位的临床症状为发热、咳嗽、流涕、气促、肌痛等,与多数研究基本相符[1, 5]。相对于成人,本研究患者的咽痛、乏力等症状不典型,与儿童上呼吸道感染局部症状较轻、全身症状更重以及患者年龄小、表述欠准确有关。90例患儿中仅10例为单纯甲流,71例有不同并发症,提示儿童甲流需警惕合并症发生,而成人甲流病情较温和[6]。影响甲流患儿病毒核酸持续时间的因素较多,包括年龄、病情严重程度等。年龄 < 14岁的重症甲流患者病毒核酸持续时间较长[7]。本研究单纯甲流组病毒核酸持续时间为6.5±3.0 d,与Cheng等[8]报道的一致;而具有并发症或基础疾病患儿的病毒核酸持续时间为9d左右,提示并发症或者基础性疾病的存在是影响甲流病毒核酸持续时间的主要因素之一。
抗病毒治疗是甲流的有效治疗方法,早期应用效果更佳[9-10],最好在症状出现48 h内使用[11]。目前治疗甲流应用较为广泛的磷酸奥司他韦活性代谢产物为流感病毒神经氨酸酶抑制剂,可以抑制病毒的粘附、播散及复制。本组病例中起病48h内给予抗病毒治疗者,甲流病毒核酸持续时间和体温恢复正常时间均短于48h后用药者。提示早期抗病毒治疗不仅可以促进核酸转阴,还可以促进体温尽快恢复。
本研究还发现,83%的体温恢复正常的甲流患儿病毒核酸仍呈阳性。根据池频频等[12]的研究,38例成人甲型H1N1流感患者中只有3例(8%)在临床症状消失后流感病毒核酸检测呈阳性。王鲜平等[13]的研究也显示,41例成人甲型H1N1流感患者中,仅有2例在体温正常、流感样症状基本消失的第6、8天流感病毒核酸仍呈弱阳性。本研究结果明显高于成人患者的比例,提示可能大部分儿童甲流患者体温恢复正常时仍携带病毒,不宜马上停止抗病毒治疗。
由于本研究样本量较小,且仅对甲流病毒核酸进行了定性检测,缺乏病毒核酸载量数据,对甲流病毒核酸持续时间的判断可能有一定偏差。因此,关于儿童甲流病毒核酸持续时间的影响因素及其临床意义有待进一步深入研究。
| [1] | 卫生部流行性感冒诊断与治疗指南编撰专家组. 流行性感冒诊断与治疗指南(2011年版)[J]. 中华结核和呼吸杂志 , 2011, 34 (10) : 725–734. |
| [2] | 中华医学会儿科学分会呼吸学组, 《中华实用儿科临床杂志》编辑委员会. 儿童流感诊断与治疗专家共识(2015年版)[J]. 中华实用儿科临床杂志 , 2015, 30 (17) : 1296–1303. |
| [3] | World Health Organization. Influenza (Seasonal)[DB/OL]. (2014-03)[2015-11-05]. http://www.who.int/mediacentre/factsheets/fs211/en/. |
| [4] | Zambon MC. The pathogenesis of influenza in humans[J]. Rev Med Virol , 2001, 11 (4) : 227–241. DOI:10.1002/(ISSN)1099-1654 |
| [5] | 谢晓虹, 金玲, 彭才静, 等. 重庆单中心2009至2011年急性呼吸道感染住院患儿2种甲型流感病毒检出情况及临床特征分析[J]. 中国循证儿科杂志 , 2014, 9 (3) : 181–185. |
| [6] | Mu YP, Zhang ZY, Chen XR, et al. Clinical features, treatments and prognosis of the initial cases of pandemic influenza HINI 2009 virus infection in Shanghai China[J]. QJM , 2010, 103 (5) : 31l–317. |
| [7] | 袁虹, 杨桂林, 刘映霞, 等. 轻型和重型甲型H1N1流行性感冒患者临床特征、病毒载量以及排毒时间分析比较[J]. 中华传染病杂志 , 2010, 28 (12) : 722–726. |
| [8] | Cheng PK, To AP, Leung TW, et al. Oseltamivir-and amantadine-resistant influenza virses A (H1N1)[J]. Emerg Infect Dis , 2010, 16 (1) : 155–156. DOI:10.3201/eid1601.091304 |
| [9] | Smith JR, Ariano RE, Toovey S. The use of antiviral agents for the management of severe influenza[J]. Crit Care Med , 2010, 38 (4 Supp1) : e43–e51. |
| [10] | Jain S, Kamimoto L, Bramley AM, et al. Hospitalized patients with 2009 H1N1 influenza in the United States, April-June 2009[J]. N Engl J Med , 2009, 361 (20) : 1935–1944. DOI:10.1056/NEJMoa0906695 |
| [11] | 中华医学会呼吸病学分会, 中华医学会儿科学分会. 流行性感冒抗病毒药物治疗与预防应用中国专家共识[J]. 中华医学杂志 , 2016, 96 (1) : 85–90. |
| [12] | Chi PP, Feng L, Chen FX, et al. Factors affecting RNA negative conversion in 38 cases 0f influenza A (H1N1)[J]. Infect Dis Info , 2010, 23 (4) : 227–229. |
| [13] | 王鲜平, 杨慧宁, 高敏, 等. 41例甲型H1N1流感病例流行病学调查分析[J]. 中华医院感染学杂志 , 2011, 21 (21) : 4516–4517. |
 2016, Vol. 18
2016, Vol. 18