随着甲型H1N1、H7N9、H5N1等流感病毒在我国以及全球的爆发流行,免疫力低下者尤其是儿童甲型流感感染发病的风险最高,发生严重病情的风险也最高[1]。在流感的流行季节,来院就诊的患者量骤增,针对甲型流感病毒进行快速、准确地筛查,逐渐成为临床上的广泛迫切需求。目前常见的流感病毒实验室检测方法包括病毒培养、病毒抗原检测、核酸检测和血清学检测法等[2]。其中病毒抗原检测和核酸检测法,是国家疾病预防控制中心推荐的方法[3],可以用于早期诊断流感病毒。这两种方法具有较高的可靠性、特异性以及敏感度,其中核酸检测需要特殊设备,操作人员需经过特殊培训,且检测所需时间较长,不宜在临床,尤其是一些基层医疗机构使用推广。目前,抗原检测方法种类众多,主要区别在于免疫标记物的差异,如酶联免疫吸附法(ELISA法)、胶体金法、荧光免疫层析法等。其中ELISA法易受加样、反应温度、反应时间、洗涤彻底性等诸多因素的影响,而且操作步骤较多,现已被新方法逐渐替代;胶体金法因其操作简便,10~15 min便可肉眼观察结果,广泛用于临床快速检测流感病毒,但胶体金法显色需要较高浓度的标记物,在病毒滴度低时易出现假阴性[4]。国内外研究[5-6]报道了一种基于荧光免疫层析技术的新型流感病毒快速检测方法,相应产品Sofia Influenza A+B FIA已广泛应用于欧美国家临床检测流感病毒抗原,Sofia流感病毒抗原检测试剂盒由美国公司研发并生产,基于欧美国家人种、环境而设计,虽然在欧美国家的临床诊断过程中表现出良好的性能,但存在由地域、人种、流行毒株等多方面引发的差异,本研究采用Sofia流感病毒抗原检测试剂盒,验证了荧光免疫层析法检测甲型流感病毒的特异性、灵敏度(与PCR法相比),并与胶体金法进行了比较,探讨其在临床中用于流感病毒快速诊断的价值。
1 资料与方法 1.1 研究对象选取2015年7~8月于湖南省人民医院儿科就诊的378例流感症状患儿为研究对象,其中男208例,女170例; < 1岁患儿103例,1岁~患儿177例,5~12岁患儿98例。
1.2 样本采集使用无菌鼻咽拭子(Copan公司,意大利)对所有流感症状患儿进行样本采集,将采样拭子轻轻旋转进入鼻孔至鄂部,在鼻孔内壁旋转3次,取得分泌物,存储在1.5 mL病毒保存液中,于-80℃保存备用。本研究获得湖南省人民医院伦理委员会的批准,并在所有受试者的知情同意情况下,签订了知情同意书。
1.3 试剂与仪器本研究中采用的快速检测试剂为美国Quidel公司的Sofia Influenza A+B FIA,配套Sofia荧光免疫分析仪;甲型/乙型流感病毒抗原检测试剂盒(胶体金法)购自艾博医药(杭州)有限公司。RNA提取试剂盒和甲型流感病毒核酸检测试剂盒均来自上海星耀医学科技发展有限公司,核酸自动提取仪购自台湾圆点,荧光定量PCR仪购自美国ABI(7500)。
1.4 荧光免疫层析法检测将拭子漂洗液加入到含还原剂干粉的试剂管中,轻轻旋转试剂管溶解干粉;将样本拭子放入试剂管,充分洗涤拭子上的病毒,挤干拭子上的液体后将其丢弃;使用试剂盒内的固定体积移液器取样120 µL,并加样至试纸条的样本孔中;最后将试纸条插入Sofia免疫荧光分析仪的卡槽中进行检测。
1.5 胶体金法检测在样本抽提管中加入6滴(约192 µL)Flu裂解液,旋转棉签使样本与裂解液充分混合,尽量挤干棉签上的液体后将其取出,按试纸条上箭头所示方向将其插入样本抽提管中,并开始计时,15 min后进行结果判读。
1.6 Real-Time PCR检测(1)样本核酸提取:使用核酸提取试剂盒在核酸自动提取仪上操作。在96孔预装板第1槽位中依次加入600 µL样本、5 µL内参和20 µL蛋白酶K;放入核酸提取仪,确认安装正确,将搅拌塑料套插入磁棒下面的震动架上;按照核酸提取仪使用说明书开启电源并选择程序,启动运行;运行结束后,第4槽位中即为提取的RNA,可以吸取进行PCR检测或转移到离心管中-20℃保存。
(2)Real-Time PCR:按照产品说明书配置反应体系,每个反应体系(25 µL)含提取的RNA 10 µL,PCR仪器设置扩增程序:50℃ 15 min;然后95℃ 2 min;再按94℃ 15 s,55℃ 40 s,循环50次;55℃采集FAM荧光通道的信号。
1.7 统计学分析采用SPSS 19.0统计学软件对数据进行统计学分析,计量资料用均数±标准差(x±s)表示。计数资料采用百分率(%)表示,两组间比较采用四格表χ2检验,多组间比较采用行×列表χ2检验,P < 0.05为差异有统计学意义;组间两两比较采用卡方分割,调整检验水准为P < 0.017为差异有统计学意义。
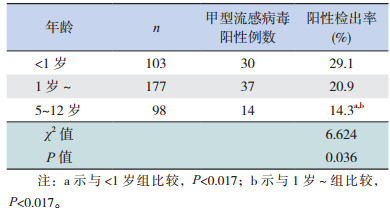
2 结果 2.1 RT-PCR检测不同年龄段患儿的感染情况对378例疑似感染患儿的鼻咽拭子样本进行PT-PCR检测,结果显示甲型流感阳性患儿81例,阳性检出率为21.4%,其中男43例,女38例,差异无统计学意义(χ2=0.157, P=0.692); < 1岁患儿30例,1岁~患儿37例,5~12岁患儿14例,差异有统计学意义(χ2=6.624, P=0.036),其中1岁以下患儿的甲型流感感染率最高,随着年龄增加,感染率逐渐降低,5~12岁儿童感染率降至14.3%,见表 1。
| 表 1 不同年龄段甲型流感患儿检查情况 |
2.2 两种流感病毒快速检测试剂结果
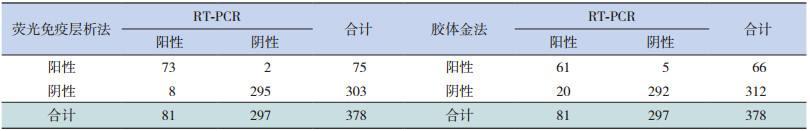
使用荧光免疫层析法检出甲型流感阳性患儿75例,阳性检出率为19.8%(75/378),其中2例RT-PCR法检测为阴性;阴性患儿303例,其中8例RT-PCR法检测为阳性;参照RT-PCR结果,其真实阳性检出率为19.3%(73/378)。采用胶体金法检出甲型流感阳性患儿66例,阳性检出率为17.5%(66/378),其中5例RT-PCR法检测为阴性;阴性患儿312例,其中20例RT-PCR法检测为阳性;参照RT-PCR结果,其真实阳性检出率为16.1%(61/378)。见表 2。
| 表 2 荧光免疫层析法和胶体金法检测结果对比 |
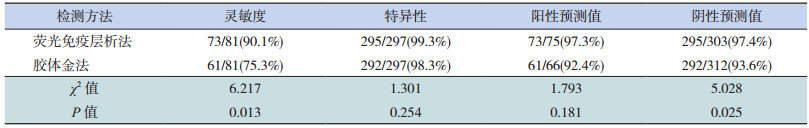
以RT-PCR为对照,荧光免疫层析法检测甲型流感病毒的灵敏度(90.1%)明显高于胶体金法(75.3%),差异有统计学意义(χ2=6.217, P=0.013)。荧光免疫层析法、胶体金法对于甲型流感病毒的检测特异性分别为99.3%和98.3%,差异无统计学意义(χ2=1.301, P=0.254)。荧光免疫层析法、胶体金法检测甲型流感病毒的阳性预测值分别为97.3%、92.4%,阴性预测值分别为97.4%、93.6%,总符合率分别为97.4%[(73+295)/378]和93.4%[(61+292)/ 378],差异有统计学意义(χ2=6.741, P=0.009)。见表 3。
| 表 3 荧光免疫层析法和胶体金法检测性能比较 |
2.3 荧光免疫层析法与胶体金法检测样本Ct值比较
荧光免疫层析法检测为甲型流感阳性的样本平均Ct值为30.6±3.0,Ct值范围为28.4~35.9;胶体金法检测为阳性的样本平均Ct值为28.7±2.8,Ct值范围为28.3~30.8,因此,荧光免疫层析法能够检测样本中的病毒载量比胶体金法低32倍(ΔCt=5,25=32)。阴性样本的平均Ct值分别为39.5±3.2和32.2±4.1。对于荧光免疫层析法检测为甲型流感阳性而胶体金法检测为阴性的样本,平均Ct值为33.3±2.7,Ct值范围为30.8~35.9,表明仅荧光免疫层析法检测为阳性的样本中流感病毒载量较低,胶体金法未能检测出。由此可见,荧光免疫层析法可以检测更低病毒滴度的样本,胶体金法出现假阴性结果的概率更高。
3 讨论流感是由流感病毒引起的一种常见的感染性疾病,流感病毒表面的血凝素和神经氨酸酶易发生变异,即使是接种了流感疫苗的人群也会感染新型流感病毒,造成新的流行。其中甲型流感的变异性最强,多次的大范围流感爆发均源于甲型流感在人群中的传播。据估算,全世界每年约有50万人死于流感[7]。根据我国疾病预防控制中心2001~2003年的监测报告:全国70%~90%的流感样疾病发生于15岁以下儿童,其中5岁以下儿童位居第一位(占43%~65%),5~14岁儿童占第2位(占25%~34%)[8]。
本研究对不同年龄段的患儿进行分析发现,不同年龄段患儿的流感病毒感染率不同(P < 0.05),其中1岁以下婴儿的感染率较高,达29.1%(30/103),感染率随年龄的增长而逐渐降低。这是由于婴幼儿机体免疫力低下,属流感病毒易感人群,而且一旦感染流感病毒则容易引发严重的并发症造成病死率高[1],因此临床要及时监控该年龄段免疫力低下患儿的病情。
另外,从临床表现来看,流感病毒感染与其他呼吸道病毒感染症状相似,医生很难从发病症状上区分,实施对症下药[9-10]。因此,实验室诊断对于流感病毒的精准诊断十分必要。近期H1N1、H7N9及H5N1等甲型流感病毒在我国甚至全球范围内频频爆发流行,不仅医院门诊常常人满为患,患者也不能得到及时诊治。临床上需要准确快速的诊断方法对甲型流感病毒进行初步筛查,以便及时医治和控制病毒传播。目前的甲型流感快速检测方法主要是胶体金法,操作简便,可在15 min左右得出结果,但由于需要高浓度的胶体金颗粒聚集显示,对于含低滴度病毒的样本检出率低,易造成漏检。
本研究中采用了一种新型Sofia流感病毒快速测试剂盒,与RT-PCR方法相比,荧光免疫层析法检测甲型流感病毒的灵敏度为90.1%(73/81),特异性为99.3%(295/297),总符合率为97.4%[(73+295)/378];灵敏度和总符合率明显高于胶体金法,差异有统计学意义;特异性略高于胶体金法,但差异无统计学意义。这与国外报道的荧光免疫层析法灵敏度和特异性高于胶体金法的BinaxNOW(Alere)和Directigen EZ(BD)的结果一致[11]。
荧光免疫层析法检测为阳性的样本平均Ct值(30.6)高于胶体金法(28.7),这说明荧光免疫层析法能够检测病毒载量更低的样本,灵敏度更高。对于荧光免疫层析法检测为阴性,而RT-PCR检测为阳性的样本,其平均Ct值(39.5)高于胶体金法(32.2),这些阴性样本中的病毒抗原浓度较低,因此荧光免疫层析法检测为阴性的样本,胶体金法也不能检出。根据产品说明及国内外文献报道[6, 11],荧光免疫层析法可以同时用于甲型和乙型流感病毒的检测,在本实验期间,由于乙型流感阳性样本量不足,未对该法检测乙型流感病毒的性能进行评估。
本研究结果表明,荧光免疫层析试剂盒检测甲型流感病毒的灵敏度明显高于基于胶体金法的快速检测试剂盒,国外报道认为[11],这是由于荧光免疫层析法使用了独特的镧系稀土元素Eu-螯合物荧光标记,其激发光波长范围宽、Stockes位移大且荧光强度高、寿命长,有利于排除非特异性荧光的干扰,增强检测的准确性。另一方面,配套使用Sofia荧光免疫分析仪自动读取检测结果,避免了医务人员人工读取、人工记录造成的误差,这也使得整个测试的准确性和灵敏度更高。
从实验结果来看,荧光免疫层析法比传统胶体金法更加适用于临床流感样病例的准确诊断,其高度的检测灵敏度和特异性,自动化程度高,独特的阅读模式可用于批量检测,尤其适用于流感病毒的早期筛查。特别是在流感大规模爆发时期,婴幼儿免疫力低下,患儿极易发生合并感染等其他严重的并发症,应在病毒感染早期进行快速诊断并采取针对性治疗,而后进一步进行核酸检测、病毒分离确诊是否感染流感病毒[12]。
| [1] | Liaw YF, Chu CM. Hepatitis B virus infection[J]. Lancet , 2009, 373 (9663) : 582–592. DOI:10.1016/S0140-6736(09)60207-5 |
| [2] | Komatsu H, Inui A. Hepatitis B virus infection in children[J]. Expert Rev Anti Infect Ther , 2015, 13 (4) : 427–450. |
| [3] | Zeng Z. Human genes involved in hepatitis B virus infection[J]. World J Gastroenterol , 2014, 20 (24) : 7696–7706. DOI:10.3748/wjg.v20.i24.7696 |
| [4] | 周琴, 郜玉峰, 赵小苗, 等. IL-4基因多态性与HBV遗传易感性的研究[J]. 中华疾病控制杂志 , 2014, 18 (10) : 968–971. |
| [5] | Motavaf M, Safari S, Alavian SM. Interleukin 18 gene promoter polymorphisms and susceptibility to chronic hepatitis B infection:a review study[J]. Hepat Mon , 2014, 14 (7) : e19879. |
| [6] | Wu L, Chen L, Zhou L, et al. Association of interleukin 18 gene promoter polymorphisms with HBV recurrence after liver transplantation in Han Chinese population[J]. Hepat Mon , 2011, 11 (6) : 469–474. |
| [7] | 费筠, 陈月, 吴文苑. 白细胞介素与HBV感染的关系[J]. 临床肝胆病杂志 , 2014, 30 (2) : 174–177. |
| [8] | 夏旭, 杨钦河. 白细胞介素-19的研究近况[J]. 国外医学(免疫学分册) , 2002, 25 (6) : 324–328. |
| [9] | Liao YC, Liang WG, Chen FW, et al. IL-19 induces production of IL-6 and TNF-alpha and results in cell apoptosis through TNF-alpha[J]. J Immunol , 2002, 169 (8) : 4288–4297. DOI:10.4049/jimmunol.169.8.4288 |
| [10] | 中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南[J]. 中华传染病杂志 , 2005, 23 (6) : 421–431. |
| [11] | Zhang PA, Wu JM, Li Y, et al. Association of polymorphisms of interleukin-18 gene promoter region with chronic hepatitis B in Chinese Han population[J]. World J Gastroenterol , 2005, 11 (11) : 1594–1598. DOI:10.3748/wjg.v11.i11.1594 |
| [12] | Miyazoe S, Hamasaki K, Nakata K, et al. Influence of interleukin-10 gene promoter polymorphisms on disease progression in patients chronically infected with hepatitis B virus[J]. Am J Gastroenterol , 2002, 97 (8) : 2086–2092. DOI:10.1111/j.1572-0241.2002.05926.x |
| [13] | Shin HD, Park BL, Kim LH, et al. Interleukin 10 haplotype associated with increased risk of hepatocellular carcinoma[J]. Hum Mol Genet , 2003, 12 (8) : 901–906. DOI:10.1093/hmg/ddg104 |
| [14] | Zhu QR, Ge YL, Gu SQ, et al. Relationship between cytokines gene polymorphism and susceptibility to hepatitis B virus intrauterine infection[J]. Chin Med J (Engl) , 2005, 118 (19) : 1604–1609. |
| [15] | Moudi B, Heidari Z, Mahmoudzadeh-Sagheb H, et al. Association between IL-10 gene promoter polymorphisms (-592 A/C, -819 T/C, -1082 A/G) and susceptibility to HBV infection in an Iranian population[J]. Hepat Mon , 2016, 16 (2) : e32427. |
| [16] | Truelove AL, Oleksyk TK, Shrestha S, et al. Evaluation of IL10, IL19 and IL20 gene polymorphisms and chronic hepatitis B infection outcome[J]. Int J Immunogenet , 2008, 35 (3) : 255–264. DOI:10.1111/j.1744-313X.2008.00770.x |
| [17] | Ryckman KK, Fielding K, Hill AV, et al. Host genetic factors and vaccine-induced immunity to HBV infection:haplotype analysis[J]. PLoS One , 2010, 5 (8) : e12273. DOI:10.1371/journal.pone.0012273 |
| [18] | Yamamoto-Furusho JK, Álvarez-León E, Fragoso JM, et al. Protective role of interleukin-19 gene polymorphisms in patients with ulcerative colitis[J]. Hum Immunol , 2011, 72 (11) : 1029–1032. DOI:10.1016/j.humimm.2011.08.013 |
| [19] | Shao ZJ, Zhang L, Xu JQ, et al. Mother-to-infant transmission of hepatitis B virus:a Chinese experience[J]. J Med Virol , 2011, 83 (5) : 791–795. DOI:10.1002/jmv.v83.5 |
| [20] | Yucesoy B, Talzhanov Y, Johnson VJ, et al. Genetic variants within the MHC region are associated with immune responsiveness to childhood vaccinations[J]. Vaccine , 2013, 31 (46) : 5381–5391. DOI:10.1016/j.vaccine.2013.09.026 |
 2016, Vol. 18
2016, Vol. 18