2. 重庆医科大学附属儿童医院, 重庆 400014
乙型肝炎病毒(hepatitis B virus, HBV)感染是一个全球性的重大公共卫生问题,也是导致慢性肝炎、肝硬化、肝癌等严重疾病的主要原因[1]。据世界卫生组织统计, 我国有超过1.3亿人感染过HBV,2 400万发展成以肝功能损害和病毒复制为主要临床症状的慢性乙型肝炎(简称乙肝)。有报道指出,小于6岁的儿童感染HBV最容易发展为慢性感染,新生儿乙肝慢性化率为80%~90%,年龄小于6岁儿童为25%~30%,而成年人慢性化率不超过5%[2]。HBV感染的转归与宿主的遗传易感性密切相关,大量研究证实基因单核苷酸多态性(single nucleotide polymorphisms, SNPs)与HBV感染的转归密切相关[3-6]。
白介素(interleukin, IL)19属于IL-10家族,是一种重要的免疫调节因子。近年来,IL-10、IL-22等IL-10家族成员被报道与HBV感染和进展有关[7]。大量研究表明,IL-19参与免疫系统的调节功能,与炎症和感染、自身免疫性疾病相关联[8];IL-19可以诱导单核细胞分泌肿瘤坏死因子α(tumor necrosis factor α, TNF-α)和IL-6[9]。以上研究结果提示IL-19可能会影响HBV感染,但是国内尚没有关于IL-19基因多态性与儿童HBV易感性的相关报道。因此本研究旨在对IL-19基因多态性与儿童HBV遗传易感性的关系进行初步探讨。
1 资料与方法 1.1 研究对象2013年10月至2015年5月在重庆医科大学附属第一医院、重庆医科大学附属儿童医院和重庆市渝中区妇幼保健院三所医院门诊、住院的患儿中随机选择年龄6个月至小于6岁的136例乙肝儿童(病例组)和297例健康儿童(对照组)作为研究对象。乙肝诊断均符合2005年中华医学会肝病学分会修订的《慢性乙型肝炎防治指南》[10]诊断标准,且未合并其他病毒性肝炎及免疫相关性疾病等。本研究获得重庆医科大学附属儿童医院医学伦理委员会批准和家长(监护人)书面知情同意。
1.2 DNA的提取取外周静脉血3~5 mL,经2 000 rpm离心分离后,使用凝固血基因组DNA提取试剂盒(北京百泰克生物有限公司,DP6101)提取DNA;4℃冰箱过夜,使用NanoDrop 2000超微量分光光度计测定DNA浓度,DNA保存于-80℃冰箱备用。
1.3 PCR使用AssayDesigner 3.1软件进行引物设计。扩增位点rs1798的正向引物为5'-ACGTTGGATGCAGGCCCTTTCAGCAGATAG-3',反向引物为5'-ACGTTGGATGAGGCTGTCTTATTCCGCTTG-3',延伸引物为5'-TCTTATTCCGCTTGAAAATAG-3'。扩增位点rs2243193的正向引物为5'-ACGTTGGATGATCCTGGGAGTAAAGGGCTG-3',反向引物为5'-ACGTTGGATGTCACTTGGCTCACATCACAG-3',延伸引物为5'-ACAGACATGGACTATATGACTT-3'。rs2243191的正向引物为5'-ACGTTGGATGCATTAAATCCCTGGGAGAGC-3',反向引物5'-ACGTTGGATGCACTATACAGGTTCCTTGTC-3',延伸引物为5'-CCTTGTCATCAAGCTGAG-3'。PCR扩增条件:95℃预变性15 min;94℃变性20 s,56℃退火30 s,72℃延伸1 min,45个循环;再72℃延伸3 min;最后4℃恒温。
1.4 基因分型由博淼生物科技(北京)有限公司采用Sequenom Mass Array系统完成样本的基因分型。
1.5 统计学分析使用SPSS 20.0软件进行统计分析。符合正态分布的计量资料以均数±标准差(x±s)表示;计数资料以百分率(%)表示,两组间率的比较采用χ2检验;采用Fisher确切概率法检测对照组哈迪-温伯格平衡(Hardy-Weinberg equilibrium);应用非条件logistic回归模型分析等位基因和基因型的影响。P < 0.05表示差异有统计学意义。
2 结果 2.1 一般情况病例组平均年龄2.6±1.6岁,对照组平均年龄2.4±1.4岁,两组间年龄比较差异无统计学意义(P > 0.05)。病例组中男89例,女47例,对照组中男175例,女122例,两组间性别分布差异无统计学意义(P > 0.05)。
2.2 Hardy-Weinberg平衡检验经检验,对照组人群中rs1798、rs2243193、rs2243191均达到连锁不平衡(P > 0.05),表明选取的研究对象为达到遗传平衡的群体,具有群体代表性。
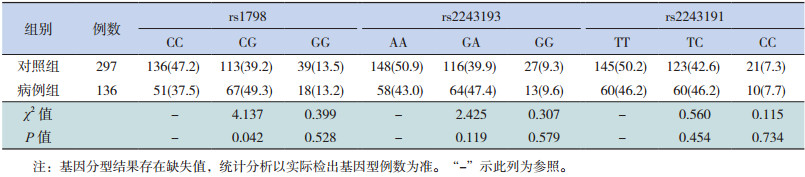
2.3 IL-19基因多态性与儿童HBV感染关联分析分析结果显示:位于IL-19基因上的rs1798的基因型在病例组和对照组间的分布有显著性差异,病例组的CG基因型的比例显著高于健康对照组(OR=1.581,95%CI:1.017~2.459,P < 0.05)。提示与rs1798 CC基因型相比,CG基因型可能增加儿童HBV感染的风险。而rs2243193和rs2243191各基因型在病例组和对照组中的分布差异均无统计学意义(P > 0.05),见表 1。
| 表 1 IL-19基因3个位点的基因型频率分布[n(%)] |
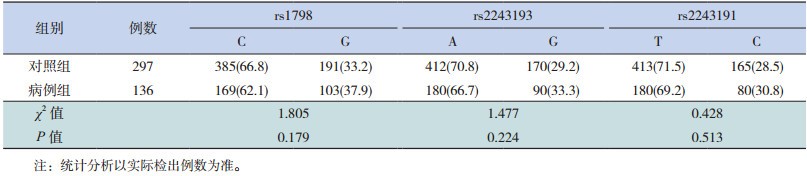
IL-19基因上的3个位点rs1798、rs2243193、rs2243191的等位基因在病例组和对照中分布差异无统计学意义(P > 0.05),见表 2。
| 表 2 IL-19基因3个位点等位基因的分布[n(%)] |
2.4 IL-19基因多态性与HBV感染高危儿童感染关联分析
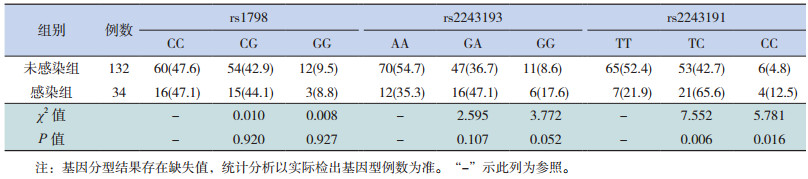
本研究中,HBV感染高危儿童定义为出生于乙肝表面抗原(HBsAg)阳性的母亲的儿童。这些儿童出生24 h内肌注乙肝免疫球蛋白(HBIG),剂量为100~200 IU,且按计划接种了乙肝疫苗。病例组和对照组中分别有34例及132例HBV感染高危儿童,采用非条件logistic回归模型分析IL-19基因上的各多态位点与HBV感染高危儿童感染的关联,分析结果显示,rs2243191的基因型在HBV感染高危儿童HBV感染组和未感染组的分布差异有统计学意义,感染组TC、CC基因型的比例显著高于未感染组(OR=3.679,95% CI:1.453~9.317;OR=6.190,95%CI:1.401~27.361,均P < 0.05)。见表 3。
| 表 3 IL-19基因3个位点的基因型在HBV感染高危儿童中的频率分布[n(%)] |
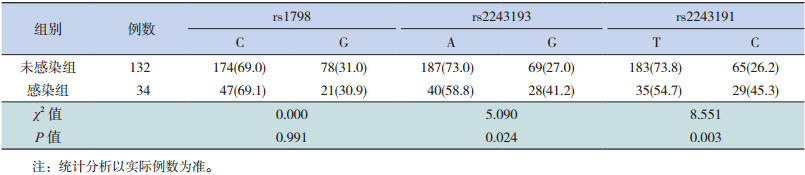
IL-19基因上rs2243193、rs2243191的等位基因在HBV感染的高危儿童感染组和未感染组中分布差异有统计学意义(P < 0.05),感染组rs2243191的等位基因C和rs2243193的等位基因G的比例显著高于未感染组,rs2243193的等位基因G和rs2243191的等位基因C可能增加HBV突破感染的风险(OR=1.897,95%CI:1.088~3.309;OR=2.333,95%CI:1.322~4.116),见表 4。
| 表 4 HBV感染高危儿童IL-19基因3个位点等位基因的分布[n(%)] |
2.5 单倍型分析
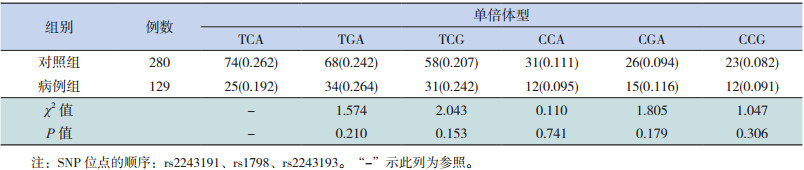
将位于IL-19基因上的3个多态位点(rs2243191、rs1798和rs2243193)导入Phase 2.0软件,病例组和对照组中分别构建了7种和8种单倍型,两组中发现频率 > 5%的单倍型共6种,分别为TCA、TGA、TCG、CCA、CGA、CCG。采用非条件logistic回归分析显示,与频率最高的TCA单倍型相比,其他各单倍型与儿童HBV感染的危险性均差异无统计学意义(P > 0.05),见表 5。
| 表 5 IL-19基因单倍型与儿童HBV易感性的关系[n(%)] |
3 讨论
研究报道遗传因素(如人类白细胞抗原),在HBV感染中扮演很重要的角色[11]。本研究结果表明IL-19基因的rs1798位点的基因型在病例组和对照组人群中频率分布差异有统计学意义,病例组的CG基因型的比例显著高于对照组,IL-19基因的rs2243191位点的基因型和等位基因在HBV感染高危儿童感染组和未感染组人群中频率分布差异有统计学意义,感染组TC、CC基因型以及C等位基因的比例显著高于未感染组。
近年来,IL-10被报道与HBV感染有关[7];IL-10基因多态性与HBV感染和进展有关[12-14]。Moudi等[15]报道在印度人群中,IL-10的基因启动子多态性与HBV易感性和HBV感染的临床转归有关。IL-10家族对免疫系统发挥着多种多样的调节作用,IL-10、IL-19等都属于IL-10家族[7]。目前国内尚没有关于IL-19基因多态性与儿童HBV易感性的相关报道,国外关于IL-19与HBV的报道主要集中于其单倍型与HBV感染的关系。Truelove等[16]曾报道IL-10、IL-20基因多态性会影响HBV感染的结局,而在美国人中IL-19(rs2243168、rs2243176、rs2243191)的单倍型与HBV感染无关。Ryckman等[17]在IL-19(rs12409415、rs2056225、rs2243158)的单倍型分析中表明,与AAC单倍型相比,ATG、GTG能增加乙肝表面抗体的水平。本研究显示,与rs1798 CC相比,rs1798 CG基因型可能增加儿童HBV感染的风险。目前国内外未见rs2243193和rs2243191位点的多态性与HBV感染相关报道,但Yamamoto-Furusho等[18]曾报道rs2243193的多态性与溃疡性结肠炎的发病有关。本研究结果显示rs2243193和rs2243191位点的等位基因和基因型在两组间差异无统计学意义,说明rs2243193和rs2243191位点的多态性对儿童HBV感染没有影响。本研究还通过单倍型分析发现,IL-19基因3个位点(rs2243191、rs1798、rs2243193)的单倍型差异无统计学意义,表明IL-19的单倍型对儿童HBV感染没有影响。
本研究中有166例HBV感染高危儿童,出生时均接种HBIG和乙肝疫苗,但仍然有34例儿童感染HBV。研究表明,免疫预防失败突破感染主要与产妇血清HBeAg阳性和高病毒载量有关[19]。但也有报道显示,相同年龄、性别、种族的儿童群体都暴露于高水平病毒载量的孕产妇,也出现不一致的临床结果,因此考虑宿主的遗传变异可能导致免疫预防的失败[20]。本研究进一步探讨IL-19基因的rs2243191、rs1798和rs2243193多态性和HBV感染高危儿童突破易感性的关系,发现rs2243191的多态性与HBV感染高危儿童感染HBV有关,携带TC和CC基因型与TT基因型相比可能增加HBV感染高危儿童突破感染的风险。由于基础资料的部分缺失,本文尚没有分析孕产妇HBV DNA载量、HBeAg阳性等高危因素对于乙肝疫苗和HBIG联合免疫阻断失败的影响,存在一定的不足。
综上所述,本研究结果表明,IL-19基因SNP位点rs1798的多态性可能与儿童HBV感染易感性有关,而IL-19基因rs2243191的多态性可能与HBV感染高危儿童感染易感性有关。由于本研究样本量较小,存在一定的局限性,今后尚需进一步扩大样本作深入探讨。
志谢: 感谢重庆医科大学附属第一医院、重庆医科大学附属儿童医院、重庆市渝中区妇幼保健院医务人员以及研究对象对本课题的支持。| [1] | Liaw YF, Chu CM. Hepatitis Bvirus infection[J]. Lancet , 2009, 373 (9663) : 582–592. DOI:10.1016/S0140-6736(09)60207-5 |
| [2] | Komatsu H, Inui A. Hepatitis B virus infection in children[J]. Expert Rev Anti Infect Ther , 2015, 13 (4) : 427–450. |
| [3] | Zeng Z. Human genes involved in hepatitis B virus infection[J]. World J Gastroenterol , 2014, 20 (24) : 7696–7706. DOI:10.3748/wjg.v20.i24.7696 |
| [4] | 周琴, 郜玉峰, 赵小苗, 等. IL-4基因多态性与HBV遗传易感性的研究[J]. 中华疾病控制杂志 , 2014, 18 (10) : 968–971. |
| [5] | Motavaf M, Safari S, Alavian SM. Interleukin 18 gene promoter polymorphisms and susceptibility to chronic hepatitis B infection: a review study[J]. Hepat Mon , 2014, 14 (7) : e19879. |
| [6] | Wu L, Chen L, Zhou L, et al. Association of interleukin 18 gene promoter polymorphisms with HBV recurrence after liver transplantation in Han Chinese population[J]. Hepat Mon , 2011, 11 (6) : 469–474. |
| [7] | 费筠, 陈月, 吴文苑. 白细胞介素与HBV感染的关系[J]. 临床肝胆病杂志 , 2014, 30 (2) : 174–177. |
| [8] | 夏旭, 杨钦河. 白细胞介素-19的研究近况[J]. 国外医学(免疫学分册) , 2002, 25 (6) : 324–328. |
| [9] | Liao YC, Liang WG, Chen FW, et al. IL-19 induces production of IL-6 and TNF-alpha and results in cell apoptosis through TNF-alpha[J]. J Immunol , 2002, 169 (8) : 4288–4297. DOI:10.4049/jimmunol.169.8.4288 |
| [10] | 中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南[J]. 中华传染病杂志 , 2005, 23 (6) : 421–431. |
| [11] | Zhang PA, Wu JM, Li Y, et al. Association of polymorphisms of interleukin-18 gene promoter region with chronic hepatitis B in Chinese Han population[J]. World J Gastroenterol , 2005, 11 (11) : 1594–1598. DOI:10.3748/wjg.v11.i11.1594 |
| [12] | Miyazoe S, Hamasaki K, Nakata K, et al. Influence of interleukin-10 gene promoter polymorphisms on disease progression in patients chronically infected with hepatitis B virus[J]. Am J Gastroenterol , 2002, 97 (8) : 2086–2092. DOI:10.1111/j.1572-0241.2002.05926.x |
| [13] | Shin HD, Park BL, Kim LH, et al. Interleukin 10 haplotype associated with increased risk of hepatocellular carcinoma[J]. Hum Mol Genet , 2003, 12 (8) : 901–906. DOI:10.1093/hmg/ddg104 |
| [14] | Zhu QR, Ge YL, Gu SQ, et al. Relationship between cytokines gene polymorphism and susceptibility to hepatitis B virus intrauterine infection[J]. Chin Med J (Engl) , 2005, 118 (19) : 1604–1609. |
| [15] | Moudi B, Heidari Z, Mahmoudzadeh-Sagheb H, et al. Association between IL-10 gene promoter polymorphisms (-592 A/C, -819 T/C, -1082 A/G) and susceptibility to HBV infection in an Iranian population[J]. Hepat Mon , 2016, 16 (2) : e32427. |
| [16] | Truelove AL, Oleksyk TK, Shrestha S, et al. Evaluation of IL10, IL19 and IL20 gene polymorphisms and chronic hepatitis B infection outcome[J]. Int J Immunogenet , 2008, 35 (3) : 255–264. DOI:10.1111/j.1744-313X.2008.00770.x |
| [17] | Ryckman KK, Fielding K, Hill AV, et al. Host genetic factors and vaccine-induced immunity to HBV infection: haplotype analysis[J]. PLoS One , 2010, 5 (8) : e12273. DOI:10.1371/journal.pone.0012273 |
| [18] | Yamamoto-Furusho JK, Álvarez-León E, Fragoso JM, et al. Protective role of interleukin-19 gene polymorphisms in patients with ulcerative colitis[J]. Hum Immunol , 2011, 72 (11) : 1029–1032. DOI:10.1016/j.humimm.2011.08.013 |
| [19] | Shao ZJ, Zhang L, Xu JQ, et al. Mother-to-infant transmission of hepatitis B virus: a Chinese experience[J]. J Med Virol , 2011, 83 (5) : 791–795. DOI:10.1002/jmv.v83.5 |
| [20] | Yucesoy B, Talzhanov Y, Johnson VJ, et al. Genetic variants within the MHC region are associated with immune responsiveness to childhood vaccinations[J]. Vaccine , 2013, 31 (46) : 5381–5391. DOI:10.1016/j.vaccine.2013.09.026 |
 2016, Vol. 18
2016, Vol. 18