肉碱棕榈酰转移酶Ⅱ(carnitine palmitoyltrans-feraseⅡ, CPTⅡ)缺乏症是由于线粒体内膜CPTⅡ缺乏导致中长链酰基CoA转运进入线粒体进行β氧化受阻所引起的疾病,属常染色体隐性遗传代谢性疾病,致病基因CPT2定位于1p32.3[1]。本病非常罕见,临床表现多样,在新生儿期、婴幼儿期、儿童期乃至成人期均可发病。主要临床表现为低血糖、昏迷、嗜睡、抽搐、癫癎、肌病以及肝功能异常等。本病进展速度快、病死率较高,本研究对1例经血酰基肉碱谱分析及基因突变检测验证的CPTⅡ缺乏症患儿的临床特点和基因突变情况进行报道,提高对该疾病的认识,为遗传咨询以及今后的产前诊断提供理论依据。
1 资料与方法 1.1 一般资料先证者,女,3个月,因发热伴抽搐1 h入院治疗。入院前8 h无明显诱因下开始出现发热,腋温38℃,入院前1 h出现持续抽搐,既往无头颅外伤史,足月剖宫产娩出,出生体重2.8 kg,无高危病史,无癫癎家族史和遗传疾病史。入院时体查:体温38.2℃,心率156次/min,呼吸46次/min,血压84/37 mm Hg,体重5.4 kg,面容正常,面色稍苍白,前囟张力稍高,双目凝视,双瞳孔等大等圆,直径3.5 mm,对光反射存在,颈软,双肺呼吸音清,心律齐,心音有力,心前区未闻及杂音,腹平软,未触及异常包块,肝肋下12 cm,脾肋下8 cm,质中,四肢肌张力稍增高,脑膜刺激征阴性。血气分析:pH 7.38,PCO2 30 mm Hg,BE -7.4 mmol/L,HCO3 -17.6 mmol/L,提示代谢性酸中毒;肌红蛋白 > 1 000 μg/L(0~46 μg/L),CK-MB 110 U/L(0~25 U/L);ALT 103 U/L(0~40 U/L),AST 260 U/L(0~40 U/L);血氨 > 300 μmol/L(0~54 μmol/L)。该患儿入院后3 h因抢救无效死亡。遂对其入院后留存的血样进行了血酰基肉碱谱分析,高度怀疑CPTⅡ缺乏症,并提取DNA进行基因检测加以验证。由于患儿病情进展迅速,在短时间内死亡,未能留取尿标本行尿有机酸分析。3年后患儿母亲再次妊娠,要求进行产前诊断。
1.2 血酰基肉碱谱分析采末梢血滴于专用采血滤纸(S & S903#)上,室温自然晾干后待检。参照文献[2]中血酰基肉碱的检测方法,并采用定量分析软件自动计算出所测样品中氨基酸和酰基肉碱的浓度。
1.3 CPT2基因突变分析及产前诊断根据知情同意原则,采集患儿及父母外周静脉血2 mL,EDTA抗凝处理,常规酚-氯法提取血液基因组DNA。患儿母亲妊娠16周,围产期检查胎儿发育正常,B超引导下抽取羊水20 mL,离心后分取细胞,提取DNA。针对CPT2基因的5个外显子,采用Primer Premier 5.0设计引物,扩增全部外显子以及与外显子交界的部分内含子区域。PCR反应体系为25 μL,包括TaKaRa LA Taq premix 12.5 μL,上、下游引物混合液0.75 μL(10 pmol/μL),基因组DNA100 ng,加去离子水至25 μL。PCR反应条件:95℃预变性3 min;94℃变性30 s,60℃退火30 s,72℃延伸40 s,38个循环;72℃延伸8 min。PCR产物经1.5%琼脂糖凝胶电泳鉴定。PCR扩增产物送英骏生物公司测序,结果与人类基因组CPT2基因序列进行比较。
2 结果 2.1 血酰基肉碱谱分析结果患儿6种血长链酰基肉碱水平均升高(表 1),其中血棕榈酰肉碱(C16)为24.2 μmol/L(正常参考值0.5~6.0 μmol/L),显著增高,高度怀疑CPTⅡ缺乏症。
| 表 1 患儿血酰基肉碱谱分析结果(μmol/L) |
|
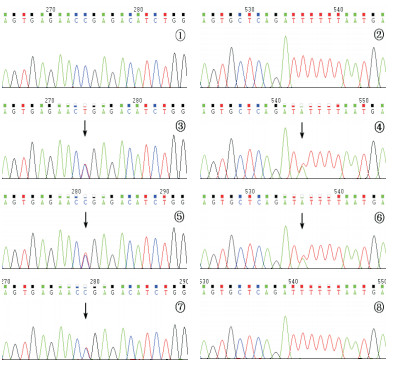
图 1 CPTⅡ缺乏症家系CPT2基因测序结果 ①②为正常对照序列;③、④分别为患儿CPT2基因c.886C > T(p.R296X)和c.1148T > A(p.F383Y)突变(箭头所示);⑤示父亲CPT2基因c.886C > T(p.R296X)杂合突变(箭头所示);⑥示母亲CPT2基因c.1148T > A(p.F383Y)杂合突变(箭头所示);⑦示胎儿CPT2基因c.886C > T(p.R296X)杂合突变(箭头所示);⑧示胎儿CPT2基因未检测出c.1148T > A(p.F383Y)突变。 |
2.2 患儿及父母CPT2基因测序结果
患儿CPT2基因外显子编码区测序结果提示已知致病突变c.886C > T(p.R296X)和c.1148T > A(p.F383Y)[3-4],突变来自父母双方,见图 1。
2.3 第二胎同胞产前诊断结果先证者母亲妊娠16周,围产期检查胎儿发育正常,于B超引导下抽取羊水20 mL,离心分取羊水细胞,提取DNA进行CPT2基因分析,提示胎儿为c.886C > T(p.R296X)突变携带者,见图 1。
胎儿出生后血酰基肉碱谱筛查未见明显异常(表 2),目前门诊随访至今6个月,生长及运动发育均达到正常同龄儿童水平。
| 表 2 第二胎血酰基肉碱谱分析结果(μmol/L) |
3 讨论
脂肪酸在应激状态下通过线粒体β氧化为机体供能,其过程需要多种酶催化完成。近年来研究发现在脂肪酸β氧化过程中大约有20余种活性酶参与,其中CPTⅡ在全身所有组织均有表达,位于线粒体内膜侧面,由658个氨基酸组成,全酶是一个同源四聚体,主要作用是把转入线粒体基质的酰基肉碱重新转变为相应的酰基辅酶A及游离肉碱,是长链脂肪酸进入线粒体参与β氧化的重要步骤[5]。如果其活性降低或缺乏,会导致脂酰基肉碱不能分解为脂酰辅酶A及肉碱,中、长链脂肪酸不能进入线粒体进行β氧化,大量酰基肉碱蓄积在线粒体基质不能被氧化利用,能量缺乏和代谢产物的毒性作用最终导致一系列生化异常和脏器损害[6-7]。CPTⅡ缺乏症分为4种亚型[8]:迟发型(MIM 255110)、婴儿型(MIM 600649)、致死性新生儿型(MIM 608836)及脑病型(MIM 614212)。主要临床表现为低血糖、昏迷、癫癎、肌病以及肝功能异常等。实验室检查提示低酮性低血糖、肌酸激酶及肝酶升高,血酰基肉碱谱筛查发现长链酰基肉碱(C12~C18:1)水平升高,其中以棕榈酰肉碱(C16)升高为主,尿有机酸分析可有二羧酸增高或正常,另外肌红蛋白异常升高也是该病的特点之一[9-11]。本例患儿发病初期表现为持续抽搐、肝脾肿大、肝功能异常、心肌酶及肌酸激酶升高,同时伴有肌红蛋白以及血氨显著升高等临床表现,血气分析提示代谢性酸中毒。患儿之前有发热症状,提示可能存在感染诱发因素,患儿病情进展迅速短时间内死亡,血酰基肉碱筛查C12~C18:1升高,以C16升高为主,初步诊断符合CPTⅡ缺乏症婴儿型。
本病于1973年由DiMauro等[12]发现,自发现第1例CPTⅡ缺乏症患者以来,国外已报道迟发型病例300余例,而婴儿型和致死性新生儿型较少见。不同国家和地区该病的患病率不同,美国报道本病患病率约为0.5/10万~1/10万,葡萄牙约为0.6/10万,德国约为0.09/10万,我国目前尚无详细流行病学调查报告,具体发病率不明确[13]。CPTⅡ缺乏症属常染色体隐性遗传病,目前已报道80余种突变类型,大部分为错义突变[14-15]。S113L、Q413fs、P50H是欧洲人群中常见的突变类型,以S113L最为常见[16-17]。Thuillier等[18]根据表型严重程度对39种突变类型进行了分类:(1)轻型突变:包含5种类型的突变(P5OH、S113L、R161W、E174K及I502T),这5种类型纯合突变时主要表现为迟发型CPTⅡ缺乏症;(2)重型突变:包括7种突变(R151Q、P227L、D328G、R382K、F383Y、Q448fs及Y628S),纯合突变时多表现为婴儿型或致死性新生儿型CPTⅡ缺乏症。因此可以通过检测CPTⅡ突变类型来预测疾病的严重程度。本家系中,患儿CPT2基因外显子编码区测序发现c.886C > T(p.R296X)和c.1148T > A(p.F383Y)复合杂合突变,致病突变来自父母双方,突变导致了CPTⅡ翻译终止,进一步影响中、长链脂肪酸不能进入线粒体进行β氧化,属于重型突变。本例患儿由于病情较为严重,最终死亡。较为幸运的是胎儿产前诊断基因型为c.886C > T(p.R296X),为致病基因携带者,出生后新生儿血酰基肉碱筛查未发现长链酰基肉碱有明显变化。目前第二胎同胞门诊随访至今6个月,生长及运动发育均达到正常同龄儿童水平。
CPTⅡ缺乏症临床表现各异,诊断主要依靠血酰基肉碱谱筛查发现C12~C18:1升高,尤其以C16和C18:1增高为主,排除其他有类似临床及生化表现的疾病后,通常可以明确诊断,必要时可以通过CPT2基因检测进一步验证。本病还需要与其他引起肌红蛋白尿或横纹肌溶解的疾病相鉴别诊断,如糖原累积病Ⅴ型、磷酸果糖激酶缺乏症、癫癎、血管炎、肌炎及肌肉挤压损伤等。另外,其他脂肪酸氧化代谢障碍疾病的临床表现也可与婴儿型或致死性新生儿型CPTⅡ缺乏症类似,如原发性肉碱缺乏症、CPTⅠ、肉碱酰基肉碱移位酶缺乏症、多种酰基CoA脱氢酶缺乏症等,必要时可通过尿有机酸分析鉴别诊断。本病治疗总的原则是避免饥饿和长时间运动,高碳水化合物和低脂饮食。急性期能量代谢危象时应持续高速静脉输注葡萄糖溶液,同时给予左卡尼汀每日100~200 mg/kg静脉输注,迟发型患者急性期最重要是预防横纹肌溶解所致的肾衰竭。慢性缓解期以补充左卡尼汀维持血中游离肉碱水平稳定为主,推荐剂量为左卡尼汀每日50~100 mg/kg口服,饮食方面限制长链脂肪酸的摄入、多进食富含中链脂肪酸和肉碱的食物。另外,近些年研究发现降脂药物苯扎贝特可使CPTⅡmRNA表达增加,增强残余酶活性,可改善患者临床症状及远期预后。
由于CPTⅡ缺乏症致死致残率较高,早期识别、早期诊断是本病预后的关键,目前我国部分地区已将此病列入新生儿疾病常规筛查项目,通过筛查血酰基肉碱谱长链酰基肉碱和尿二羧酸,进一步进行酶学检测或基因检测即可确诊。避免了发生误诊和漏诊的可能性,为临床提供了有力的确诊依据,对CPTⅡ缺乏症的早期诊断已成为可能。同时基因诊断为遗传咨询和产前诊断提供了重要信息,对于有再生育要求的家庭,建议进行产前诊断预防此类患儿出生。
| [1] | Isackson PJ, Bennett MJ, Lichter-Konecki U, et al. CPT2 gene mutations resulting in lethal neonatal or severe infantile carnitine palmitoyl transferase Ⅱ deficiency[J]. Mol Genet Metab , 2008, 94 (4) : 422–427. DOI:10.1016/j.ymgme.2008.05.002 |
| [2] | 韩连书, 高晓岚, 叶军, 等. 串联质谱分析干血滤纸片酰基肉碱方法的建立[J]. 中华检验医学杂志 , 2005, 28 (1) : 88–91. |
| [3] | Bonnefont JP, Djouadi F, Prip-Buus C, et al. Carnitine palmitoyl transferases 1 and 2: biochemical, molecular and medical aspects[J]. Mol Aspects Med , 2004, 25 (5-6) : 495–520. DOI:10.1016/j.mam.2004.06.004 |
| [4] | Yamamoto S, Abe H, Kohgo T, et al. Two novel gene mutations (Glu174→Lys, Phe383→Tyr) causing the "hepatic" form of carnitine palmitoyl transferase Ⅱ deficiency[J]. Hum Genet , 1996, 98 (1) : 116–118. DOI:10.1007/s004390050170 |
| [5] | Isackson PJ, Sutton KA, Hostetler KY, et al. Novel mutations in the gene encoding very long-chain acyl-CoA dehydrogenase identified in patients with partial carnitine palmitoyl transferase Ⅱ deficiency[J]. Muscle Nerve , 2013, 47 (2) : 224–229. DOI:10.1002/mus.v47.2 |
| [6] | Wieser T, Deschauer M, Olek K, et al. Carnitine palmitoyl transferase Ⅱ deficiency: molecular and biochemical analysis of 32 patients[J]. Neurology , 2003, 60 (8) : 1351–1353. DOI:10.1212/01.WNL.0000055901.58642.48 |
| [7] | 蔡敏, 姚敏, 木户博, 等. 肉碱棕榈酰基转移酶Ⅱ缺陷症的生化学研究[J]. 交通医学 , 2010, 24 (6) : 592–595. |
| [8] | 董碗娟, 陈万金, 王柠. 肉碱棕榈酰转移酶Ⅱ缺乏症研究进展[J]. 中华神经科杂志 , 2009, 42 (3) : 201–203. |
| [9] | Corti S, Bordoni A, Ronchi D, et al. Clinical features and new molecular findings in Carnitine Palmitoyl transferase Ⅱ (CPT Ⅱ) deficiency[J]. J Neurrol Sci , 2008, 266 (1-2) : 97–103. DOI:10.1016/j.jns.2007.09.015 |
| [10] | 张李霞, 高平明. 肉碱棕榈酰转移酶Ⅱ缺乏症1例[J]. 中国当代儿科杂志 , 2009, 11 (2) : 162. |
| [11] | 戴怡蘅, 张李霞, 邵巧仪. 新生儿期肉碱棕榈酰转移酶Ⅱ缺乏症4例临床分析[J]. 中国实用儿科杂志 , 2014, 29 (4) : 308–310. |
| [12] | DiMauro S, DiMauro PM. Muscle carnitine palmitoyl transferase deficiency and myoglobinuria[J]. Science , 1973, 182 (4115) : 929–931. DOI:10.1126/science.182.4115.929 |
| [13] | 顾学范. 临床遗传代谢病[M]. 北京: 人民卫生出版社, 2015 : 139 -141. |
| [14] | Anichini A, Fanin M, Vianey-Saban C, et al. Genotypephenotype correlations in a large series of patients with muscle type CPT Ⅱ deficiency[J]. Neurol Res , 2011, 33 (1) : 24–32. DOI:10.1179/016164110X12767786356390 |
| [15] | Joshi PR, Young P, Deschauer M, et al. Expanding mutation spectrum in CPT Ⅱ gene: identification of four novel mutations[J]. J Neurol , 2013, 260 (5) : 1412–1414. DOI:10.1007/s00415-013-6887-1 |
| [16] | Joshi PR, Deschauer M, Zierz S. Carnitine palmitoyl transferase Ⅱ (CPT Ⅱ) deficiency: genotype-phenotype analysis of 50 patients[J]. J Neurol Sci , 2014, 338 (1-2) : 107–111. DOI:10.1016/j.jns.2013.12.026 |
| [17] | Fanin M, Anichini A, Cassandrini D, et al. Allelic and phenotypic heterogeneity in 49 Italian patients with the muscle form of CPT-Ⅱ deficiency[J]. Clin Genet , 2012, 82 (3) : 232–239. DOI:10.1111/cge.2012.82.issue-3 |
| [18] | Thuillier L, Sevin C, Demaugre F, et al. Genotype/phenotype correlation in carnitine palmitoyl transferase Ⅱ deficiency: lessons from a compound heterozygous patient[J]. Neuromuscul Disord , 2000, 10 (3) : 200–205. DOI:10.1016/S0960-8966(99)00096-6 |
 2016, Vol. 18
2016, Vol. 18




