2. 青海省妇女儿童医院妇产科, 青海 西宁 810000 ;
3. 海口市人民医院神经科, 海南 海口 570208
吉兰-巴雷综合征(Guillain-Barré syndrome, GBS)是由感染、免疫、疫苗接种等因素引发的由T细胞介导的急性周围神经系统炎性脱髓鞘性自身免疫性疾病,病理表现主要是小血管周围淋巴细胞与巨噬细胞的炎性反应,周围神经和神经根的脱髓鞘,严重时发生轴突变性。GBS以进行性四肢肌力降低、腱反射减弱或消失、感觉障碍为典型表现,严重者可伴有呼吸肌麻痹,危及生命。GBS尚无特异疗法,临床主要采用免疫球蛋白疗法、激素冲击疗法、血浆置换疗法、免疫疗法等。目前,国内大剂量丙种球蛋白[0.4 g/(kg·d)]联合激素冲击治疗急性GBS的报道多见[1],且几乎成为专家共识,而小剂量丙种球蛋白联合激素冲击治疗GBS的临床试验鲜有报道,但有学者报道静脉滴注小剂量丙种球蛋白[0.2 g/(kg·d)]与大剂量丙种球蛋白治疗GBS的疗效无明显差异[2-3]。为此,本研究通过前瞻性随机对照试验对两种剂量丙种球蛋白联合糖皮质激素治疗儿童急性GBS的临床疗效进行了比较分析,报道如下。
1 资料与方法 1.1 研究对象本研究获得青海省妇女儿童医院医学伦理委员会批准,采用前瞻性研究方法进行研究。
纳入标准:年龄 < 14岁;符合GBS典型临床表现,并经脑脊液、肌电图检查综合确诊;近期有感染史;病程 < 2周;肌力4级以下;治疗方案获得监护人知情同意。急性GBS诊断标准[4]:疾病急骤,四肢对称性弛缓性瘫痪,腱反射减弱或消失,伴或不伴呼吸肌麻痹或脑神经障碍或末梢感觉障碍;脑脊液检查显示蛋白细胞分离特征;肌电图检查示早期F波或H波反射延迟,神经传导速度减慢,远端潜伏期延长;起病前1~3周有感染史。
排除标准:周期性麻痹、脊髓灰质炎、多发性神经病、重症肌无力、慢性GBS疾病及严重过敏史患儿。
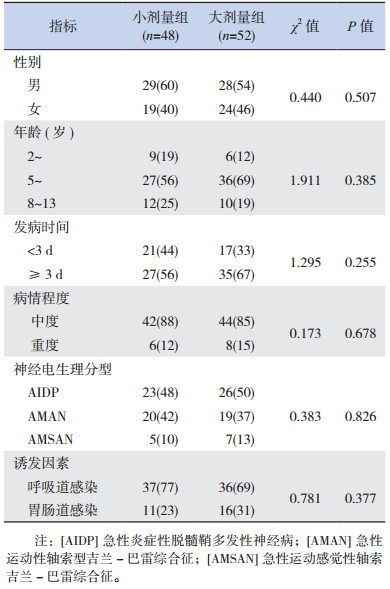
根据纳入和排除标准,入选2013年1月至2016年3月间收治的100例中度或重度急性GBS患儿为研究对象,采用随机盲法根据丙种球蛋白使用剂量将患儿分为小剂量组(48例)与大剂量组(52例)。小剂量组中,男29例,女19例,年龄2~12岁。大剂量组中,男28例,女24例,年龄3~13岁。两组患儿性别、年龄、发病时间、病情程度、神经电生理分型及诱发因素等的比较差异均无统计学意义(P > 0.05),见表 1。
| 表 1 两组患儿临床特征比较[n(%)] |
1.2 治疗方案
两组患儿均给予BIPAP呼吸机辅助呼吸、抗生素、能量合剂、复合维生素、神经生长因子、改善微循环药物等对症治疗,保持呼吸道通畅,必要时予气管插管或切开呼吸机辅助通气。此外,两组分别给予不同剂量丙种球蛋白联合注射用甲泼尼龙冲击治疗。具体为:小剂量组予丙种球蛋白0.2 g/(kg·d)(10% 3 mL/瓶,上海生物制品研究所有限责任公司,国药准字S10970081),溶于等体积5%葡萄糖溶液中静脉滴注。开始滴注速率为20滴/min,持续15 min若无不良反应,可加速滴注,最大速率不得超过60滴/min,连续5 d。注射用甲基强的松龙20 mg/(kg·d)(40 mg/支,辉瑞制药有限公司,批准文号H20130301),溶于5%葡萄糖溶液150 mL,静脉滴注,1.5 h滴完,连续3 d,后改为口服醋酸泼尼松片1.5 mg/(kg·d)(5 mg/片,浙江仙琚制药股份有限公司,国药准字H33021207),维持3~4周,用药2周后根据病情逐渐减量至停用。大剂量组予丙种球蛋白0.4 g/(kg·d),连续5 d,激素用法同小剂量组。
1.3 观察指标与疗效判定治疗前与治疗5 d后采集外周静脉血,测定炎性因子[肿瘤坏死因子(TNF-α)、白介素-6(IL-6)、C反应蛋白(CRP)]水平,记录两组症状改善时间(呼吸机麻痹恢复时间、肌力提升1级时间、感觉障碍恢复时间)、住院时间、有创通气比例及药物不良反应,治疗5 d后判定临床疗效。其中,血清TNF-α、IL-6的检测采用酶联免疫吸附夹心法,CRP的检测采用激光散射比浊法测定。
临床疗效判定标准参照文献[5]。显效:四肢肌力基本恢复正常,呼吸肌麻痹及球麻痹症基本消失,功能活动基本正常;有效:肌力开始恢复且不恶化,呼吸肌及球麻痹症状较治疗前改善;无效:肌力、呼吸肌麻痹、球麻痹无改善或加重,需借助呼吸机进行呼吸,痛、温、触觉及深感觉减退或消失。总体有效率=(显效例数+有效例数)/治疗总例数×100%。
1.4 统计学分析采用SPSS 19.0软件进行统计学处理与分析。定量数据用均数±标准差(x±s)表示,组间比较采用两样本t检验;定性数据用百分率(%)表示,组间比较采用χ2检验或Fisher精确概率法;单向有序列联表数据比较采用Mann-Whitney U秩和检验。P < 0.05为差异有统计学意义。
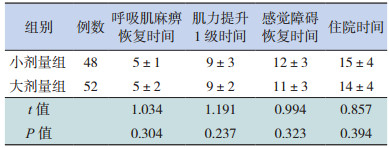
2 结果 2.1 两组临床疗效的比较大小剂量两组患儿呼吸肌麻痹恢复时间、肌力提升1级时间、感觉障碍恢复时间的比较差异均无统计学意义(P > 0.05);两组患儿住院时间比较差异亦无统计学意义(P > 0.05)。见表 2。
| 表 2 两组患儿症状改善时间及住院时间的比较(x±s,d) |
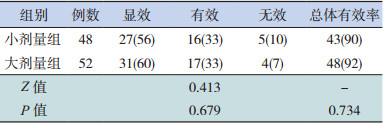
治疗过程中大小剂量两组分别有6例、5例患儿因呼吸肌麻痹导致血氧饱和度无明显改善而行气管切开辅助通气,两组气管切开比例(12% vs 10%)差异无统计学意义(χ2=0.032,P=0.858)。两组患儿治疗8~21 d后均明显好转,未出现死亡病例。治疗5 d后两组临床疗效比较差异无统计学意义(P > 0.05);大剂量组总体有效率略高于小剂量组,但组间比较差异无统计学意义(P > 0.05)。见表 3。
| 表 3 两组患儿治疗5 d后临床疗效比较[n(%)] |
2.2 两组治疗前后炎性因子变化的比较
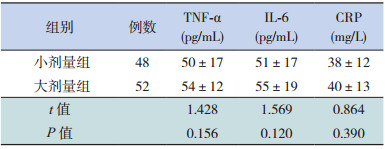
两组患儿治疗5 d后,血清TNF-α、IL-6、CRP水平均较治疗前明显下降,两组上述炎性因子治疗前后下降幅度差异无统计学意义(P > 0.05),见表 4。
| 表 4 两组治疗前后炎性因子差值的比较(x±s) |
2.3 两组不良反应的比较
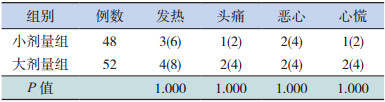
两组有少数患儿出现发热、头痛、恶心、心慌,通过减慢液体滴速、物理降温等措施,症状得以缓解。两组各种不良反应发生率比较差异无统计学意义(P > 0.05),见表 5。
| 表 5 两组患儿治疗期间不良反应发生率的比较[n(%)] |
3 讨论
GBS病因及发病机制尚未明了,目前认为是患者因急性病毒感染诱发的自身免疫性疾病[6]。GBS的治疗包括病因治疗和对症支持治疗,病因治疗目的是抑制免疫反应,减轻或消除致病性因子对神经髓鞘的损害,促进受损髓鞘的修复再生。病因治疗的一线方案主要包括免疫球蛋白疗法、血浆置换疗法、激素疗法等,血浆置换虽然疗效明显,但临床技术要求高、操作繁琐、费用昂贵,因而受到极大限制,不易推广。故目前GBS仍以免疫球蛋白疗法、激素疗法为主。
静脉注射丙种球蛋白是一种被动免疫疗法,也是公认的可以缩短疗程、减轻病情的有效疗法。静脉注射丙种球蛋白治疗GBS的作用机制为:提供特异性IgG抗体并中和致病性自身抗原,能阻断自身抗体与自身抗原的相互反应,减轻神经损伤;巨噬细胞膜Fc段受体(FcγR)的基因多态性与GBS发生、发展相关,丙种球蛋白能与FcγR结合,使其失去抗原呈递功能,阻断外周血单核细胞和巨噬细胞的多克隆活化及IgG等自身抗体的产生,阻断免疫炎症反应[7];能与自身抗体竞争结合靶组织,抑制T细胞、NK细胞而降低病理性免疫反应;充当活化补体成分的受体,阻止补体结合形成膜溶解性免疫复合物,防止补体介导性免疫损害[8]。因此,丙种球蛋白能发挥免疫替代和免疫调节的双重作用,急性期应用可减轻免疫系统对自身组织的攻击、损伤,缓解病情。激素是一种免疫抑制剂,糖皮质激素冲击疗法曾经被认为是GBS的经典疗法,有人主张若无禁忌证应早期给予足量甲基强的松龙冲击治疗。国外研究报道单纯激素治疗GBS尤其是重症GBS并不能有效缩短病程和改善预后[9]。国内报道,丙种球蛋白联合激素冲击治疗GBS的临床效果优于单纯使用丙种球蛋白[4, 10],可能的原因如下:甲基强的松龙冲击疗法能发挥激素的非特异性免疫抑制作用,进入血液后既能减轻免疫反应的过度激活,又能抑制多种炎性介质、细胞因子对神经髓鞘的损害;此外,甲基强的松龙具有膜稳定功效,能改善神经细胞膜的抗氧化能力,减轻细胞水肿,逆转神经传导阻滞,减轻脱髓鞘程度[11]。因此,甲基强的松龙冲击疗法可以从多环节抑制脱髓鞘的影响因素。免疫球蛋白与激素联合用药则互为补充,从不同作用机制消除脱髓鞘因素,有助于改善GBS尤其是中重度GBS患者的预后。
目前国内多采用IVIG 0.4 g/(kg·d)的冲击疗法治疗GBS,极少有IVIG 0.2 g/(kg·d)的报道。江利敏[12]报道,小剂量丙种球蛋白0.2 g/(kg·d)联合甲基强的松龙治疗成人GBS能获得较满意的临床疗效。国外有学者亦认为丙种球蛋白治疗GBS的合理剂量有待进一步探讨[13]。本研究通过前瞻性分析比较两种剂量丙种球蛋白联合甲基强的松龙治疗中重度儿童GBS的临床疗效,结果表明,两组患儿症状缓解时间、短期临床疗效、有创通气比例、不良反应发生率等临床指标均无明显差异。从实验室检测炎性指标看,GBS本身为免疫炎性反应,T细胞、巨噬细胞激活,炎性因子大量释放并参与神经损伤[14]。TNF-α主要是由T细胞和巨噬细胞分泌的Th1型细胞因子,是参与神经细胞和轴索损伤的重要细胞因子;CRP是一种急性时相反应非特异性蛋白,CRP可激活补体,产生大量炎症介质并释放氧自由基;IL-6是触发全身炎症反应的最强的内源性因子,能促进淋巴细胞的分化,能诱导CPR的生成并活化补体,加重免疫损伤和血管炎性反应。治疗5 d后,丙种球蛋白0.4 g/(kg·d)组上述实验室指标下降幅度略有优势,但组间差异不具有统计学意义,这说明两种方案在控制炎性反应方面效果相近。笔者分析,这可能与小剂量丙种球蛋白配伍大剂量甲基强的松龙已能充分发挥免疫调节和炎性抑制作用有关,大剂量丙种球蛋白虽能“锦上添花”,但已无法更多获益。从药物经济学角度分析,丙种球蛋白本身价格昂贵,大剂量使用势必增加患者经济负担,且单次大剂量丙种球蛋白可提高血液黏度,有加重心、肾负担及血栓性疾病的风险[15-16]。
综上所述,本研究显示,剂量为0.2 g/(kg·d)与0.4 g/(kg·d)的丙种球蛋白联合甲基强的松龙冲击治疗小儿中重度急性GBS临床疗效与安全性相当。考虑到国内对丙种球蛋白0.2 g/(kg·d)联合甲基强的松龙治疗GBS的报道较少,本研究属于单中心、小样本报道,因此有必要开展更多的、大样本的临床试验以进一步探讨丙种球蛋白治疗小儿急性GBS的适宜剂量。
| [1] | 何雪桃, 王丽娟, 陈洁玲, 等. 大剂量丙种球蛋白治疗吉兰-巴雷综合征相关因素分析[J]. 中国神经免疫学和神经病学杂志 , 2014, 21 (1) : 9–11. |
| [2] | 朱记军, 侍海存, 周桂龙. 不同剂量丙种球蛋白对急性吉兰-巴雷综合征疗效的比较[J]. 临床荟萃 , 2009, 24 (16) : 1409–1411. |
| [3] | Hughes RA, Swan AV, van Doorn PA. Intravenous immunoglobulin for Guillain-Barré syndrome[J]. Cochrane Database Syst Rev , 2014 (9) : CD002063. |
| [4] | 饶雪梅, 麦朗君, 李丽华. 激素联合丙种球蛋白治疗小儿格林巴利综合征的疗效观察[J]. 重庆医学 , 2012, 41 (17) : 1739–1740. |
| [5] | 王坤亮, 朱家攀. 大剂量丙种球蛋白联合甲基强的松龙治疗急性格林巴利综合征36例疗效观察[J]. 中国伤残医学 , 2014, 22 (4) : 139. |
| [6] | 王晓慧, 邹丽萍, 吴沪生, 等. 不同类型儿童吉兰-巴雷综合征的临床特点及治疗随访研究[J]. 中华儿科杂志 , 2011, 49 (8) : 583–586. |
| [7] | 耿娜, 张金彪, 仲伟斌, 等. 大剂量丙种球蛋白静脉注射治疗急性期格林-巴利综合征的临床疗效[J]. 中国医学创新 , 2015, 12 (32) : 65–68. |
| [8] | Zhang G, Massaad CA, Gao T, et al. Sialylated intravenous immunoglobulin suppress anti-ganglioside antibody mediated nerve injury[J]. Exp Neurol , 2016, 282 : 49–55. DOI:10.1016/j.expneurol.2016.05.020 |
| [9] | van Koningsveld R, Schmitz PI, Meché FG, et al. Effect of methylprednisolone when added to standard treatment with intravenous immunoglobulin for Guillain-Barré syndrome:randomised trial[J]. Lancet , 2004, 363 (9404) : 192–196. DOI:10.1016/S0140-6736(03)15324-X |
| [10] | 周劲松. 大剂量免疫球蛋白联合甲泼尼龙治疗急性格林巴利综合征的临床疗效[J]. 中国现代药物应用 , 2012, 6 (2) : 1–2. |
| [11] | 杨翠容, 余小兰. 丙种球蛋白联合糖皮质激素治疗格林巴利综合征患者的护理[J]. 中国临床护理 , 2012, 4 (5) : 386–388. |
| [12] | 江利敏. 激素联合小剂量丙种球蛋白治疗慢性格林-巴利综合征患者的疗效分析[J]. 中华脑科疾病与康复杂志(电子版) , 2012, 2 (1) : 53–56. |
| [13] | Kerr J, Quinti I, Eibl M, et al. Is dosing of therapeutic immunoglobulins optimal? A review of a three-decade long debate in Europe[J]. Front Immunol , 2014, 5 : 629. |
| [14] | 杨丹琪, 吴云. 格林-巴利综合征发病机制中相关细胞因子的作用[J]. 国际免疫学杂志 , 2015, 38 (6) : 596–598. |
| [15] | Vinod KV, Kumar M, Nisar KK. High dose intravenous immunoglobulin may be complicated by myocardial infarction[J]. Indian J Crit Care Med , 2014, 18 (4) : 247–249. DOI:10.4103/0972-5229.130579 |
| [16] | Elovaara I, Hietaharju A. Can we face the challenge of expanding use of intravenous immunoglobulin in neurology?[J]. Acta Neurol Scand , 2010, 122 (5) : 309–315. |
 2016, Vol. 18
2016, Vol. 18