10日龄Sprague-Dawley(SD)雄性大鼠购自成都达硕医学实验动物有限公司。pcDNA3.1(大连宝生物工程有限公司),TERT真核表达质粒pcDNA3.1-TERT由本实验室构建储存。兔抗TERT抗体、ECL化学发光底物(Millipore公司,美国);兔抗活化型半胱氨酸蛋白酶3(cleaved caspase 3, CC3)抗体、兔抗凋亡诱导因子(apoptosis-inducing factor, AIF)抗体(Cell Signaling Technology公司,美国);TUNEL细胞凋亡检测试剂盒(Roche公司,瑞士);小鼠抗β-actin抗体、辣根过氧化物酶标记山羊抗兔IgG(成都正能生物技术公司)。电泳系统、转印系统、化学发光凝胶成像系统(Bio-Rad公司,美国);动物缺氧舱(杭州艾普仪器设备有限公司);侧脑室微量注射器(汉密尔顿公司,瑞士)。
1.2 动物分组先将24只发育健康、喂养良好的10日龄SD新生大鼠进行模型验证,分为假手术组、HI 4 h组、HI 24 h组和HI 72 h组,每组6只。模型验证成功后,再取48只SD新生大鼠分为假手术组、HIBD组、空质粒组和TERT组,每组12只,其中每组取3只用于Western blot检测,取9只用于TUNEL染色。
1.3 动物模型制备采用乙醚吸入法进行动物麻醉。将新生大鼠仰卧位固定于实验台上,医用碘伏消毒颈部皮肤,在颈部正中偏右作长约0.5 cm的纵向切口,用眼科镊分离右侧颈总动脉(尽量避免损伤与血管伴行的迷走神经),采用5#手术缝合线双结结扎右侧颈总动脉,并在双结之间剪断,缝合皮肤切口,放回母鼠处休息1 h,然后将大鼠放入缺氧舱中,8%氧气和92%氮气的低氧混合气通气2.5 h,制作HIBD动物模型[6]。假手术组仅分离右侧颈总动脉,不结扎,不进行低氧处理。
1.4 侧脑室注射HI后0.5 h进行侧脑室注射给药,空质粒组注射pcDNA3.1,TERT组注射pcDNA3.1-TERT,注射剂量均为5 μL。动物经乙醚麻醉后俯卧位固定于实验台上,对耳线前缘作头皮正中切口,暴露前囟,在前囟向后2 mm,矢状缝向右2 mm处作为侧脑室注射位点,采用汉密尔顿侧脑室注射器垂直进针3 mm,缓慢注射,推注时间10 min左右,注射完毕留针2 min,然后缓缓将注射器垂直拔出,缝合皮肤。每次注射前侧脑室注射器均用无水乙醇浸泡灭菌。
1.5 苏木精-伊红染色石蜡切片脱蜡至水,苏木素染色3 min,蒸馏水洗涤。70%乙醇溶液分色后,伊红乙醇溶液染色3 min,梯度乙醇脱水,二甲苯透明,中性树胶封片。光学显微镜下观察脑组织病理改变。
1.6 Western blot检测转染TERT真核表达质粒或空质粒48 h后处死动物,取各组大鼠损伤侧大脑皮层组织,用细胞裂解液提取总蛋白。行SDS-PAGE电泳,湿转法将胶中蛋白水平转移至PVDF膜上,5% BSA常温封闭30 min,用封闭液稀释TERT抗体(1:1 000)、AIF抗体(1:2 000)、CC3抗体(1:500)和内参β-actin抗体(1:5 000),室温孵育1 h,4℃过夜;TBST洗膜后,用封闭液稀释二抗(1:3 000),室温孵育1 h,TBST洗膜,在膜上滴加ECL化学发光底物,在化学发光凝胶成像系统中曝光。用Gelpro32软件分析条带灰度值,蛋白相对表达量为目的条带与β-actin条带灰度值的比值。
1.7 TUNEL染色HI后24 h大鼠麻醉后灌注取脑,脑组织震动切片,切片厚度为40 μm,每个脑组织样本随机选取3张切片,以新鲜配置的细胞通透液(用0.1%柠檬酸钠配置的0.1% Triton X-100)常温处理5 min,加TUNEL反应液,37℃避光孵育1 h,PBS洗3次,DAPI染液常温孵育15 min,用抗荧光淬灭封片剂封片,激光共聚焦显微镜下随机选取5个视野观察,采集图像。计数凋亡细胞;计算凋亡指数(apoptosis index, AI)=(凋亡细胞数/总细胞数)×100%。
1.8 统计学分析采用SPSS 17.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示,多组间比较采用方差分析,组间两两比较采用SNK-q检验,P < 0.05为差异有统计学意义。
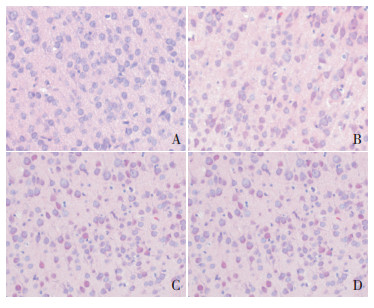
2 结果 2.1 HIBD新生大鼠模型验证假手术组大脑皮层中神经细胞与周围组织间无间隙,细胞核浆比例正常,排列有序(图 1A)。HI后大脑皮层组织出现不同程度的病理改变。HI 4 h时,大量细胞呈嗜酸性染色变,有的细胞与周围组织间隙增宽,组织结构相对疏松,细胞排列略紊乱(图 1B);HI 24 h时,细胞数目减少,许多神经细胞皱缩,与周围组织间隙明显增宽,细胞排列更加紊乱(图 1C);HI 72 h时,皱缩细胞增多,仍有大量嗜酸性变的神经细胞,细胞排列依然紊乱(图 1D)。表明HIBD模型建立成功,可用于后续实验研究。
|
图 1 HIBD大鼠脑组织病理学改变 (苏木精-伊红染色,×200)A:假手术组;B:HI 4 h组;C:HI 24 h组;D:HI 72 h组。假手术组大脑皮层神经细胞结构正常、排列整齐,与周围组织无间隙;HI后各时间点大脑皮层神经细胞数目减少、呈嗜酸性变、排列紊乱,与周围组织间隙增宽。 |
2.2 转染TERT对HIBD新生大鼠大脑皮层中TERT、AIF和CC3表达的影响
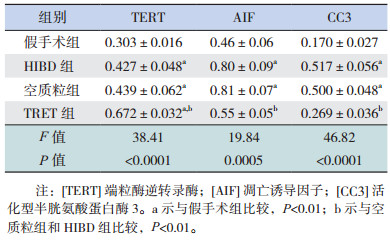
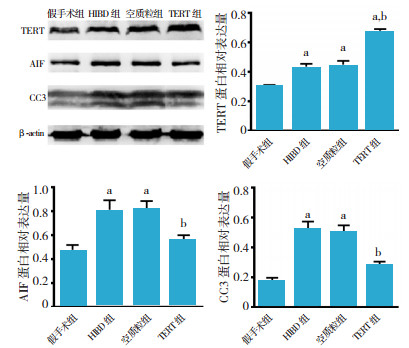
与假手术组相比,HIBD组、空质粒组和TERT组大脑皮层中TERT蛋白的表达均有所增加(P < 0.01);与空质粒组和HIBD组相比,TERT组TERT蛋白的表达明显上调(P < 0.01),表明侧脑室注射TERT真核表达质粒可明显上调HIBD大鼠大脑皮层中TERT蛋白的表达;HIBD组和空质粒组比较,TERT蛋白表达差异无统计学意义(P > 0.05)。与假手术组相比,空质粒组和HIBD组AIF蛋白表达均明显增加(P < 0.01),TERT组AIF蛋白表达差异无统计学意义(P > 0.05);与空质粒组和HIBD组相比,TERT组AIF蛋白表达明显减少(P < 0.01),表明转染TERT可抑制HIBD大鼠大脑皮层中AIF的表达;空质粒组与HIBD组间比较,AIF蛋白表达差异无统计学意义(P > 0.05)。与假手术组相比,空质粒组和HIBD组CC3蛋白表达均明显增加(P < 0.01),TERT组CC3蛋白表达差异无统计学意义(P > 0.05);与空质粒组和HIBD组相比,TERT组CC3蛋白表达明显降低(P < 0.01),表明转染TERT可抑制HIBD大鼠大脑皮层中caspase3蛋白的激活;空质粒组和HIBD组间比较,CC3蛋白表达差异无统计学意义(P > 0.05)。见表 1,图 2。
| 表 1 各组新生大鼠大脑皮层中TERT、AIF和CC3蛋白的表达比较(n=3,x±s) |
|
图 2 Western blot法检测转染TERT对HIBD新生大鼠大脑皮层中TERT、AIF和CC3表达的影响 A:Western blot电泳图;B:TERT蛋白相对表达量柱状图(n=3),C:AIF蛋白相对表达量柱状图(n=3),D:CC3蛋白相对表达量柱状图(n=3)。a示与假手术组比较,P < 0.01;b示与空质粒组和HIBD组比较,P < 0.01。 |
2.3 转染TERT对HIBD新生大鼠神经细胞凋亡的影响
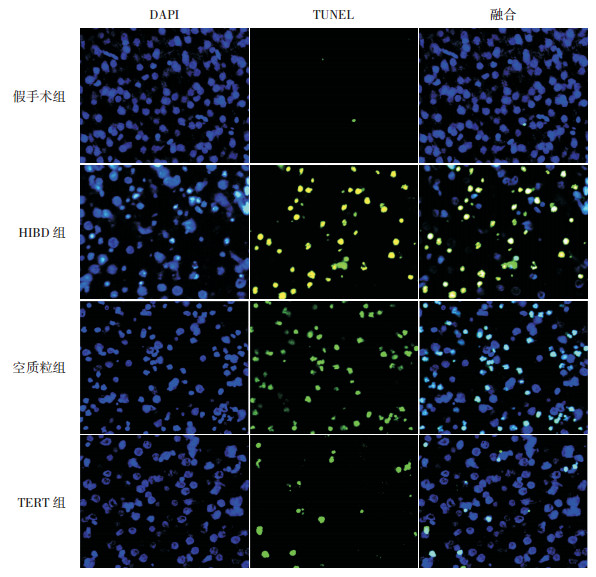
激光共聚焦显微镜下观察各组新生大鼠神经细胞TUNEL染色结果,凋亡神经细胞胞核呈绿色。结果显示:各组凋亡指数比较差异有统计学意义(F=193.2,P < 0.0001)。与假手术组(2.4%±0.6%)相比,HIBD组(52.8%±4.4%)、空质粒组(51.9%±7.0%)和TERT组(22.7%±6.4%)细胞AI值均显著增加(P < 0.01);与空质粒组和HIBD组相比,TERT组细胞AI值明显降低(P < 0.01),表明上调TERT水平可明显抑制HI诱导的神经细胞凋亡;而空质粒组和HIBD组间比较AI值差异无统计学意义(P > 0.05)。见图 3。
|
图 3 TUNEL法检测各组新生大鼠神经细胞凋亡情况(×400 左列为DAPI染色,中间列为TUNEL染色,右列为DAPI和TUNEL染色融合图。凋亡细胞呈绿色荧光。假手术组偶见凋亡细胞,HIBD组和空质粒组凋亡细胞较多,TERT组凋亡细胞数明显减少。 |
3 讨论
HIE是各种围产期因素引起的脑缺氧或缺血导致的急慢性脑损伤,具有极高的病死率和致残率。流行病学资料显示,即使发达国家,HIE仍是导致围生期死亡及儿童致残的主要原因[7]。据统计,HIE致残率在西方发达国家为1‰~8‰,在发展中国家为26‰[8-9]。HIE的后遗症表现为脑瘫、失明失聪、智力障碍等,严重影响患儿及家人的生活质量,给社会带来严重经济负担[10]。目前,新生儿HIE发病及修复机制尚未阐明,临床治疗手段局限于对症支持治疗,尚缺乏安全有效的HIE后遗症防治措施。迄今,亚低温疗法是缓减HIE症状,改善中重度HIE患儿预后的唯一有效的治疗措施[11-13]。科学家们对亚低温治疗的安全性及有效性尚存在争议[14-15],现有研究成果尚不能证实亚低温疗法可降低HIE的病死率及致残率。因此,深入探讨新生儿HIE的发生发展机制及损伤后修复机制,探索行之有效的治疗方法具有重要意义。
HIBD模型是经典的HIE的疾病模型。新生10日龄SD大鼠脑发育程度更接近于人类足月新生儿。因此,本研究采用10日龄SD大鼠为研究对象,在Rice法基础上加以改良,制备HIBD动物模型,以模拟足月新生儿脑损伤的变化过程。细胞凋亡是HIBD中神经细胞死亡的主要形式。脑组织发生HI时,能量锐减,细胞膜上Na+-K+-ATP泵功能衰竭、大量钠钙离子内流,线粒体膜通透性转运孔异常开放,AIF和细胞色素C释放,大量氧自由基和兴奋性氨基酸堆积,导致细胞凋亡。研究表明,细胞凋亡在HI损伤后数十分钟内发生,24~48 h达高峰,可持续数周[16]。细胞凋亡是一种慢性可逆的过程,很多因素可以阻断或减少凋亡的发生。因此,早期阻断细胞凋亡,减轻HIBD,已成为研究HIE治疗措施的重要途径。
TERT是端粒酶的催化亚基,其经典作用是维持端粒长度和延长细胞寿命。在中枢神经系统,TERT主要表达于胚胎期神经前体细胞和生后早期的神经元中[3, 17],随着神经细胞分化成熟,TERT表达逐渐降低,在出生后5 d几乎检测不到[18-19]。Baek等[20]在大脑中动脉栓塞动物模型的研究中发现,缺血性损伤能诱导TERT表达增加。本课题组前期研究结果显示,TERT蛋白表达在HI后4 h即开始增加,24~48 h达高峰[21],提示TERT可能在HIBD中发挥着重要作用。研究表明,TERT能通过抵抗N-甲基-D-天门冬氨酸(N-methyl-D-aspartate, NMDA)兴奋性神经毒作用、改善线粒体功能、减少Ca2+内流、抑制氧自由基产生等多种机制,发挥神经保护作用[4, 22-23]。抑制TERT表达可促进HI诱导的细胞凋亡,加重脑损伤[24]。既往研究中,本课题组采用反义寡核苷酸的方法抑制新生鼠脑组织中TERT的表达,发现抑制TERT后脑组织中CC3蛋白表达及细胞AI值均显著增加[5],提示TERT在HIBD中具有抗细胞凋亡作用。本研究中,我们应用TERT真核表达质粒上调脑组织中TERT的表达,发现上调TERT水平可有效抑制HI引起的细胞凋亡,进一步证实TERT可能是HIBD过程中重要的神经保护分子,上调TERT有利于改善HIBD。由于本实验样本量小,观察时间仅为2 d,因此,TERT基因治疗HIBD的远期治疗效果及安全性问题尚需深入研究分析。此外,TERT基因转染效率以及治疗时间窗等问题也有待进一步研究探索。
| [1] | Descloux C, Ginet V, Clarke PG, et al. Neuronal death after perinatal cerebral hypoxia-ischemia:focus on autophagy-mediated cell death[J]. Int J Dev Neurosci , 2015, 45 : 75–85. DOI:10.1016/j.ijdevneu.2015.06.008 |
| [2] | Rocha-Ferreira E, Hristova M. Plasticity in the neonatal brain following hypoxic-ischaemic injury[J]. Neural Plast , 2016, 2016 : 4901014. |
| [3] | Fu W, Killen M, Culmsee C, et al. The catalytic subunit of telomerase is expressed in developing brain neurons and serves a cell survival-promoting function[J]. J Mol Neurosci , 2000, 14 (1-2) : 3–15. DOI:10.1385/JMN:14:1-2 |
| [4] | Li J, Qu Y, Chen D, et al. The neuroprotective role and mechanisms of TERT in neurons with oxygen-glucose deprivation[J]. Neuroscience , 2013, 252 : 346–358. DOI:10.1016/j.neuroscience.2013.08.015 |
| [5] | Zhao F, Qu Y, Xiong T, et al. The neuroprotective role of TERT via an antiapoptotic mechanism in neonatal rats after hypoxia-ischemia brain injury[J]. Neurosci Lett , 2012, 515 (1) : 39–43. DOI:10.1016/j.neulet.2012.03.014 |
| [6] | Li L, Xiong Y, Qu Y, et al. The requirement of extracellular signal-related protein kinase pathway in the activation of hypoxia inducible factor 1 alpha in the developing rat brain after hypoxia-ischemia[J]. Acta Neuropathol , 2008, 115 (3) : 297–303. DOI:10.1007/s00401-008-0339-5 |
| [7] | Lange S. Peptidylarginine deiminases as drug targets in neonatal hypoxic-ischemic encephalopathy[J]. Front Neurol , 2016, 7 : 22. |
| [8] | Perlman JM. Intervention strategies for neonatal hypoxic-ischemic cerebral injury[J]. Clin Ther , 2006, 28 (9) : 1353–1365. DOI:10.1016/j.clinthera.2006.09.005 |
| [9] | Kurinczuk JJ, White-Koning M, Badawi N. Epidemiology of neonatal encephalopathy and hypoxic-ischaemic encephalopathy[J]. Early Hum Dev , 2010, 86 (6) : 329–338. DOI:10.1016/j.earlhumdev.2010.05.010 |
| [10] | Mwaniki MK, Atieno M, Lawn JE, et al. Long-term neurodevelopmental outcomes after intrauterine and neonatal insults:a systematic review[J]. Lancet , 2012, 379 (9814) : 445–452. DOI:10.1016/S0140-6736(11)61577-8 |
| [11] | Jacobs SE, Berg M, Hunt R, et al. Cooling for newborns with hypoxic ischaemic encephalopathy[J]. Cochrane Database Syst Rev , 2013 (1) : CD003311. |
| [12] | Kali GT, Martinez-Biarge M, Van Zyl J, et al. Therapeutic hypothermia for neonatal hypoxic-ischaemic encenphalopathy had favourable outcomes at a referral hospital in a middle-income country[J]. Acta Paediatr , 2016, 105 (7) : 806–815. DOI:10.1111/apa.2016.105.issue-7 |
| [13] | Gulczynska E, Gadzinowski J. Practical aspects of therapeutic hypothermia in neonates with hypoxic ischemic encephalopathy--questions and answers. Part Ⅰ. providing newborn care before and during transfer to the reference center[J]. Dev Period Med , 2015, 19 (3 Pt 1) : 247–253. |
| [14] | Horn AR, Harrison MC, Linley LL. Evaluating a simple method of neuroprotective hypothermia for newborn infants[J]. J Trop Pediatr , 2010, 56 (3) : 172–177. DOI:10.1093/tropej/fmp089 |
| [15] | Robertson NJ, Nakakeeto M, Hagmann C, et al. Therapeutic hypothermia for birth asphyxia in low-resource settings:a pilot randomised controlled trial[J]. Lancet , 2008, 372 (9641) : 801–803. DOI:10.1016/S0140-6736(08)61329-X |
| [16] | 王菊莉, 韩玉昆. 新生大鼠缺氧缺血性脑损伤神经细胞凋亡时程[J]. 新生儿科杂志 , 2003, 18 (3) : 111–113. |
| [17] | Klapper W, Shin T, Mattson MP. Differential regulation of telomerase activity and TERT expression during brain development in mice[J]. J Neurosci Res , 2001, 64 (3) : 252–260. DOI:10.1002/(ISSN)1097-4547 |
| [18] | Mattson MP, Fu W, Zhang P. Emerging roles for telomerase in regulating cell differentiation and survival:a neuroscientist's perspective[J]. Mech Ageing Dev , 2001, 122 (7) : 659–671. DOI:10.1016/S0047-6374(01)00221-4 |
| [19] | Caporaso GL, Lim DA, Alvarez-Buylla A, et al. Telomerase activity in the subventricular zone of adult mice[J]. Mol Cell Neurosci , 2003, 23 (4) : 693–702. DOI:10.1016/S1044-7431(03)00103-9 |
| [20] | Baek S, Bu Y, Kim H, et al. Telomerase induction in astrocytes of Sprague-Dawley rat after ischemic brain injury[J]. Neurosci Lett , 2004, 363 (1) : 94–96. DOI:10.1016/j.neulet.2004.03.059 |
| [21] | 赵凤艳, 屈艺, 唐彬秩, 等. 新生大鼠缺氧缺血性脑损伤后细胞凋亡与端粒酶逆转录酶的表达[J]. 中国修复重建外科杂志 , 2010, 24 (5) : 588–593. |
| [22] | Lee J, Jo YS, Sung YH, et al. Telomerase deficiency affects normal brain functions in mice[J]. Neurochem Res , 2010, 35 (2) : 211–218. DOI:10.1007/s11064-009-0044-3 |
| [23] | Ahmed S, Passos JF, Birket MJ, et al. Telomerase does not counteract telomere shortening but protects mitochondrial function under oxidative stress[J]. J Cell Sci , 2008, 121 (Pt 7) : 1046–1053. |
| [24] | Kang HJ, Choi YS, Hong SB, et al. Ectopic expression of the catalytic subunit of telomerase protects against brain injury resulting from ischemia and NMDA-induced neurotoxicity[J]. J Neurosci , 2004, 24 (6) : 1280–1287. DOI:10.1523/JNEUROSCI.4082-03.2004 |
 2016, Vol. 18
2016, Vol. 18