新生儿坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是一种病因尚不明确的急性肠道坏死性疾病,也是新生儿重症监护室内最常见的需要外科手术干预的疾病。本病多发生于早产儿,轻症病例预后良好,低出生体重儿病死率可高达15%~30%[1],部分存活患儿预后不良。NEC临床转归与疾病严重程度及诊治的早晚密切相关,因此,早期诊断、及时治疗是影响NEC转归的关键。一直以来,NEC的诊断主要依靠临床表现(喂养不耐受、腹胀、血便)和腹部X线平片改变(肠壁积气或肝门积气),但 腹部X线检查在NEC早期阶段表现不典型,其敏感性低,检查结果与临床表现可能不一致。近年来,不断有研究将腹部超声检查逐渐引入NEC的诊断评估中,并发现其具有便捷、实时、动态的优势[2, 3, 4, 5, 6, 7]。本研究收集我院新生儿科诊断为NEC的84例患儿的临床资料,分析腹部超声检查在NEC的诊断及疾病严重程度评估中的价值。
1 资料与方法 1.1 研究对象以2013年7月至2015年1月于我院新生儿科住院期间明确诊断为NEC的患儿为研究对象,共84例,其中男性55例,女性29例。患儿胎龄26.1~41周,平均34±4周,其中早产儿62例 (74%);出生体重750~4 400 g,平均2 055± 788 g。纳入标准:(1)符合《实用新生儿学》(第 4 版)以及修正的 Bell-NEC 分级标准进行的NEC临床诊断[8];(2)发病日龄为生后30 d以内;(3)患儿的辅助检查包括腹部平片及腹部超声,且两者检查时间间隔<24 h;(4)住院资料完整。排除肠道畸形(先天性巨结肠、肠闭锁、肠旋转不良等)、复杂性先天性心脏病者。
根据临床表现及腹部平片结果将84例NEC患儿分为NEC疑似组(n=44)及确诊组(n=40);另根据临床转归分为内科治愈组(n=58)及手术/死亡组(n=26),其中4例患儿病情危重虽有手术指征但家长拒绝手术,保守治疗后很快死亡而分在手术/死亡组。
1.2 腹部超声和腹部平片检查临床发现可疑NEC病例后,立即预约床旁腹部彩超及床旁腹部X线平片检查,两者首次检查时间差小于3 h(仅9%病例因医疗条件限制两者检查时间超过3 h),并且,根据患儿病情,间隔6~12 h复查床旁彩超及腹部X线片,所有受试者腹部超声检查均采用Mindray M7彩色多普勒超声诊断仪,线阵探头频率为7~12 MHz。检查由一名超声专科医生完成。X线检查采用SIEMENS MOBILETT XP Digital DR机,结果由放射科专科医生判读。
1.3 统计学分析所有数据应用SPSS 21.0统计学软件进行处理,正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用成组t检验;非正态分布计量资料以中位数及四分位数[M(P25,P75)]表示,组间比较采用秩和检验;计数资料采用χ2检验或校正χ2检验。P<0.05为差异有统计学意义。
2 结果 2.1 NEC疑似组与确诊组基本资料的比较NEC疑似组与确诊组在胎龄、出生体重、发病时间、白细胞总数、中性粒细胞绝对值、血小板计数及CRP的比较中差异无统计学意义(表 1)。
| 表 1 NEC 疑似组与确诊组基本资料的比较 |
在NEC疑似组,肠管扩张、肠管充气减少、肠壁增厚检出率在腹部彩超与腹部平片上比较差异无统计学意义(均P>0.05)。但在疑似组腹部超声发现3例门静脉积气,而腹部平片上未见该表现。在NEC确诊组,肠壁积气、腹腔游离气体、肠管充气减少及肠壁增厚在腹部彩超及腹部平片的检出率差异无统计学意义(P>0.05),而腹部超声发现肠管扩张、门静脉积气的比例高于腹部平片,差异有统计学意义(表 2)。
| 表 2 NEC 疑似组和确诊组中腹部彩超与腹部平片各项表现的比较 [n(%)] |
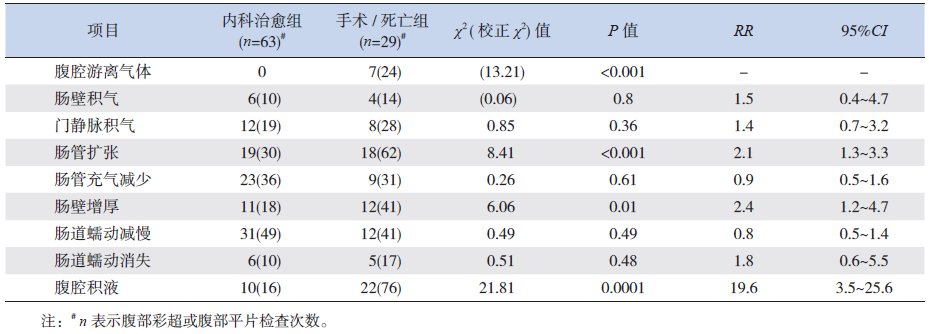
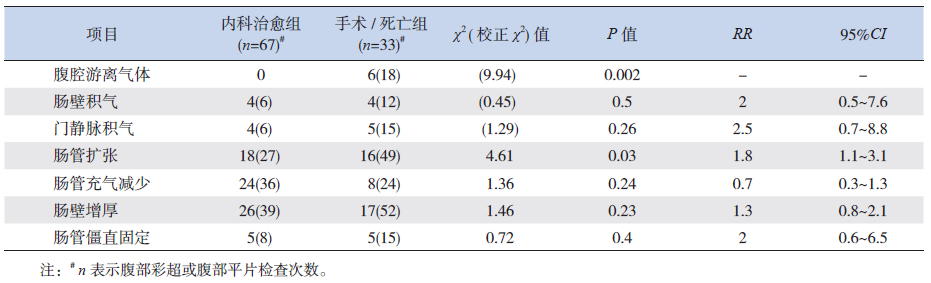
手术/死亡组腹部彩超对腹腔游离气体、肠管扩张、肠壁增厚及腹腔积液的检出率显著高于内科治愈组,差异有统计学意义(P<0.05),见表 3。手术/死亡组腹部平片显示腹腔游离气体、肠管扩张率显著高于内科治愈组,差异有统计学意义(P<0.05),见表 4。
| 表 3 内科治愈组与手术/ 死亡组的腹部彩超表现比较 [n(%)] |
| 表 4内科治愈组与手术/ 死亡组的腹部平片表现比较 [n(%)] |
随着围产医学技术的不断提高,早产儿尤其是极低出生体重儿的存活率逐年升高,与此同时NEC的发生率也呈上升趋势。如何降低NEC患儿的病死率、改善预后已日益受到关注。由于本病的早期诊治与预后密切相关,因此,不断有研究就本病的诊断手段及治疗方案进行探讨。近年来随着超声探头分辨率的不断提高,超声在新生儿NEC的诊治过程中优势逐渐显现,该研究用腹部X线检查对比探讨腹部超声检查在诊断新生儿NEC中的意义;且腹部超声可避免放射性损伤,能直视肠道蠕动、肠壁灌注及腹腔液体,因此与腹部平片相比,腹部超声在NEC的诊断中有其独特价值[4, 5, 6]。
本研究显示,在NEC的疑似期及确诊期,门静脉积气在腹部彩超的发现率为20%,相比腹部平片的9%发现率其敏感性更高。一般认为气体进入门静脉有两种途径,其一为肠管扩张内压增加,肠黏膜层的水肿、坏死、黏膜屏障破坏使得肠腔内气体渗入肠壁小静脉,经肠系膜血管回流至门静脉;另一途径为肠道及腹腔内产气菌直接感染造成门静脉内积气[9, 10, 11]。但临床上门静脉积气还可见于非坏死性的胃肠黏膜损伤、肠梗阻及肠管扩张、腹腔或盆腔脓肿、胎粪性肠梗阻用过氧化氢灌肠治疗时及脐静脉置管等。因此,超声检查发现门静脉积气存在,辅助明确NEC诊断时还需要结合患儿高危因素及临床表现。近年研究发现超声检查可用于NEC与其他新生儿肠道获得性疾病相鉴别(其发现门静脉积气的敏感性为82%,特异性96%)[10]。本研究NEC确诊组中,肠壁积气的检出率在腹部彩超和腹部平片上差异无统计学意义,与文献报道一致[5, 11]。另外,在NEC的早期,腹部平片不易发现肠道细小改变,如肠壁血流灌注减少、水肿、蠕动减慢、腹腔少量积液等,而此时,超声观察上述改变已较明显。本研究中疑似组有42%患儿肠道蠕动减慢,确诊组中,44%发现肠道蠕动减慢,67%发现腹腔积液,因此,腹部彩超在这些方面较腹部平片有其独特优势。
由于NEC病死率较高,存活患儿的生活质量亦是关注的重点。本研究发现,腹部超声显示肠管扩张、肠壁增厚及腹腔积液在手术/死亡组组显著高于内科治愈组,提示腹部超声的上述三项表现可作为预测疾病严重程度以及疾病早期不良转归的指标。由于肠道感染,肠道蠕动功能差,从而使肠腔内大量气体积聚,肠壁变薄,更易合并肠穿孔,且腹部平片发现肠管扩张病例在手术/死亡组更高,肠管扩张为手术或死亡的风险指标。相比之下腹部超声检查发现肠管扩张的敏感性较高。腹部超声检查结果提示腹腔积液是手术/死亡的危险因素,这是因为该因素可能与肠穿孔有关。本组病例中,腹部彩超及腹部平片检查到游离气体的患儿结果全需手术治疗或临床死亡,这与Silva等[3]报道的超声发现腹腔游离气体的患儿100%需手术治疗或临床死亡是相符的,该结果提示腹腔游离气体为手术/死亡的危险因素。国外有研究显示腹部平片发现肠袢僵直固定预示不良结果[12],但本研究未显示这样的结果,考虑与本研究样本量少有关,且本研究中缺少腹部彩超对肠管僵直的观察,亦为本研究的不足。本研究还提示门静脉积气在内科治愈组与手术/死亡组的发生率差异无统计学意义,提示门静脉积气既不是手术指征,也不预示临床不良结果,这与Sharma 等[13]的研究结果相同。由于临床上缺乏彩超诊断NEC的普遍使用的参考标准,因此直接比较腹部超声和腹平片上述表现的敏感度是较困难的,但整体来说,腹部超声的影像结果对NEC患儿的疾病严重程度及早期临床转归有预测作用。
综上所述,腹部超声在NEC的诊断及预测疾病严重程度上均有重要的作用,且无放射性损伤,可于床旁进行,并可密切监测,因此,可推广用于NEC的临床应用。本研究仅仅是对腹部超声检查在对NEC的诊断及疾病的严重程度评估的价值进行了对比,未对患儿住院时间的长短、肠狭窄、粘连性肠梗阻的发生率、患儿营养状态等近远期预后进行评估。因此,需要更多的针对腹部超声对于NEC诊断及严重程度评价方面的研究,对疑似或明确NEC的患儿,可以动态监测,随病情变化及时调整治疗方式,降低手术率及病死率,改善患儿预后。
| [1] | Neu J, Walker WA. Necrotizing enterocolitis[J]. N Engl J Med, 2011, 364(3):255-264. |
| [2] | Bohnhorst B. Usefulness of abdominal ultrasound in diagnosing necrotising enterocolitis[J]. Arch Dis Child Fetal Neonatal Ed, 2013, 98(5):F445-F450. |
| [3] | Silva CT, Daneman A, Navarro OM, et al. Correlation of sonographic findings and outcome in necrotizing enterocolitis[J]. Pediatr Radiol, 2007, 37(3):274-282. |
| [4] | Kim WY, Kim WS, Kim IO, et al. Sonographic evaluation of neonates with early-stage necrotizing enterocolitis[J]. Pediatr Radiol, 2005, 35(11):1056-1061. |
| [5] | Muchantef K, Epelman M, Darge K, et al. Sonographic and radiographic imaging features of the neonate with necrotizing enterocolitis:correlating findings with outcomes[J]. Pediatr Radiol, 2013, 43(11):1444-1452. |
| [6] | Garbi-Goutel A, Brévaut-Malaty V, Panuel M, et al. Prognostic value of abdominal sonography in necrotizing enterocolitis of premature infants born before 33 weeks gestational age[J]. J Pediatr Surg, 2014, 49(4):508-513. |
| [7] | Shebrya NH, Amin SK, El-Shinnawy MA, et al. Abdominal ultrasonography in preterm necrotizing enterocolitis. Is it superior to plain radiography?[J]. Egypt J Radiol Nuclear Med, 2012, 43(3):457-463. |
| [8] | 童笑梅. 新生儿坏死性小肠结肠炎[M]//邵肖梅, 叶鸿瑁, 邱小汕. 实用新生儿学. 第4版. 北京:人民卫生出版社, 2011:477-483. |
| [9] | Kinoshita H, Shinozaki M, Tanimura H, et al. Clinical features and management of hepatic portal venous gas:four case reports and cumulative review of the literature[J]. Arch Surg, 2001, 136(12):1410-1414. |
| [10] | Bohnhorst B, Kuebler JF, Rau G, et al. Portal venous gas detected by ultrasound differenciates surgical NEC from other acquired neonatal intestinal disease[J]. Eur J Pediatr Surg, 2011, 21(1):12-17. |
| [11] | Staryszak J, Stopa J, Kucharska-Miassik I, et al. Usefulness of ultrasound examinations in the diagnosis of necrotizing enterocolitis[J]. Pol J Radiol, 2015, 80:1-9. |
| [12] | Coursey CA, Hollingsworth CL, Wriston C, et al. Radiographic predictors of disease severity in neonates and infants with necrotizing enterocolitis[J]. AJR Am J Roentgenol, 2009, 193(5):1408-1413. |
| [13] | Sharma R, Tepas JJ 3rd, Hudak ML, et al. Portal venous gas and surgical outcome of neonatal necrotizing enterocolitis[J]. J Pediatr Surg, 2005, 40(2):371-376. |
 2016, Vol. 18
2016, Vol. 18