肺炎是儿童常见病、多发病,随着诊疗水平的提高,死亡率明显下降,但部分患儿反复发生肺炎,且反复肺炎发病率逐年增加[1],影响儿童的身心健康。反复肺炎发病机制复杂,在排除基础疾病或免疫缺陷性疾病的基础上仍有部分反复肺炎原因不明。有报道益生菌可以通过调节免疫功能,增强机体抗感染能力,缩短反复呼吸道感染病程[2, 3]。而目前关于反复肺炎患儿的肠道菌群变化、肠道黏膜的机械屏障功能变化以及二者关系的报道较少。本文旨在通过对照研究反复肺炎患儿、急性肺炎患儿及正常儿童粪便中的双歧杆菌、大肠杆菌菌群变化,以及血液中的D-乳酸水平,以期为益生菌治疗反复肺炎提供理论依据。
1 资料与方法 1.1 研究对象反复肺炎组(反复组):2014年6月至2015年6月经郑州大学第一附属医院儿科门诊或住院首次确诊的反复肺炎患儿30例,中位年龄5(4.52,6.16)岁,男22例,女8例,平均体重18.7±4.3 kg。反复肺炎的判断标准:指1年内反复发生肺炎≥2次,或一生中任意时段3次肺炎;肺炎由肺部体征和影像学证实,两次肺炎期间肺炎体征和影像学改变完全消失[4]。急性肺炎组(急性组):不满足反复肺炎诊断条件,同期我院门诊或住院的急性肺炎患儿30例,中位年龄5(4.371,5.86)岁,男19例,女11例,平均体重18.1±3.6 kg。外科组:同期我院小儿外科住院的无感染的发育异常儿童,如多指畸形等,15例,中位年龄5(4.66,6.34)岁,男9例,女6例,平均体重18.5±3.7 kg。其中3组患儿的年龄、性别、体重差异无统计学意义(P>0.05)。
以上3组儿童近4周内均未用抗生素、激素、抗组胺药及微生态制剂;平时饮食未摄入含益生菌的奶制品;近4周无胃肠道病史,无先天性心脏病、先天性肺发育畸形、先天性免疫缺陷病、支气管哮喘、肾脏疾病、过敏性紫癜、糖尿病等基础疾病;此次病程不超过3 天,且外院应用抗生素不超过1 天或未应用抗生素。本研究通过医院医学伦理委员会批准,同时获得家长书面知情同意。
1.2 标本采集入院第1天留取标本。用无菌离心管收集粪便标本,放置于-80℃冰箱保存;同时采集静脉血2 mL于肝素钠管中,离心后血清标本放置于-80℃冰箱内保存。
1.3 16S rRNA荧光定量PCR检测粪便双歧杆菌和大肠杆菌粪便目的细菌DNA提取试剂盒选用TIANamp Bacteria DNA Kit(TIANGEN),荧光染料为RealMasterMix(SYBR Green)(TIANGEN)。
提取肠道细菌基因组DNA。称取粪便样本200 mg冻融,按照试剂盒说明提取粪便细菌DNA,-20℃保存备用。
PCR引物设计。根据PubMed基因库中双歧杆菌及大肠杆菌16S rDNA基因序列设计引物,由天根生化有限科技公司合成,分别在BLAST数据库(www.ncbi.nlm.nih.gov/BLAST)进行比较。其中双歧杆菌引物:上游5-GATTCTGGCTCAGGATGAACGC-3,下游5-CTGATAGGACGCGACCCCAT-3,扩增片段为230 bp;大肠杆菌引物:上游5-CATGCCGCGTGTATGAAGAA-3,下游5-CGGGTAACGTCAATGAGCAAA-3,扩增片段为95 bp。
引物特异性检测,取外科组粪便进行荧光定量PCR,反应体系为:上游引物1 μL,下游引物1 μL,SYBR Green 9 μL,DNA模板 7 μL,ddH2O μL,共 20 μL,双歧杆菌和大肠杆菌反应条件均为:95℃预变性5 min后,95℃ 40 s,55℃ 20 s,68℃ 40 s,共40个循环,最后72℃延伸 10 min结束。取PCR产物10 μL与2 μL Loading Buffer混匀上样,琼脂糖凝胶电泳,可见2种细菌PCR扩增产物均显示出特异性条带。
荧光定量PCR,取外科组粪便提取的DNA,分别用双歧杆菌及大肠杆菌特异性引物进行扩增,将扩增产物按DNA琼脂糖凝胶回收试剂盒说明进行纯化回收,测定纯化产物吸光度值及浓度,换算为各标准品1 μL的拷贝数用于制作标准曲线。将3组提取的DNA分别进行16S rRNA荧光定量PCR,每次实验同时设标准品校正和ddH2O代替DNA模板作为阴性对照,根据溶解曲线分析PCR产物的特异性,并由Light Cycler PCR仪分析定量结果。
双歧杆菌和大肠杆菌含量以其对数值( 拷贝数/g湿便)表示,并计算双歧杆菌和大肠杆菌含量的比值(B/E值)
1.4 血清D-乳酸检测采用BioVision D-Lactate试剂盒,血浆经高氯酸去蛋白后,用酶偶联紫外分光光度法检测。
1.5 统计学分析采用SPSS 15.0统计软件,进行统计学处理。计量资料以均数±标准差(x±s)或中位数(四分位间距)[M(Q)]表示,组间比较采用Kruskal-Wallis检验,组间两两比较采用Wilcoxon 检验。相关性分析采用Pearson相关分析。P<0.05为差异有统计学意义。
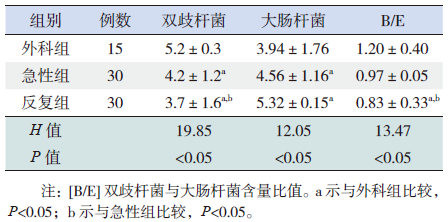
2 结果 2.1 各组大肠杆菌及双歧杆菌定量分析结果反复组患儿双歧杆菌数量明显低于急性组及外科组(Z分别为-2.139和-3.854,均P<0.05),急性组患儿双歧杆菌数量低于外科组(Z=-3.349,P<0.05);反复组、急性组患儿大肠杆菌数量明显高于外科组(Z分别为-2.364和-3.160,均P<0.05),反复组大肠杆菌数量与急性组差异无统计学意义(Z=-1.643,P>0.05);反复组患儿B/E值明显低于急性组和外科组(Z分别为-3.026和-3.149,均P<0.05),急性组患儿B/E值与外科组的差异无统计学意义(Z=-1.341,P>0.05)。见表 1。
| 表 1 各组两种细菌含量比较( x±s) |
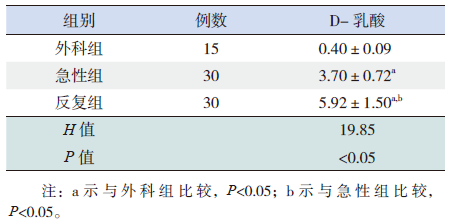
反复组患儿血清D-乳酸明显高于急性组及外科组(Z分别为6.071和16.411,均P<0.05),急性组患儿血清D-乳酸较外科组高(Z=20.707,P<0.05)。见表 2。
| 表 2 各组D- 乳酸的定量分析结果比较( x±s, μg/mL) |
Pearson相关分析表明,反复组患儿的B/E值与血清D-乳酸呈直线负相关(r=-0.539,P<0.05)。见图 1。
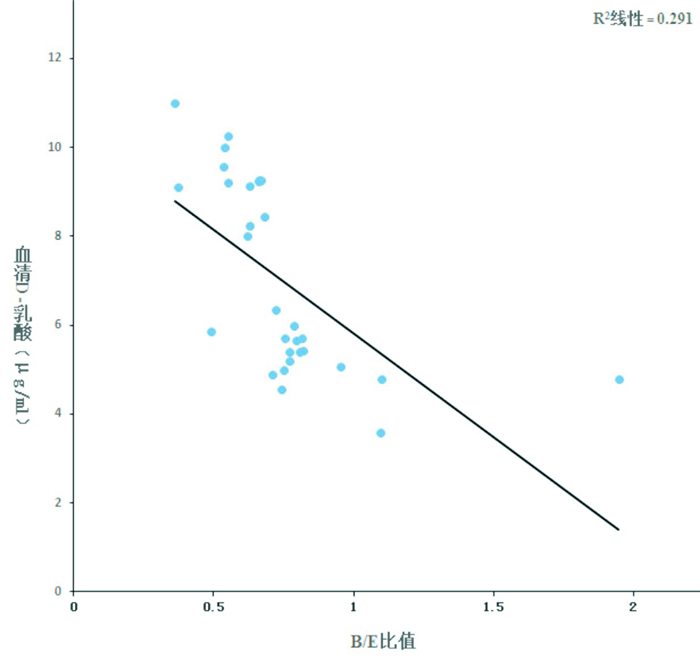 |
图 1 反复肺炎患儿的B/E 值与血清D- 乳酸的相关性 |
肺炎是儿童常见疾病,多见于学龄前儿童,死亡率仍较高。反复肺炎占儿童肺炎总数的8%左右,其发病受多种因素影响[5]。目前国内外研究发现,反复肺炎患儿存在免疫功能紊乱,主要以细胞免疫紊乱为主,尤其是辅助T淋巴细胞功能异常是儿童反复肺炎的重要原因[6, 7];另外吴小川等[8]报道反复肺炎可能是导致高IgE的免疫基础,有促发气道高反应及哮喘等可能;Chillvers等[9]认为反复肺炎也可引起支气管哮喘的发生,因此反复肺炎也可能与过敏性疾病相关。而肠道菌群紊乱可以引起免疫功能改变及过敏性疾病的发生[10]。
目前关于反复肺炎与肠道菌群及血浆D-乳酸变化的相关_性研究较少。临床研究显示,益生菌治疗反复肺炎有明确疗效,但相关机制尚未明 确[11]。本研究发现,反复肺炎患儿双歧杆菌数量明显减少,大肠杆菌数量增加说明反复肺炎可能存在菌群失调。研究发现双歧杆菌或乳酸杆菌可通过Toll样受体2(TLR2)影响肥大细胞的功能,在体外双歧杆菌预处理的致敏IgE肥大细胞,经抗原刺激未发生脱颗粒,提示益生菌可能产生抗过敏效应[12],而过敏体质是反复肺炎的危险因素之一[13]。另有研究发现[2, 3],益生菌通过免疫调节作用可以促进黏膜的抗病原能力甚至产生免疫耐受,作用于肠道外远隔部位的黏膜免疫。口服益生菌可通过作用于TLR2产生细胞因子,募集中性粒细胞或增强其功能,减少促炎因子及下调黏附分子的表达来提高固有免疫,同时还可以增加呼吸道产生IgA的细胞及促进IgA循环[14]。这些研究均提示益生菌可以上调呼吸道的特异性及非特异性免疫反应,减少过敏及呼吸道感染的发生。
肠道内B/E可作为评估肠道微生物定植抗力的新指标[15, 16]。本研究发现反复肺炎患儿B/E值<1,明显低于急性肺炎及外科组患儿,说明反复肺炎患儿肠道定植抗力较急性肺炎患儿及正常儿童均低,进一步说明反复呼吸道感染患儿肠道定植抗力减弱。
D-乳酸主要由胃肠道细菌发酵产生,正常情况下很少被吸收,在肠粘膜发生急性缺血等情况下,血清D-乳酸可在损伤早期就升高,且与肠粘膜的损伤程度呈正比,血清D-乳酸水平可以反映肠道粘膜损害的程度和通透性变化[17]。本研究发现反复肺炎患儿血清D-乳酸较急性肺炎患儿高,说明其肠道粘膜损伤较急性肺炎重。另外反复肺炎患儿B/E值与血清D-乳酸呈直线负相关,说明肠道菌群平衡可能对肠道黏膜的机械屏障有重要作用,肠黏膜屏障受损可能在反复肺炎发生中起重要作用。
综上述,反复肺炎患儿可能存在肠道菌群紊乱,表现为双歧杆菌减少,大肠杆菌增加,肠道粘膜通透性明显增加。因此,在合理应用抗生素同时,加强肠道微生态平衡,刺激增强免疫作用,从而促进疾病恢复。
| [1] | Lodha R, Puranik M, Natchu UCM, et al. Recurrent pneumonia in children:clinical profile and underlying causes[J]. Acta Paediatr, 2002, 91(11):1170-1173. |
| [2] | Villena J, Oliverira ML, Ferreira PC, et al. Lactic acid bacteria in the prevention of pneumococcal respiratory infection:future opportunities and challenges[J]. Int Immunopharmacol, 2011, 11(11):1633-1645. |
| [3] | Vouloumanou EK, Makris GC, Karageorgopoulos DE, et al. Probiotics for the prevention of respiratory tract infections:a systematic review[J]. Int J Antimicro Agents, 2009, 34(3):e1-e10. |
| [4] | 中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 反复呼吸道感染的临床概念和处理原则[J]. 中华儿科杂志, 2008, 46(2):108-110. |
| [5] | 中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 儿童社区获得性肺炎管理指南(2013修订)(上)[J]. 中华儿科杂志, 2013, 51(10):745-752. |
| [6] | Owayed AF, Campbell DM, Wang EE. Underlying causes of recurrent pneumonia in children[J]. Arch Pediatr Adolesc Med, 2000, 154(2):190-194. |
| [7] | 李小青, 段明玥, 李丹, 等. 反复呼吸道感染患儿细胞及体液免疫功能分析[J]. 中国妇幼健康研究, 2013,24(4):469-471. |
| [8] | 吴小川, 周杜娟. 儿童反复呼吸道感染的支气管粘膜免疫和气道高反应变化[J]. 临床儿科杂志, 2011, 29(1):22-25. |
| [9] | Chilvers MA, O'Callaghan C. Local mucociliary defence mechanisms[J]. Pediatr Respir Rev, 2000, 1(1):27-34. |
| [10] | Takahashi K. Interaction between the intestinal immune system and commensal bacteria and its effect on the regulation of allergic reactions[J]. Biosci Biotechnol Biochem, 2010, 74(4):691-695. |
| [11] | 陈汝文,杨静,薛辉,等. 益生菌治疗反复呼吸道感染的相关机制[J]. 中国小儿急救医学, 2012, 19(5):539-540. |
| [12] | Kasakura K, Takahashi K, Aizawa T, et al. A TLR2 ligand suppresses allergic inflammatory reactions by action directly on mast cells[J]. Int Arch Allergy Immunol, 2009, 150(4):359-369. |
| [13] | Dellepiane RM, Pavesi P, Patria MF, et al. Atopy in preschool Italian children with recurrent respiratory infections[J]. Med Surg Pediatr, 2009, 31(4):161-164. |
| [14] | Salava S, Villena J, Alvarez S. Immunomodulatory activity of Lactobacillus rhamnosus strains isolated from goat milk:impact on intestinal and respiratory infections[J]. Int J Food Microbiol, 2010, 141(1-2):82-89. |
| [15] | van der Waaij D, Berghuis-de Vries JM, Lekkerkerk-van der Wees JEC. Colonization resistance of the digestive tract in conventional and antibiotic-treated mice[J]. J Hyg(Lond), 1971, 69(3):405-411. |
| [16] | 吴仲文, 李兰娟, 马伟航, 等. 肠道微生物定值抗力的新指标-B/E值[J]. 浙江预防医学, 2000, 12(7):4-5. |
| [17] | Szalay L, Umar F, Khadem A, et al. Increased plasma D-lactate is associated with the severity of hemorrhagic/traumatic shock in rats[J]. Shock, 2003, 20(3):245-250. |
 2016, Vol. 18
2016, Vol. 18