原发性肾病综合征(primary nephrotic syndrome,PNS)是常见的肾脏疾病,口服糖皮质激素是首选的治疗方案[1],依据PNS对糖皮质激素治疗效应不同分为激素敏感型肾病综合征(steroid-sensitive nephrotic syndrome,SSNS)、激素耐药型肾病综合征(steroid-resistant nephrotic syndrome,SRNS)、激素依赖型肾病综合征(steroid-dependent nephrotic syndrome,SDNS)。SRNS约占肾病综合征的10%~20%,部分患儿由于持续性水肿、高脂血症、高血压、血栓以及感染最终引起肾功能衰竭,甚至死亡[2],临床治疗较为棘手,因其对单纯激素治疗的效果不佳,常需联合免疫抑制剂治疗。环磷酰胺、苯丁酸氮芥等被证明能够有效缓解尿蛋白,然而这些药物严重的不良反应使其长期疗效受到了限制[3]。目前环孢素A(cyclosporin A,CsA)与霉酚酸酯(mycophenolate mofetil,MMF)在SRNS中应用最为广泛。CsA属于钙调磷酸酶抑制剂类(calcineur ininhibitors)药物,已被改善全球肾脏病预后组织(KDIGO)指南推荐为SRNS治疗的一线药物[4]。MMF是一种新型免疫抑制剂,其具有不影响碳水化合物及脂质代谢、无肾毒性、不良反应少等优点[5]。目前国外有研究关于泼尼松联合CsA和MMF对于频复发型肾病综合征(FRNS)疗效的比较,结果表明MMF预防儿童FRNS患者复发的效果不如CsA,但对肾脏的毒性较弱[6]。但两者对于治疗SRNS的疗效有无差别目前尚无统一定论,因此,本研究收集湖南省儿童医院收治并采用泼尼松联合MMF或CsA为治疗方案的SRNS患儿的临床资料,旨在对两种治疗方案的临床疗效进行比较。
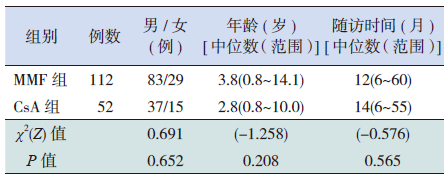
1 资料与方法 1.1 研究对象2004年1月至2013年12月湖南省儿童医院收治并采用泼尼松联合MMF或CsA为治疗方案的164例SRNS患儿为研究对象。其中男120例,女44例,入院中位年龄3.4岁。患儿家长在知情同意的基础上,自愿选择泼尼松联合MMF或泼尼松联合CsA治疗方案。前者简称为MMF组,112例,其中男83例,女29例,入院中位年龄3.8岁,随访中位时间12个月;后者简称为CsA组,52例,其中男37例,女15例,入院中位年龄为2.8岁,随访中位时间14个月。两组性别、年龄、随访时间比较差异均无统计学意义(表 1)。
| 表 1MMF 组与CsA 组一般资料比较 |
病例纳入标准:(1)临床诊断为SRNS(包括迟发型SRNS [7]),诊断标准按照中华医学会儿科学分会肾脏病学组制定的诊断标准[8, 9];(2)激素联合MMF或CsA治疗>6个月;(3)完善肾脏病理检查者(肾组织光学显微镜、免疫病理及电子显微镜检查);(4)有完整随访资料(随访时间>12个月)。
病例排除标准:(1)在服用MMF或CsA治疗前使用过其他免疫抑制剂;(2)合并严重感染;(3)合并肝、肾功能不全;(4)继发性、先天性肾脏疾病。
1.2 治疗方案激素治疗方案:所有纳入研究患儿均予泼尼松口服,初始剂量2 mg/(kg·d)(按身高的标准体重计算),最大剂量≤60 mg/d,晨起顿服;4~8周开始减量,每2~4周减量2.5~5 mg,至0.5~1 mg/kg 时维持3个月,以后每2周减2.5~5 mg至停药。
激素联合MMF治疗方案:2009年4月前收治的患儿于第8周末加用MMF,2009年4月后收治的患儿于第4周末加用MMF,剂量为20~ 30 mg/(kg·d),分两次口服(最大剂量1 g,每天2次),疗程1~2年。
激素联合CsA治疗方案:2009年4月前收治的患儿于第8周末加用CsA,2009年4月后收治的患儿于第4周末加用CsA,剂量2~3 mg/(kg·d),调整剂量使血药谷浓度维持在80~120 ng/mL,疗程1~2年。
1.3 观察指标随访观察期间,每2周查血常规、尿常规,每4周查24 h尿蛋白定量(按体重进行校正)、血肌酐、肝功能、血清白蛋白、血胆固醇。监测血压情况及不良反应的发生。
1.4 疗效判断MMF或CsA治疗后1、3、4、6个月进行疗效判断[9]。(1)完全缓解判断标准:临床症状、体征消失,尿蛋白连续3次转阴(24 h尿蛋白定量<150 mg/d),血清白蛋白恢复正常。(2)未完全缓解判断标准:24 h尿蛋白定量下降>50%、血清白蛋白水平上升定义为部分缓解;24 h尿蛋白定量下降<50%定义为未缓解。
对完全缓解患儿进行远期疗效观察。连续3 d晨尿蛋白由阴性转为(3+)或(4+)或24 h尿蛋白定量≥50 mg/kg或尿蛋白/肌酐≥2.0定义为复发。肾病病程中半年内复发≥2次,或1年内复发≥3次定义为频复发[9]。
1.5 统计学分析运用SPSS 18.0软件进行统计学处理与分析。本资料中计量资料为非正态分布,以中位数(范围)表示,组间比较采用Mann-Whitney U 检验,同组治疗前后指标比较采用Wilcoxon符号秩检验,组间对于同一指标进行不同时间点(治疗前、治疗1个月、治疗3个月、治疗4个月、治疗6个月)的重复测量观察指标的比较采用重复测量方差分析;计数资料采用百分率(%)表示,组间比较采用χ2检验或Fisher 精确概率法。P<0.05为差异有统计学意义。
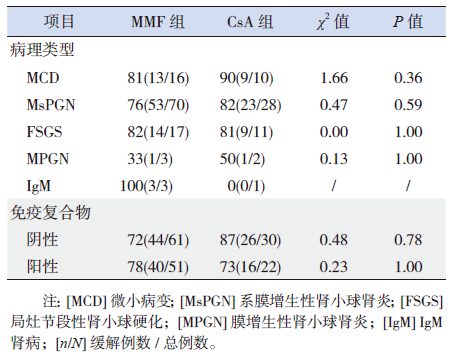
2 结果 2.1 肾脏病理肾脏病理类型:微小病变型(MCD)25例;非微小病变139例,其中系膜增生性肾小球肾炎(MsPGN)102例,局灶节段性肾小球硬化(FSGS)28例,膜增生性肾小球肾炎(MPGN)5例,IgM肾病4例。164例患儿中有免疫复合物沉积(包括IgM、IgG、补体C3、C4、C1q)的有73例,无免疫复合物者91例。MMF组与CsA组间病理类型构成、免疫复合物沉积差异无统计学意义(P>0.05)。
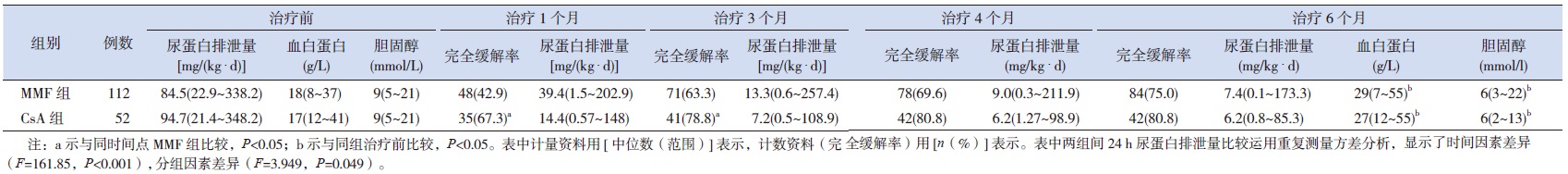
2.2 两组血生化值及24 h尿蛋白排泄量的比较MMF组与CsA组两组间治疗前、治疗6个月后血清白蛋白、胆固醇值比较差异均无统计学意义。MMF组、CsA组治疗6个月后的血清白蛋白值均高于治疗前(分别Z=-6.604、-4.342,均P<0.001);MMF组、CsA组治疗6个月后的血胆固醇值均低于治疗前(分别Z=-5.481、-4.383,均P<0.001)。而通过重复测量方差分析发现,MMF组与CsA组的24 h尿蛋白排泄量随治疗时间变化差异均具有统计学意义(F=161.885;P<0.001);MMF组与CsA组之间24 h尿蛋白排泄量存在差别(F=3.949;P<0.001);时间因素与分组因素未见交互作用(F=2.658,P=0.058)(表 2)。
| 表 2 MMF 组与CsA 组治疗疗效的比较 |
分别以治疗1、3、4、6个月为观察点,治疗1个月及3个月后CsA组完全缓解率均高于MMF组,差异有统计学意义(分别χ2=3.92、8.49,均P<0.05),而治疗4个月及个6个月后,两组间完全缓解率差异无统计学意义(表 2)。而对于6个月内未完全缓解的患儿,MMF组28例患儿中有15例加用CsA进行治疗,其中10例6个月内获得完全缓解,3例失访;13例加用他克莫司进行治疗,10例6个月内获得完全缓解,3例失访。CsA组无效的10例患儿加用他克莫司治疗,其中5例6个月内获得完全缓解,3例失访。
2.4 两组复发情况的比较对治疗6个月内完全缓解的患儿继续随访观察并统计复发次数,因随访时间长短不一(均≥12个月),分别统计每个患儿的平均复发次数及两组间的频复发例数。MMF组平均复发次数为0.93(0~4.5)次/年,CsA组平均复发次数为1.06(0~6)次/年,两组间比较差异无统计学意义(P>0.05)。MMF组和CsA组频复发率分别为21%(18/84)、29%(12/42),两组间比较差异无统计学意义(P>0.05)。
2.5 疗效与肾脏病理的关系本研究根据不同肾脏病理类型及免疫病理有无免疫复合物沉积进行分层分析,比较MMF和CsA治疗6个月的疗效。对同一治疗组之间进行不同病理类型与疗效的比较,发现MMF组和CsA组的疗效均与病理类型无显著相关性(P>0.05);对于MCD患儿,CsA组的缓解率为90%,高于MMF组缓解率(81%),但差异无统计学意义;对于非MCD的各病理类型组,两组间比较差异亦无统计学意义。在同一治疗组,MMF和CsA的疗效与有无免疫复合物沉积亦无显著相关性(P>0.05);而对于无免疫复合物沉积者,CsA组缓解率高于MMF组(87% vs 72%);对于有免疫复合物沉积者,MMF组缓解率高于CsA组(78% vs 73%),但差异均无统计学意义(表 3)。
| 表 3 MMF 组与CsA 组不同肾脏病理患儿缓解率的比较 [%(n/N)] |
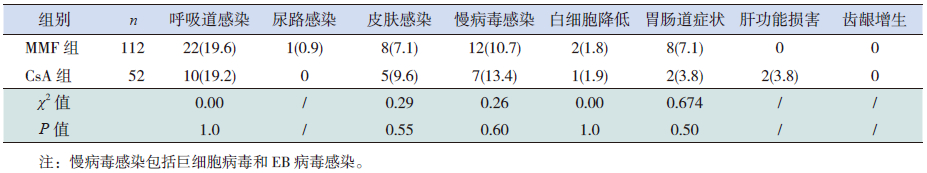
感染是两组最常见的不良反应(表 4)。另外MMF组有8例出现一过性腹泻、腹痛,CsA组中2例出现一过性肝功能损害,服用联苯双酯后肝酶可降至正常;CsA组有2例频复发患儿在用药2年后行重复肾活检,亦未见明显肾间质损害。对两组间用药12个月以上的患儿监测肾小球滤过率(Schwartz公式),MMF组治疗前后肾小球滤过率分别为137(范围77~230)、152(范围74~247)mL/(min·1.73 m2);CsA组治疗前后肾小球滤过率分别为128(范围77~186)、139(范围94~233)mL/(min·1.73 m2),两组间估算肾小球滤过率(eGFR)均无明显下降,且两组间治疗前后eGFR比较差异均无统计学意义(P>0.05)。两组均无严重不良反应出现。
| 表 4 两组治疗过程中的不良反应 [n(%)] |
SRNS是一种慢性、进行性疾病,其治疗一直是儿童肾病综合征治疗的难点。为避免一味延长足量激素使用时间所造成的药物毒副反应,激素联合免疫抑制剂治疗已是临床共识。目前MMF及CsA的应用较为广泛。CsA系钙调磷酸酶抑制剂,抑制钙依赖磷酸酶,可通过提高肾小球基底膜孔径的选择性及电荷的选择性,发挥降低分流滤过和促足突重建以降低蛋白尿水平的作用[10],并且通过稳定肾小球上皮细胞(足细胞)的骨架,从而减少肾小球性蛋白尿[11]。1986年CsA被Meyrier等[12]首次报道用于FRNS、SDNS和SRNS的治疗,可诱导缓解并控制复发。MMF是一种新型免疫抑制剂,为选择性细胞毒药物,已被广泛应用于预防同种异体肾移植的排斥反应,同时也用于自身免疫性肾脏疾病的治疗。其在体内迅速水解为具有免疫抑制活性的霉酚酸(MPA),MPA可抑制次黄嘌呤单核苷酸脱氢酶,阻断T和B淋巴细胞鸟嘌呤核苷酸的经典合成途径,减少循环免疫复合物浓度及相应减少免疫复合物在肾脏的沉积,延缓肾脏损害。Gellermann等[6]通过研究表明在第1年内,MMF治疗频复发患者的复发次数高于CsA,MMF治疗组缓解持续时间显著短于CsA治疗组,表明CsA对于治疗FRNS患儿的效果优于MMF,但其肾毒性高于MMF。Eiske等[13]的研究亦表明在治疗FRNS中MMF较CsA的不良反应小,然而MMF治疗后复发率更高。但两者对于SRNS疗效的比较,目前国内外报道较少。
本研究收集SRNS病例164例,由于6个月后部分病例更改治疗方案或联合其他药物治疗,因此,本研究仅比较泼尼松联合MMF和CsA两组治疗6个月内的疗效,分别以服药后1、3、4、6个月为观察时间点,系统观察比较激素联合MMF和联合CsA的临床疗效,总结得出激素联合MMF或CsA治疗SRNS的疗效均良好,均能有效缓解尿蛋白,提高血清白蛋白水平,降低血胆固醇。治疗后各观察时间点CsA组24 h尿蛋白排泄量均低于MMF组;治疗1个月、3个月时CsA组完全缓解率均优于MMF组,而治疗4个月、6个月时两组完全缓解率无明显差异。以上结果表明CsA能够更快地缓解尿蛋白。另外对6个月内完全缓解的病例进一步观察,因各病人随访时间长短不一,本研究通过对其进行平均复发次数及频复发例数比较,发现MMF组平均每年复发次数(0.93次)稍低于于CsA组(1.06次),MMF组频复发率(21%)稍低于CsA组(29%),但差异均无统计学意义。MMF组治疗后6个月内未完全缓解的28例患儿中,有15例加用CsA治疗,其中10例加用CsA治疗6个月内获得完全缓解,提示MMF与CsA在免疫抑制效应中具有协同作用,与国外报道相符[14]。
病理类型是影响SRNS预后的重要因素之一。不同的病理类型对药物的反应亦存在差异性。有学者对SRNS的预后进行多因素分析研究,发现病理类型为MCD患儿的有效率显著高于非MCD患儿[15]。国外研究86例SRNS患儿,CsA联合激素治疗在MCD患儿中有效率为100%,在非家族遗传性FSGS患儿中有效率为88%,但两组差异尚未有统计学意义[16]。Echeverri等[17]研究表明对于FSGS患儿MMF治疗1个月的缓解率为61.5%,且维持治疗1年以上可显著减少SRNS的复发率,并减少激素用量。国内有研究发现MCD 型PNS 患儿肾脏的微量IgM 沉积可能是糖皮质激素耐药及频复发的重要因素[18]。于是本研究再根据不同病理类型进行分层分析,比较MMF及CsA对不同病理类型PNS 患儿的疗效,发现治疗6个月后,对于病理类型为MCD的患儿,CsA组的缓解率(90%)高于MMF组(81%),但差异无统计学意义,这与国外报道[16]相似。近年来研究发现免疫反应在儿童PNS中发挥重要作用,主要机制为各种抗原刺激机体产生特异性抗体诱导免疫应答反应,形成免疫复合物在肾脏沉积,进而引起肾脏组织自身免疫性损伤。MMF近年来已被广泛应用于狼疮性肾炎的治疗,可改善狼疮性肾炎免疫复合物在肾脏的沉积、减少尿蛋白。于是本研究为了研究在SRNS患儿中不同免疫病理是否影响MMF及CsA疗效,对本组患者进行免疫病理分层分析,发现无免疫复合物沉积者,CsA组缓解率高于MMF组(87% vs 72%),对于有免疫复合物沉积者,MMF组缓解率高于CsA组(78% vs 73%),但差异均不显著。此差异可能系两种药物通过不同机制发挥效应有关,MMF主要通过有效减少抗体生成、减少免疫复合物在肾脏的沉积而发挥效应,而CsA除抑制抗体产生外,还通过稳定肾小球上皮细胞(足细胞)的骨架,从而减少肾小球性蛋白尿发挥效应。但对于MMF与CsA治疗疗效与免疫病理之间的相关性有待进一步更大样本的研究。
CsA的不良反应主要包括对肝肾功能的损害、高血压、多毛、齿龈增生、胃肠道反应及肾毒性等[18]。特别是因其肾毒性,故仅限于短期的治疗。而MMF除报道有感染、胃肠道症状外,无明显不良反应报道。本研究中两组患儿的主要不良反应均表现为感染,另MMF组有8例(7.1%)出现一过性腹泻、腹痛,CsA组中有2例(3.8%)出现一过性肝功能损害,但服用联苯双酯后肝酶可降至正常。另外Gellermann等[6]的研究发现,治疗12个月以后MMF治疗组的胱抑素清除率、eGFR均显著高于CsA治疗组,提示MMF对肾脏的毒性较CsA轻 。而本研究中CsA组有2例频复发患儿在用药2年后行重复肾活检,未见明显肾间质损害。且对两组间用药12个月以上的患儿监测肾小球滤过率,两组间eGFR均无明显下降,且两组间治疗前后eGFR无明显差异。本研究与国外报道[6]比较,CsA组未见明显肾毒性的原因可能与本组病例CsA应用为极低剂量,而且药物谷浓度维持在较低水平有关。本研究尽管在治疗期间患儿能够很好地耐受,没有严重的不良反应出现,但因研究资料观察随诊的时间长短不一,平均随访时间小于2年,故对于MMF及CsA的不良反应的比较仍需要收集更长时间的随诊观察资料。
综上所述,本研究通过比较泼尼松联合MMF与CsA治疗儿童SRNS的疗效发现,两种方案治疗儿童SRNS疗效均较好且安全,但在治疗3个月以内,泼尼松联合CsA治疗方案具有更高的完全缓解率,且能更大程度缓解蛋白尿,即CsA疗效优于MMF;但在治疗4个月以后,泼尼松联合MMF与CsA治疗两种方案的完全缓解率差异不显著。
| [1] | 易著文,吴小川,党西强, 等. 实用小儿肾脏病手册[M]. 北京:人民卫生出版社,2005:326-336. |
| [2] | 中华医学会儿科学分会肾脏病学组. 儿童常见肾脏疾病诊治循证指南(试行)(三):激素耐药型肾病综合征诊治指南[J]. 中华儿科杂志, 2010, 48(1):72-75. |
| [3] | Cammas B, Harambat J, Bertholet-Thomas A, et al. Long-term effects of cyclophosphamide therapy in steroid-dependent or frequently relapsing idiopathic nephrotic syndrome[J]. Nephrol Dial Transplant, 2011, 26(1):178-184. |
| [4] | Beck L, Bomback AS, Choi MJ, et al. KDOQI US Commentary on the 2012 KDIGO clinical practice guideline for glomerulonephritis[J]. Am J Kidney Dis, 2013, 62(3):403-441. |
| [5] | Moudgil A, Bagga A, Jordan SC. Mycophenolate mofetil therapy in frequently relapsing steroid-dependent and steroid——resistant nephrotic syndrome of childhood:current status and future directions[J]. Pediatr Nephrol, 2005, 20(10):1376-1381. |
| [6] | Gellermann J, Weber L, Pape L, et al. Mycophenolate mofetil versus cyclosporin A in children with frequently relapsing nephrotic syndrome[J]. J Am Soc Nephrol, 2013, 24(10):1689-1697. |
| [7] | 朱洪涛. 儿童激素耐药型肾病诊疗新进展[J]. 临床儿科杂志, 2014, 32(3):289-291. |
| [8] | 中华医学会儿科学分会肾脏病学组. 小儿肾小球疾病的临床分类、诊断及治疗[J]. 中华儿科杂志, 2001, 39(12):746-749. |
| [9] | 中华医学会儿科学分会肾脏病学组. 儿童常见肾脏疾病诊治循证指南(一):激素敏感、复发/依赖肾病综合征诊治循证指南(试行)[J]. 中华儿科杂志, 2009, 47(3):167-170. |
| [10] | Al Salloum AA, Muthanna A, Bassrawi R, et al. Long-term outcome of the difficult nephrotic syndrome in children[J]. Saudi J Kidney Dis Transpl, 2012, 23(5):965-972. |
| [11] | 罗丹, 姜红. 儿童激素耐药型肾病综合征的治疗进展[J]. 实用药物与临床, 2013, 16(8):731-733. |
| [12] | Meyrier A, Simon P, Perret G, et al. Remission of idiopathic nephrotic syndrome after treatment with cyclosporin[J]. Br Med J(Clin Res Ed), 1986, 292(6523):789-792. |
| [13] | Eiske M, Elena N, Albert J, et al. Mycophenolate mofetil versus cyclosporine for remission maintenance in nephrotic syndrome[J]. Pediatr Nephrol, 2008, 23(11):2013-2020. |
| [14] | Segarra Medrano A, Vila Presas J, Pou Clavé L, et al. Efficacy and safety of combined cyclosporin A and mycophenolate mofetil therapy in patients with cyclosporin-resistant focal segmental glomerulosclerosis[J]. Nefrologia, 2011, 31(3):286-291. |
| [15] | Gulati S, Saha A. Factors predietive of remission in steroid resistant nephrotic syndrome in children:a multivariate analysis[J]. Indian Pediatr, 2007, 44(5):395-396. |
| [16] | Ehrich JHH, Geerlings C, Zivicnjak M, et al. Steroidresistant idiopathic childhood nephrosis:overdiagnosed and undertreated[J]. Nephrol Dial Transplant,2007, 22(8):2183-2193. |
| [17] | Echeverri CV, Valencia GA, Higuita LM, et al. Immunosupressive therapy in children with steroid-resistant nephrotic syndrome:single center experience[J]. J Bras Nefrol, 2013, 35(3):200-205. |
| [18] | 李志辉, 夏团红, 段翠蓉, 等. 肾小球系膜区微量IgM沉积在儿童微小病变型肾病综合征中的意义[J]. 中国当代儿科杂志, 2015, 17(3):222-226. |
 2016, Vol. 18
2016, Vol. 18