自身免疫性多内分泌腺病综合征Ⅰ型(autoimmune polyendocrinopathy syndrome type Ⅰ,APSⅠ)是由自身免疫调节因子(autoimmune regulator,AIRE)基因突变引起T淋巴细胞耐受缺损的单基因遗传病,导致多个内分泌腺以及非内分泌器官功能受损,主要表现为自身免疫性甲状旁腺功能减退、原发性肾上腺皮质功能减退和慢性皮肤黏膜念珠菌病,又称自身免疫性多发性内分泌病-念珠菌病-外胚层营养不良(autoimmune polyendocrinopathy-candidiasis-ectodesmal dystrophy,APECED)[1, 2]。迄今为止,人类基因突变数据库收录AIRE基因致病突变有117种,包括错义突变、沉默突变、插入和缺失、无义突变以及剪接位点突变。不同民族和地区引起APSⅠ的突变类型各不相同。目前国内关于AIRE基因突变报道甚少[3, 4]。2010年,刘彩虹等[3]首次报道中国汉族人APSⅠ患者AIRE基因具有A19T和R257X的复合杂合突变。本研究针对1例APSⅠ患者及其父母进行AIRE基因序列分析,并用生物学技术对其功能进行预测,以获得确切的基因学诊断。
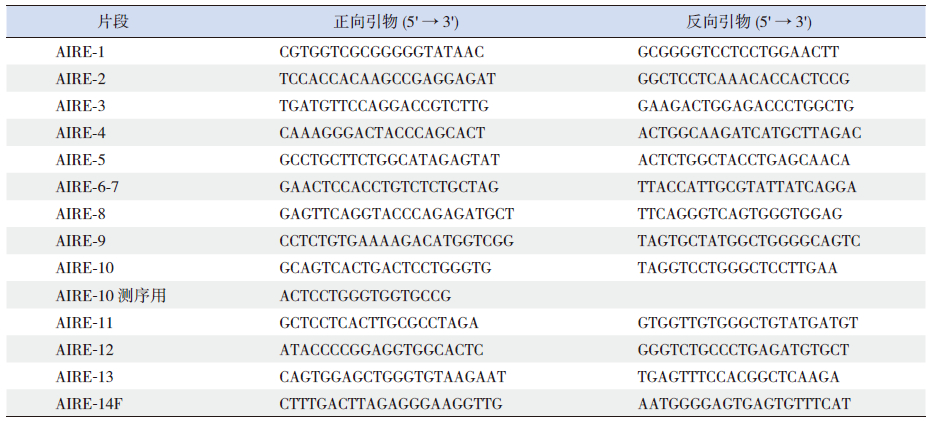
1 资料与方法 1.1 病例介绍先证者,女,15岁,因恶心、呕吐、腹泻2年半,口腔肿痛、间断发热2年,院外对症治疗效果欠佳,无手足抽搐,于1年前首次收住我院。体查:体型消瘦,营养不良,贫血貌;颊黏膜、舌体可见散在溃疡,深约5 mm,局部白膜覆盖;双手指甲菲薄。实验室检查:贫血,血红蛋白波动于69~76 g/L(参考值110~150 g/L);血钙低,血总钙波动于0.82~0.98 mmol/L(参考值2.0~ 2.7 mmol/L);血磷升高,波动于2.72~2.49 mmol/L (参考值0.81~1.90 mmol/L);甲状旁腺激素低,波动于2.30~4.94 ng/mL(参考值15~65 ng/mL);曲霉菌半乳甘露聚糖抗原检测(即GM试验)阳性;甲状腺功能、血清促肾上腺皮质激素、血清皮质醇、24 h尿游离皮质醇均正常。根据临床表现及检查结果诊断为APSⅠ。予肠内高营养、制霉菌素片、氟康唑注射液、阿法骨化醇软胶囊、碳酸钙D3片治疗,体温降至正常,口腔溃疡面愈合、白膜消失,血钙回升。7个月前,以反复口腔溃疡7 d再次收入院。体查:营养中等,舌体及口腔黏膜分布大小不等散在溃疡,较表浅。实验室检查:血红蛋白97 g/L(贫血);仍低钙高磷:血钙波动于1.19~1.36 mmol/L;血磷波动于2.81~3.42 mmol/L;甲状旁腺激素仍低(8.9 ng/mL)。予罗盖全、钙尔奇、叶酸、腺苷钴胺片、沙利度胺片治疗,血钙升高,口腔溃疡明显好转。院外规律用药。4个月前,以四肢抽搐1个月第3次入院,抽搐时伴短暂意识丧失、牙关紧闭、口吐白沫,持续10 min自行好转。复查实验室指标:血红蛋白88 g/L(贫血);仍低钙高磷:血钙波动于1.06~1.78 mmol/L,血磷波动于2.53~3.02 mmol/L;甲状旁腺激素仍低 (4.2 ng/mL);24 h尿钙升高(50.88 mmol/24 h);血清促肾上腺皮质激素,血清皮质醇、24 h尿游离皮质醇正常。沙利度胺可能会引起癫癎大发作,停用沙利度胺片后,随访3个月,抽搐未再发作,余治疗不变,血钙回升至1.78 mmol/L。既往史:无特殊。家族史:祖父患“冠心病”,祖母患“高血压、脑出血”,外祖父因“肝癌”去世,外祖母体健。父亲患“糖尿病”,母亲体健,非近亲婚配。1个弟弟体健。家族中无同类病史。家系图谱见图 1。遂对患者及其一级家属AIRE基因进行测序。
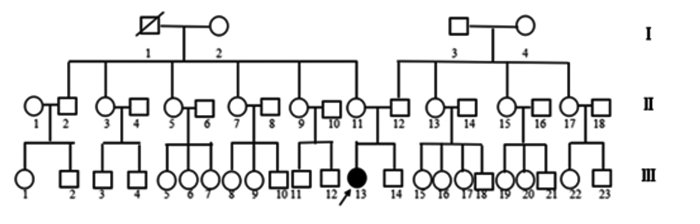 |
图 1 APS Ⅰ患者家系图谱
□示健康男性;○示健康女性; 示死亡男性;●示APSI 女性患儿;黑色箭头示先证者。 示死亡男性;●示APSI 女性患儿;黑色箭头示先证者。
|
签署知情同意书后,采集患儿、患儿父母及50名无血缘关系的正常对照人群外周血标本3 mL,酚-氯仿法提取基因组DNA。所有引物委托上海生物工程股份有限公司设计合成,引物序列见表 1。
| 表 1 AIRE 基因PCR 扩增及测序引物 |
聚合酶链反应反应体系(50 μL):包括模板1 μL,正反向引物各1 μL,dNTP(10 mmol/L)1 μL,Taq Buffer 5 μL,MgCl2(25 mmol/L)5 μL,Taq酶(5 U/μL)0.5 μL,去离子水35.5 μL。PCR反应条件:95℃预变性3 min;94℃变性30 s;55~60℃退火35 s;72℃延伸40~50 s,进行35个循环;然后72℃修复延伸5~8 min,4℃保存。
1.4 DNA测序委托上海生物工程股份有限公司进行DNA双向测序,用3730测序列分析仪分析测序结果。使用DNAstar软件包中的 Seqman进行测序基因与正常AIRE基因的比对分析。突变的命名参考Genebank 中的cDNA序列NM_000383.3。
1.5 生物学信息分析使用Polyphen2(http://genetics.bwh.harvard.edu/pph2/)、SNPs3D(http://www.snps3d.org/)、SIFT(http://sift.jcvi.org/)软件对发现的突变位点进行功能预测。
2 结果 2.1 DNA测序结果先证者AIRE基因有一处杂合突变:第5外显子622位G→T,密码子由GGG→TGG,导致编码的208位甘氨酸被色氨酸代替(Gly→Trp,G208W),先证者父亲和母亲第5外显子测序均未发现此突变(图 2)。
 |
图 2 第5 外显子622 位测序峰图 黑色箭头示突变所在位点。 |
经检索人类基因突变数据库和最新文献,位于第5外显子的突变c.622G>T(p.G208W)为新突变。50名无血缘关系的正常对照人群中未发现同样突变,排除其单核苷酸多态性(single nucleotide polymorphism,SNP)。另外,在患者的AIRE基因上检测到已报道的5个SNP位点,即c.57T>C、c.588C>T、c.834C>G、c.1197T>C、c.1578T>C。其中c.834C>G为非同义SNP位点,导致编码的278位氨基酸丝氨酸被精氨酸替代(Ser→Arg,S278R),先证者父亲第7外显子测序结果与野生型相同,而母亲第7外显子834位存在这一纯合突变,但未发病,支持此突变为非致病性突变。
2.2 生物学信息分析应用Polyphen2、SNPs3D、SIFT对622位G→T突变进行功能预测。Polyphen2预测结果分数为1.00(分数越接近1.00,突变损害可能性越大;越接近于0,突变损害可能性越小),同源性分析发现此突变区域在多物种中具有高度保守性(图 3);SNPs3D预测结果为-2.11(正值:无害;负值:有害);SIFT预测分数结果为0.00(分数<0.05认为可能影响蛋白质功能),以上3个软件均认为此突变可影响AIRE蛋白功能。
 |
图 3 AIRE 蛋白c.622G>T(p.G208W)突变区域同源性分析 黑框区为突变所在位点。 |
患者在3年内先后出现了慢性皮肤黏膜念珠菌感染、自身免疫性甲状旁腺功能减退和指甲发育不良,临床符合APSⅠ诊断。DNA双向测序结果显示:患者存在c.622G>T(p.G208W)杂合突变,先证者父亲和母亲第5外显子测序均未发现此突变,且检索人类基因突变数据库及最新文献证实此突变为新突变。
APSⅠ是一种单基因常染色体隐性遗传病,由AIRE基因突变引起,该疾病在某些地区人群多发,例如芬兰人、撒丁岛人、犹太人[5],但是在中国这种疾病稀少。患者常在儿童或者青少年时期发病[6],临床表现多为自身免疫性甲状旁腺功能减退、原发性肾上腺皮质功能减低和慢性皮肤黏膜念珠菌感染,称为APSⅠ“三联征”,其中慢性念珠菌感染常见和最早出现。尽管APSⅠ是一种单基因遗传病,但是其临床表现复杂多样,尚可合并其他自身免疫性炎症导致的多内分泌腺功能减退和非内分泌腺体的自身免疫疾病如原发性自身免疫性性腺功能减退、自身免疫性甲状旁腺功能减退、自身免疫性1型糖尿病、慢性萎缩性胃炎、自身免疫性肝炎等[7, 8]。此外,临床表现还包括外胚层发育不良导致的脱发和白癜风等。当至少存在“三联征”中2种临床表现时即可诊断APSⅠ,若有相应的家族史则具有1种病症也可诊断[6]。本例患者先后3年里出现顽固性口腔黏膜念珠菌感染、指甲发育不良等外胚层器官发育不良以及吸收不良综合征等表现,原发性甲状旁腺功能减退诊断无误,临床符合APSⅠ诊断。患者无低钙抽搐症状与患者长期低钙,机体已适应有关。随后的抽搐与沙利度安的应用有关而非甲状旁腺功能减退所致。APSⅠ患者的治疗包括激素补充治疗和抗真菌治疗,病人应该长期随访观察其是否有其他病变的出现,为了明确诊断应对其AIRE基因行测序分析或者检测相应的自身免疫性抗体。在本例患儿的诊疗中,对患者行抗真菌治疗以及补充相应的激素,患者营养良好、口腔溃疡愈合、血钙回升。对患者AIRE基因进行DNA双向测序分析,发现患者具有c.622G>T(p.G208W)杂合突变。
Nagamine等[9]和芬兰-德国[10]两个研究小组在1997年分离出APECED基因,命名为AIRE基因,该基因编码AIRE蛋白在许多组织中表达,但主要在胸腺髓质上皮细胞和单核树突状细胞这两种抗原呈递细胞上表达,该基因功能区结构改变会影响其亚细胞定位和蛋白的转录活性,干扰自身反应性T细胞(阴性选择)和/或通过产生免疫调节性T细胞影响自身耐受的维持[11]。AIRE蛋白包含1个保守的核定位信号、2个植物同源结构域锌指结构、4个LXXLL基序、DNA结合功能区SAND(Sp100、AIRE-1、NucP41/75、DEAF-1)、同源染色功能区。其中,SAND区含有DNA结合活性,是来自sp100的异构体,参与核区室化作用,分析显示在这个能够结合DNA的功能区有唯一的一个蛋白折叠[12],该区的缺失和点突变会导致胞质多肽的聚集反应,干扰正常的核定位[13]。SAND是AIRE基因的热点突变区之一,经典的芬兰突变R257X即位于此结构域。另外Meloni等[14]报道第6外显子755位P252L突变,导致与脯氨酸富集区相关的基因二级螺旋结构破坏,这一突变同时也位于SAND区。Cetani等[15]报道,在SAND区上的G228W突变以显性方式遗传。以上研究说明,发生在SAND区的突变会对AIRE蛋白功能产生不可忽略的影响。且本例G208W突变同G228W突变[15]一样发生在SAND区,且均由甘氨酸突变为色氨酸,一方面芳香族侧链的引入可能改变了蛋白分子的极性,另一方面由最小最灵活的氨基酸突变为庞大的氨基酸可能改变了蛋白分子的构象。那么c.622G>T(p.G208W)突变有可能与G228W突变类似,以显性方式遗传,导致本病的发生。同时,本研究采用Polyphen2、SNPs3D、SIFT软件对c.622G>T(p.G208W)突变进行预测分析,发现此突变极可能影响AIRE蛋白功能。相关文献及功能预测提示在本例APS-Ⅰ患者中位于第5外显子的c.622G>T(p.G208W)突变极可能是其致病的分子因素。由于本实验只进行了外显子Sanger测序,因此不排除可能存在的无法识别的大片段插入和缺失突变参与本病的发生,因此c.622G>T(p.G208W)突变致病性的确定尚需进一步的实验、随访和循证医学证据。
另外,遗传素质会与环境相互作用,导致自身耐受的破坏和自身免疫[16],可能使具有同一基因突变的APS-Ⅰ患者具有不同的表型。因此,APS-Ⅰ临床表现复杂多样,一些表现随年龄增长逐渐出现。进行基因筛查以及定期随访,可望使患者得到早期治疗的机会。
| [1] | Perheentupa J. Autoimmune polyendocrinopathy-candidiasisectodermal dystrophy[J]. J Clin Endocrinol Metab, 2006, 91(8):2843-2850. |
| [2] | Nagamine K, Peterson P, Scott HS et al. Positional cloning of the APECED gene[J]. Nat Genet, 1997, 17(4):393-398. |
| [3] | 刘彩虹, 石岩, 阴怀清, 等. 中国人自身免疫多内分泌腺病综合征1型AIRE基因突变[J]. 中华医学遗传学杂志, 2010, 27(1):18-22. |
| [4] | Zhang J, Liu H, Liu Z, et al. A functional alternative splicing mutation in AIRE gene causes autoimmune polyendocrine syndrome type 1[J]. PLoS One, 2013, 8(1):e53981. |
| [5] | Björses P, Aaltonen J, Vikman A, et al. Genetic homogeneity of autoimmune polyglandular disease type I[J]. Am J Hum Genet, 1996, 59(4):879-886. |
| [6] | Buzi F, Badolato R, Mazza C, et al. Autoimmune polyendocrinopathy-candidiasis-ectodermal dystrophy syndrome:time to review diagnostic criteria?[J]. J Clin Endocrinol Metab, 2003, 88(7):3146-3148. |
| [7] | Michels AW, Eisenbarth GS. Autoimmune polyendocrine syndrome type 1(APS-1) as a model for understanding autoimmune polyendocrine syndrome type 2(APS-2)[J]. J Intern Med, 2009, 265(5):530-540. |
| [8] | Shikama N, Nusspaumer G, Holländer GA. Clearing the AIRE:on the pathophysiological basis of the autoimmune polyendocrinopathy syndrome type-1[J]. Endocrinol Metab Clin North Am, 2009, 38(2):273-288. |
| [9] | Nagamine K, Peterson P, Scott HS, et al. Positional cloning of the APECED gene[J]. Nat Genet, 1997, 17(4):393-398. |
| [10] | Finnish-German APECED Consortium. An autoimmune disease, APECED, caused by mutations in a novel gene featuring two PHD-type zinc-finger domains[J]. Nat Genet, 1997, 17(4):399-403. |
| [11] | Lopes N, Ferrier P, Irla M. Induction of central tolerance by the factor Aire:molecular and epigenetic regulation[J]. Med Sci(Paris), 2015, 31(8-9):742-747. |
| [12] | Bottomley MJ, Collard MW, Huggenvik JI, et al. The SAND domain structure defines a novel DNA-binfing fold in transcriptional regulation[J]. Nat Struct Biol, 2001, 8(7):626-633. |
| [13] | Ramsey C, Bukrinsky A, Peltonen L. Systematic mutagenesis of the functional domains of AIRE reveals their role in intracellular targeting[J]. Hum Mol Genet, 2002, 11(26):3299-3308. |
| [14] | Meloni A, Perniola R, FaàV, et al. Delineation of the molecular defects in the AIRE gene in autoimmune polyendoerinopathycandidiasis-ectodermal dystrophy patients from Southern Italy[J]. J Clin Endocrinol Metab, 2002, 87(2):841-846. |
| [15] | Cetani F, Barbesino G, Borsari S, et al. A novel mutation of the autoimmune regulator gene in an Italian kindred with autoimmune polyendocrinopathy-candidiasis-ectodermal dystrophy, acting in a dominant fashion and strongly cosegregating with hypothyroid autoimmune thyroiditis[J]. J Clin Endocrinol Metab, 2001, 86(10):4747-4752. |
| [16] | Temajo NO, Howard N. The mosaic of environment involvement in autoimmunity:the abrogation of viral latency by stress, a non-infectious environmental agent, is an intrinsic prerequisite prelude before viruses can rank as infectious environmental agents that trigger autoimmune diseases[J]. Autoimmun Rev, 2014, 13(6):635-640. |
 2016, Vol. 18
2016, Vol. 18