2. 东莞市厚街医院儿科, 广东 东莞 523945
脓毒症是机体对病原的免疫应答反应性疾病,其免疫学特征是宿主自身免疫损伤,进一步可发展为多器官功能障碍综合征(MODS)。心脏是脓毒症的靶器官之一,合并心功能障碍的脓毒症患者的病死率可高达70%[1, 2]。研究发现活性氧(reactive oxygen species,ROS)生成过多、能量产生和代谢受损等线粒体功能障碍的多个方面与脓毒症心肌功能障碍密切相关[3, 4],然而目前对其确切发病机制仍不十分清楚。陈志江等[5]研究发现脓毒症模型大鼠心肌组织解偶联蛋白2(uncoupling protein 2,UCP2)上调,UCP2在调控炎症反应、减轻氧化应激及维持线粒体功能方面具有重要作 用[6, 7],因此推测UCP2可能与脓毒症心肌损伤相关。目前国内外对于UCP2与脓毒症心肌线粒体损伤的关系的研究甚少,本研究拟观察脂多糖(LPS)诱导的脓毒症模型大鼠心肌线粒体损伤指标及心肌UCP2表达的变化,探讨脓毒症心肌线粒体损伤与UCP2表达的关系。
1 材料与方法 1.1 实验动物及分组SPF级Sprague-Dawley(SD)雄性大鼠40只(广东省动物实验中心提供),体重250~300 g,适应性喂养1周,实验前禁食6 h,自由饮水。将40只SD雄性大鼠通过随机数字表法分为5组:对照组、脓毒症6 h组(LPS-6 h组)、脓毒症12 h组(LPS-12 h组)、脓毒症24 h组(LPS-24 h组)和脓毒症48 h组(LPS-48 h组),每组8只。腹腔注射LPS 10 mg/kg建立脓毒症模型[8, 9];腹腔注射等体积9 g/L生理盐水建立对照组。
1.2 主要试剂与仪器主要试剂与仪器包括:LPS (E.coli,O111:B4,美国Sigma公司);兔抗大鼠UCP2抗体,兔抗大鼠β-actin抗体和辣根过氧化物酶标记的山羊抗兔IgG(美国Proteintech公司);活性氧(ROS)检测试剂盒(南京建成生物工程研究所);全蛋白提取试剂盒、BCA蛋白浓度测定试剂盒(江苏凯基生物技术股份有限公司);线粒体提取液(北京普利莱基因技术有限公司);ND1000酶标仪(美国NanoDrop公司);FACSAria流式细胞仪(美国BD公司)。
1.3 相关指标的检测对照组腹腔注射生理盐水后立即留取血标本和心肌组织标本。LPS各组于LPS注射后相应时间点留取标本。
(1)血清CK和CK-MB的检测:腹腔注射水合氯醛麻醉大鼠后,沿腹正中线切开腹腔,暴露腹主动脉,经腹主动脉留取血标本,血标本室温静置1~2 h,3 000 r/min离心10 min后取血清,全自动生化分析仪检测肌酸激酶(CK)和肌酸激酶同工酶(CK-MB)水平。
(2)心肌组织ROS水平的检测:取冻存的心肌组织样本,每1 mg组织加50 μL PBS冰上研磨、1 000×g 4℃离心10 min,取上清。具体操作按ROS检测试剂盒说明书进行,以平均荧光强度表示ROS水平。
(3)心肌组织线粒体膜电位(MMP)和线粒体肿胀度的检测:按文献[10]提取线粒体,将50 μg纯化的线粒体按说明书加入稀释的JC-1染色工作液中,室温放置10 min后用流式细胞仪检测。以红色荧光(PI-H)强度与绿色荧光(FITC-H)强度的比值计算线粒体膜电位,以前向角(FSC)和侧向角(SSC)平均荧光强度的比值计算肿胀度。
(4)心肌组织UCP2蛋白的检测:提取各组心肌组织样本总蛋白,采用蛋白质免疫印迹试验(Western blot)测定UCP2蛋白浓度。按每孔60 μg蛋白量加样,SDS-PAGE凝胶电泳分离,电转移至聚偏二氟乙烯(PVDF)膜上。用脱脂奶粉室温封闭2 h,TBST漂洗10 min,加入羊抗UCP2(1 : 1 000)、兔抗β-actin(1 : 2 000)孵育,4℃摇床过夜,接着用TBST洗3次,每次10 min,加入(1 : 5 000)辣根过氧化物酶标记的二抗室温孵育1.5 h,TBST洗3次,每次10 min后使用ECL发光剂荧光显色,扫描分析。用Image J软件计算UCP2/β-actin的灰度值比值代表UCP2表达量。
(5)心肌组织病理学检测:将各时间点的心肌组织样本切成1.0 mm3大小的组织块,用30 g/L戊二醛固定,缓冲液浸洗,再用10 g/L四氧化锇固定,逐级脱水,环氧树脂包埋后制作病理切片,透射电镜观察。
1.4 统计学分析数据用SPSS 20.0统计软件分析,结果以均 数±标准差(x±s)表示。多样本间均数比较采用单因素方差分析,并用SNK检验进行两两分析比较。两变量间的相关性分析采用Pearson相关分析法。P<0.05为差异有统计学意义。
2 结果 2.1 动物一般情况大鼠腹腔注射LPS 6 h后即出现精神萎靡、竖毛、腹泻、进食减少、饮水减少和活动减少,符合脓毒症大鼠模型的一般表现。
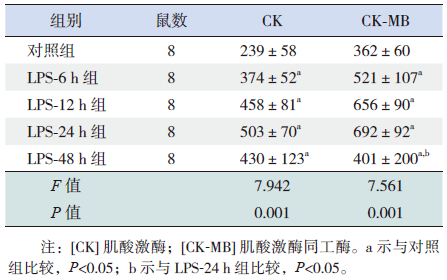
2.2 血清CK和CK-MB水平变化与对照组比较,LPS-6 h组、LPS-12 h组、LPS-24 h组和LPS-48 h组的血清CK、CK-MB水平均升高(P<0.05),峰值在LPS-24 h组。与LPS-24 h组比较,LPS-48 h组血清CK-MB水平降低(P<0.05),见表 1。
| 表 1各组大鼠血清CK 和CK-MB 水平 ( x±s,U/L) |
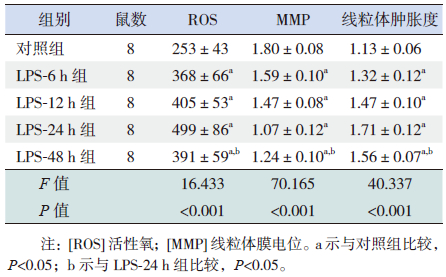
与对照组比较,LPS组大鼠心肌组织ROS水平从LPS注射后6 h开始升高,24 h升至最高(P<0.05)。与LPS-24 h组比较,LPS-48 h组ROS水平有所降低(P<0.05)。见表 2。
| 表 2 各组心肌组织线粒体ROS、MMP 和线粒体肿胀度 检测结果 ( x±s) |
与对照组比较,LPS组大鼠心肌组织线粒体肿胀度从LPS注射后6 h开始上升,24 h升至最高(P<0.05)。与LPS-24 h组比较,LPS-48 h组的线粒体肿胀度降低(P<0.05)。与对照组比较,LPS组大鼠心肌组织MMP从LPS注射后6 h开始下降,24 h降至最低(P<0.05)。与LPS-24 h组比较,LPS-48 h组大鼠心肌组织MMP增加(P<0.05)。见表 2。
2.5 心肌组织UCP2表达变化与对照组比较,LPS-6 h组、LPS-12 h组、LPS-24 h组和LPS-48 h组的UCP2表达均升高(P<0.05),峰值在LPS-24 h组。与LPS-24 h组比较,LPS-48 h组的UCP2表达降低(图 1)。
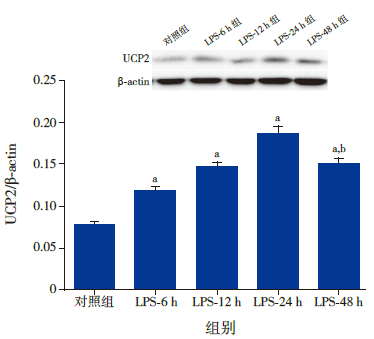 |
图 1 各组大鼠心肌UCP2 表达水平 注:上图为电 泳条带结果。下图为统计结果:a 示与对照组比较,P< 0.05;b 示 与LPS-24 h 组比较,P< 0.05。 |
电镜下观察对照组心肌线粒体形态正常,排列整齐,边界清楚,线粒体嵴致密。LPS-6 h组大鼠心肌线粒体形态大致正常,部分线粒体稍肿胀。LPS-12 h组心肌线粒体肿胀,线粒体嵴排列紊乱或疏松溶解,甚至消失。LPS-24 h组线粒体病变最严重,线粒体膜破碎,线粒体嵴断裂,有空泡形成。LPS-48 h组线粒体损伤较24 h组有所恢复。见图 2。
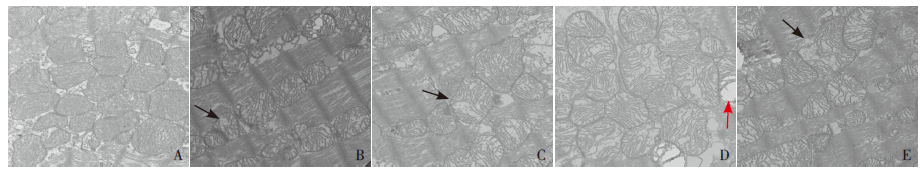 |
图 2 各组大鼠心肌线粒体超微结构变化(×30 000) A:对照组,大鼠心肌组织线粒体形态大致正常,边界清 楚,线粒体嵴致密。B、C、D、E 分别为LPS-6 h 组、LPS-12 h 组、LPS-24 h 组和LPS-48 h 组。LPS 组可见线粒体肿胀,线粒 体嵴疏松溶解,部分嵴断裂(黑色箭头所示),甚至空泡形成(红色箭头所示)。 |
脓毒症模型大鼠心肌线粒体ROS水平和线粒体肿胀度与UCP2表达量呈正相关(分别r=0.796、0.893,P<0.05);脓毒症模型大鼠心肌MMP与UCP2表达量呈负相关(r=-0.903,P<0.05)。见图 3~5。
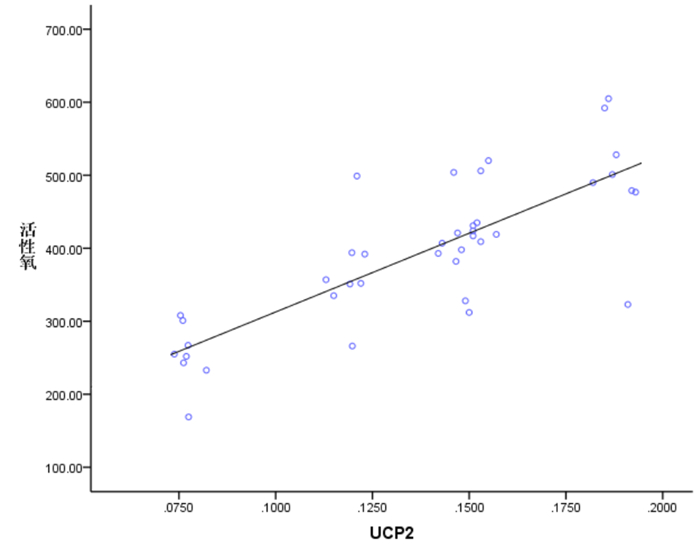 |
图 3 ROS 与UCP2 表达量的相关性 |
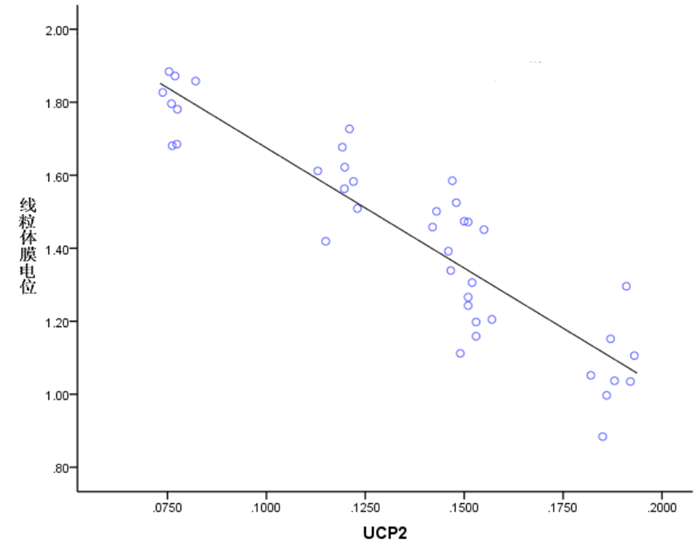 |
图 4 MMP 与UCP2 表达量的相关性 |
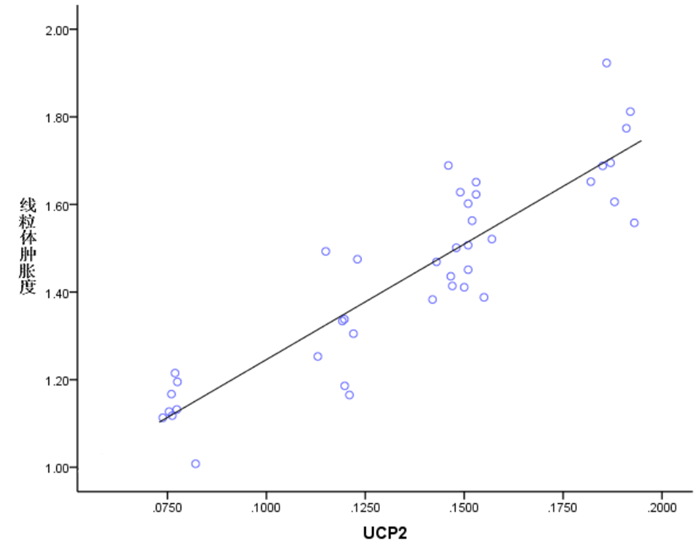 |
图 5 线粒体肿胀度与UCP2 表达量的相关性 |
脓毒症心肌功能障碍因其高病死率受到越来越多的关注,其发病机制已成为学界的研究热点。心脏是机体血液循坏的主要器官,心肌细胞内含有大量线粒体以满足心脏不间断做功的高耗能状态,线粒体也是ROS产生的主要部位,同时由于线粒体损伤程度与脓毒症预后相关[2, 3, 4],故本研究着重点在脓毒症模型心肌线粒体损伤方面。既往研究发现给大鼠腹腔注射LPS可诱导产生与脓毒症患者类似的血流动力学、血液学及代谢改变,而且模型较易复制,重复性好,因此LPS诱导脓毒症大鼠模型是一种比较理想的动物模型,在脓毒症实验研究中也较为常用[11, 12]。因此本研究采用大鼠腹腔注射LPS诱导脓毒症模型。
本研究通过腹腔注射LPS模拟脓毒症心肌损伤模型,结果发现LPS组大鼠血清心肌损伤指标CK和CK-MB都有不同程度的升高,提示脓毒症模型大鼠出现了心肌损伤。目前研究认为脓毒症心肌损伤与线粒体结构和功能损伤有关[13, 14]。脓毒症时心肌MPP下降,呼吸链复合体活性降低,同时线粒体通透性转换孔开放,进而使氧化磷酸化受损,ATP生成减少,最终导致线粒体结构损伤和功能障碍[15]。本研究电镜结果观察到LPS组大鼠心肌线粒体大小不一,排列不整齐,可见线粒体有不同程度的肿胀、嵴断裂消失和空泡样改变等,提示脓毒症时存在心肌线粒体结构损伤,其中以造模后24 h线粒体损伤最为严重。本研究还检测了心肌MPP和线粒体肿胀度,发现LPS各组大鼠心肌MPP均有不同程度的降低,而线粒体肿胀度均有升高,二者变化过程相反,但均以造模后24 h组最为明显,提示脓毒症心肌损伤伴有线粒体功能损伤。心肌线粒体电镜检查、MPP和线粒体肿胀度三者的结果,证实了脓毒症模型大鼠心肌损伤时出现心肌线粒体结构和功能损伤,LPS注射后24 h是病变的一个折点,恢复需要一个过程,这与脓毒症动物模型线粒体损伤的相关研究有类似发现[15]。
有研究发现,在一些内毒素诱导脓毒症心肌损伤的动物模型中发现UCP2基因和蛋白表达均有明显上升,表明UCP2与脓毒症心肌损伤具有相关性[16, 17]。因此,本研究通过Western blot检测UCP2的表达,发现LPS组大鼠心肌组织UCP2表达较对照组明显升高,且以LPS-24 h组表达最高,这与既往研究结果一致[5, 16, 17]。UCP2在生理或病理状态下可以调节线粒体ROS的产生和能量传导,许多研究也表明UCP2可抑制ROS产生,改变脂肪酸代谢,从而保护线粒体功能。研究发现心肌线粒体损伤与ROS有关[18, 19, 20],过多的ROS可以直接攻击线粒体,破坏线粒体膜的完整性,并且还可通过“钙超载”使线粒体发生严重的结构损伤[21]。因此,本研究还检测了实验大鼠心肌线粒体ROS的含量,发现脓毒症模型大鼠心肌线粒体ROS水平从造模后6 h开始增加,24 h时达到最高,随后出现下降,提示心肌线粒体氧化应激反应增强,ROS生成增加,且ROS变化趋势与心肌损伤指标CK和CK-MB是一致的,与心肌UCP2表达也是一致的。
UCP2是线粒体膜上阴离子载体蛋白家族的质子转运蛋白。UCP2蛋白广泛分布于人类的各组织器官中,包括心脏、肝脏、脑、胰腺和脂肪组织等。目前对于UCP2在糖尿病、脑病和心脏病等疾病模型中研究较多。在UCP2基因敲除小鼠中,升高的MMP可通过增加ROS产生引起血管重塑[22]。在体内研究发现人类UCP2过表达与解偶联作用增强和减少ROS产生相关[23, 24],以及许多体内体外实验都表明UCP2可以通过调控线粒体ATP、MMP和ROS水平等发挥细胞保护作用[25],这些都表明UCP2与线粒体功能密切相关。为了验证脓毒症模型心肌UCP2与线粒体功能之间的关系,本研究对UCP2表达与线粒体相关指标进行了相关性分析,发现UCP2表达与ROS、线粒体肿胀度呈正相关,而与MMP则呈负相关,说明脓毒症模型心肌损伤时UCP2表达与线粒体损伤密切相关。目前对于脓毒症模型心肌UCP2表达升高具体机制还未完全研究清楚,同时也不能排除UCP2表达是应激状态下的一种代偿性升高。最近,Zheng等[25]等通过转染技术沉默脓毒症状态下的H9c2心肌细胞UCP2基因的表达,发现沉默后的心肌细胞线粒体ROS生成更多,线粒体结构和功能损伤更重,提示在脓毒症细胞模型心肌细胞损伤时UCP2可能通过降低ROS的产生、稳定膜电位而发挥保护作用。因此推测,UCP2可能通过调节ROS的生成和稳定MMP而在脓毒症心肌线粒体损伤中发挥重要作用。但是本研究不足之处在于,未能验证UCP2在脓毒症模型心肌线粒体损伤中的具体作用机制,下一步需要使用转基因或基因敲除动物模型进行验证。
总之,脓毒症模型大鼠心肌损伤时心肌线粒体结构和功能均受损,而UCP2的表达与其心肌线粒体损伤密切相关,推测UCP2可能通过调节ROS的生成和稳定MMP而在脓毒症所致心肌线粒体损伤中发挥重要作用。
| [1] | Cimolai MC, Alvarez S, Bode C, et al. Mitochondrial mechanisms in septic cardiomyopathy[J]. Int J Mol Sci, 2015, 16(8):17763-17778. |
| [2] | Yao X, Carlson D, Sun Y, et al. Mitochondrial ROS induces cardiac inflammation via a pathway through mtDNA damage in a pneumonia-related sepsis model[J]. PLoS One, 2015, 10(10):e139416. |
| [3] | Lee I, Huttemann M. Energy crisis:the role of oxidative phosphorylation in acute inflammation and sepsis[J]. Biochim Biophys Acta, 2014, 1842(9):1579-1586. |
| [4] | Zang QS, Sadek H, Maass DL, et al. Specific inhibition of mitochondrial oxidative stress suppresses inflammation and improves cardiac function in a rat pneumonia-related sepsis model[J]. Am J Physiol Heart Circ Physiol, 2012, 302(9):H1847-H1859. |
| [5] | 陈志江, 王惠丽, 王阳, 等. 解耦连蛋白2在脓毒症大鼠心肌组织中的动态表达变化[J]. 发育医学电子杂志, 2014, 2(2):99-103. |
| [6] | Cao T, Dong Y, Tang R, et al. Mitochondrial uncoupling protein 2 protects splenocytes from oxidative stress-induced apoptosis during pathogen activation[J]. Cell Immunol, 2013, 286(1-2):39-44. |
| [7] | Yang CS, Yuk JM, Kim JJ, et al. Small heterodimer partnertargeting therapy inhibits systemic inflammatory responses through mitochondrial uncoupling protein 2[J]. PLoS One, 2013, 8(5):e63435. |
| [8] | Semmler A, Frisch C, Debeir T, et al. Long-term cognitive impairment, neuronal loss and reduced cortical cholinergic innervation after recovery from sepsis in a rodent model[J]. Exp Neurol, 2007, 204(2):733-740. |
| [9] | Langheinrich AC, Ritman EL. Quantitative imaging of microvas cu lar permeab i l i t y in a r a t model o f lipopolysaccharide-induced sepsis:evaluation using cryostatic micro-computed tomography[J]. Invest Radiol, 2006, 41(8):645-650. |
| [10] | 谢美燕, 项丹, 吕娟娟, 等. 持续输注异丙肾上腺素对早期脓毒症大鼠心肌线粒体的保护作用及其机制[J]. 中华实用儿科临床杂志, 2015, 30(6):425-428. |
| [11] | Rittirsch D, Hoesel LM, Ward PA. The disconnect between animal models of sepsis and human sepsis[J]. J Leukoc Biol, 2007, 81(1):137-143. |
| [12] | 尹承芬, 姚咏明. 脓毒症动物模型的研究进展[J]. 中华实验外科杂志, 2013, 30(5):1092-1093. |
| [13] | Li L, Hu BC, Chen CQ, et al. Role of mitochondrial damage during cardiac apoptosis in septic rats[J]. Chin Med J(Engl), 2013, 126(10):1860-1866. |
| [14] | Duran-Bedolla J, Montes de Oca-Sansoval MA, Saldana-Navor V, et al. Sepsis, mitochondrial failure and multiple organ dysfunction[J]. Clin Invest Med, 2014, 37(2):E58-E69. |
| [15] | 吕娟娟, 陈志江, 项丹, 等. 脂多糖诱导脓毒症大鼠远期脑线粒体损伤的初步研究[J]. 中国当代儿科杂志, 2015(8):859-863. |
| [16] | Roshon MJ, Kline JA, Thornton LR, et al. Cardiac UCP2 expression and myocardial oxidative metabolism during acute septic shock in the rat[J]. Shock, 2003, 19(6):570-576. |
| [17] | Wang X, Liu D, Chai W, et al. The role of uncoupling protein 2 during myocardial dysfunction in a canine model of endotoxin shock[J]. Shock, 2015, 43(3):292-297. |
| [18] | 白静, 张文丽, 张军伟, 等. 脓毒症大鼠心肌氧化应激损伤及心肌细胞超微结构变化[J]. 细胞与分子免疫学杂志, 2015, 31(5):634-638. |
| [19] | Turdi S, Han X, Huff AF, et al. Cardiac-specific overexpression of catalase attenuates lipopolysaccharide-induced myocardial contractile dysfunction:role of autophagy[J]. Free Radic Biol Med, 2012, 53(6):1327-1338. |
| [20] | Hao E, Lang F, Chen Y, et al. Resveratrol alleviates endotoxininduced myocardial toxicity via the Nrf2 transcription factor[J]. PLoS One, 2013, 8(7):e69452. |
| [21] | Zang QS, Wolf SE, Minei JP. Sepsis-induced cardiac mitochondrial damage and potential therapeutic interventions in the elderly[J]. Aging Dis, 2014, 5(2):137-149. |
| [22] | Pak O, Sommer N, Hoeres T, et al. Mitochondrial hyperpolarization in pulmonary vascular remodeling, mitochondrial uncoupling protein deficiency as disease model[J]. Am J Respir Cell Mol Biol, 2013, 49(3):358-367. |
| [23] | Andrews ZB, Horvath B, Barnstable CJ, et al. Uncoupling protein-2 is critical for nigral dopamine cell survival in a mouse model of Parkinson's disease[J]. J Neurosci, 2005, 25(1):184-191. |
| [24] | Mattiasson G, Shamloo M, Gido G, et al. Uncoupling protein-2 prevents neuronal death and diminishes brain dysfunction after stroke and brain trauma[J]. Nat Med, 2003, 9(8):1062-1068. |
| [25] | Zheng G, Lyu J, Liu S, et al. Silencing of uncoupling protein 2 by small interfering RNA aggravates mitochondrial dysfunction in cardiomyocytes under septic conditions[J]. Int J Mol Med, 2015, 35(6):1525-1536. |
 2016, Vol. 18
2016, Vol. 18