2. 孝感市中心医院儿科, 湖北 孝感 432100
支气管哮喘(简称哮喘)是由多种炎症细胞及细胞组分参与的气道慢性炎症疾病,既往认为嗜酸性粒细胞(eosinophil,EOS)气道炎症是哮喘典型的改变,但随着研究深入,显示哮喘的气道炎症存在不同的亚型,可分为嗜酸细胞性哮喘(eosinophilic asthma,EA)和非嗜酸细胞性哮喘[1](non-eosinophilic asthma,NEA),其中半数以上的非嗜酸细胞性哮喘为中性粒细胞(neutrophilic asthma,NEU)性哮喘[2],其发病机制仍在探讨中[3, 4]。 T淋巴细胞是哮喘发病中发挥重要作用的免疫细胞,其中Th17 细胞是分泌IL-17的CD4+T细胞,不仅与多种自身免疫性疾病有关,还作为新的辅助性T细胞亚型参与NEU哮喘的发病,其分泌的主要细胞因子IL-17可募集多种炎症细胞和促进多种细胞因子分泌并参与气道中性粒细胞炎症及气道高反应的形成[5, 6, 7]。最近人们在一些自身免疫性疾病还发现了一群分泌IL-17的CD8+T细胞,即Tc17 细胞,主要分泌IL-17炎性细胞因子,在慢性炎症、自身免疫性疾病及肿瘤的发病机制中发挥免疫调节作用,例如,银屑病和系统性红斑狼疮、过敏性皮炎、多发性硬化等,并且与过敏性哮喘密切相关[8, 9],但目前这群细胞在NEU哮喘中作用不明。基于Tc17细胞及主要细胞因子IL-17的生物学功能,有理由推测Tc17细胞参与NEU哮喘的发病,本研究旨在初步探讨Tc17细胞在NEU哮喘小鼠中的作用,并为其防治提供新思路。
1 材料与方法 1.1 动物和分组32只健康清洁级C57/B6雌性6~8周龄小鼠(由湖南斯莱科景达实验动物有限公司提供),体重18~22 g。按随机数字表随机分为NEU哮喘组和正常对照组,每组各16只小鼠。
1.2 主要试剂及仪器脂多糖(lipopolysaccharides,LPS)、卵蛋白(ovalbumin,OVA)以及佛波酯(phorbol ester,PMA)、离子霉素(Ionomycin)均为美国Sigma公司产品;CD4-Percp-Cy5.5、CD8-APC、IL-17-PE、IgG1-PE单克隆 抗体,布雷菲德菌素A(Brefeldin A,BFA)购自美国BD公司。IL-17、IL-6、TFG-β ELISA试剂盒购自欣博盛公司。压缩型雾化吸入机为德国Batigo产品;流式细胞仪为美国 BD公司BD FACS Calibur流式细胞仪。光学显微镜为日本Olympus公司产品,病理图像分析仪为德国Leica公司产品,细胞甩片离心机为美国WESCOR产品。
1.3 哮喘动物模型制备哮喘小鼠模型参照文献建立[7, 10]。NEU哮喘组于第0,6,13天给予100 µg OVA加LPS 0.1 µg气道滴入致敏,于第21天起,连续7 天雾化吸入1% OVA激发,每次1 h。对照组用生理盐水致敏和激发。
1.4 BALF细胞计数及分类计数最后一次雾化24 h 后眼球放血处死小鼠,每组各取8只小鼠,分离气道,22G留置针气管插管并固定,用0.5 mL 0.01 M磷酸盐缓冲液(PBS)灌洗肺部两次(回收率≥80%合格),取100 µL BALF离心甩片,Diff-Quik染色行细胞分类计数;另取10 µL于血球计数板上计细胞总数;余下的BALF离心,-20℃留上清待测细胞因子。
1.5 肺组织病理切片并HE染色另每组各取8只未经肺泡灌洗的小鼠,取出小鼠左侧肺脏,用4%多聚甲醛固定24 h后,将肺组织梯度酒精脱水、石蜡包埋切片、常规HE染色。
1.6 流式细胞术检测肺脏Tc17、Th17细胞表达取出未经肺泡灌洗的小鼠右侧肺脏,将肺脏剪碎,经0.1%胶原酶Ⅳ消化45 min,置于 300 目不锈钢筛网上并用玻璃研磨棒以适当力度研磨,去除筋膜,75 µm滤网过滤,收集培养皿中单细胞悬液,用PBS重悬细胞,l 500 rpm/min离心5 min,弃上清,加3倍体积红细胞裂解液室温孵育5 min,PBS 洗 2 次离心去上清,再用含 10% 胎牛血清的1640培养基将细胞制成单细胞悬液,调至密度2×106/mL,每孔加入1 mL的细胞悬液至24孔板,按比例加入PMA 50 ng/mL、离子霉素1 µg/mL、BFA 1 µL,在37℃、5% CO2培养箱中共同孵育 5 h。收集孵育后的细胞离心去上清,混匀后分别加入Percp-cy5.5标记的抗小鼠CD4单克隆抗体、APC标记抗小鼠CD8单克隆抗体,轻轻混匀;4℃避光孵育30 min。冷PBS洗涤2次,弃上清,加入 1×Fix/Perm Buffer 1 mL,4℃避光孵育 50 min,1×Perm/Wash洗2次,混匀后加入PE标记的抗小鼠IL-17单克隆抗体或同型对照,轻轻混匀,避光孵育。1×Perm/Wash洗2次,弃上清,1%多聚甲醛0.5 mL重悬细胞,24 h内上机检测。BD FACS Calibur流式细胞仪检测,FLOWJOP 7.6.5软件分析结果。
1.7 ELISA法检测BALF中细胞因子IL-6、TGF-β、IL-17水平用 ELISA 双抗体夹心法检测小鼠BALF IL-17、IL-6、TGF-β水平,操作按照试剂盒的说明书进行,每个样本和标准品均设 2 个复孔。
1.8 统计学分析用SPSS 16.0软件进行统计分析。计量资料以均数±标准差(x±s)表示,组间比较采用t检验或秩和检验(Mann-Whitney U检验),相关性分析采用Spearman相关分析。P<0.05为差异有统计学意义。
2 结果 2.1 小鼠的哮喘症状表现NEU哮喘组小鼠在激发过程中均出现不同程度的烦躁不安、呼吸急促、弓背直立、前肢缩抬、大小便失禁等表现。
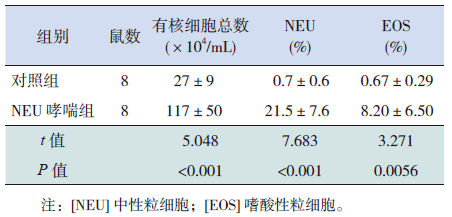
2.2 两组小鼠BALF有核细胞总数和分类比较NEU哮喘组小鼠 BALF有核细胞总数、中性粒细胞百分比(NEU%)、嗜酸性粒细胞百分比(EOS%)均明显高于对照组,差异有统计学意义(均 P<0.01)。见表 1。
| 表 1 两组小鼠BALF 细胞总数和分类比较 ( x±s) |
NEU哮喘组肺组织结构紊乱,肺泡间隔增宽和肺泡壁断裂,气道周围及肺间质炎症细胞浸润,以中性粒细胞浸润为主,可见血管扩张、充血。对照组小鼠支气管管腔及肺泡结构完整,无明显炎症细胞浸润,气道上皮细胞排列整齐。见图 1。
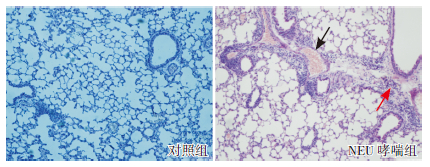 |
图 1 肺组织病理变化(HE 染色,×100) 与对照组 相比,NEU 哮喘组肺组织结构紊乱,气道周围及肺间质炎症细胞 浸润明显(红色箭头所示),以中性粒细胞浸润为主,并可见血 管扩张、充血(黑色箭头所示)。 |
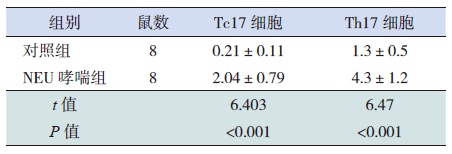
NEU哮喘组小鼠肺脏Tc17细胞百分比、Th17细胞百分比均较对照组增加,差异有统计学意义(P<0.05)。见表 2、图 2。
| 表 2 两组小鼠肺脏Tc17、Th17 细胞百分比比较 ( x±s,%) |
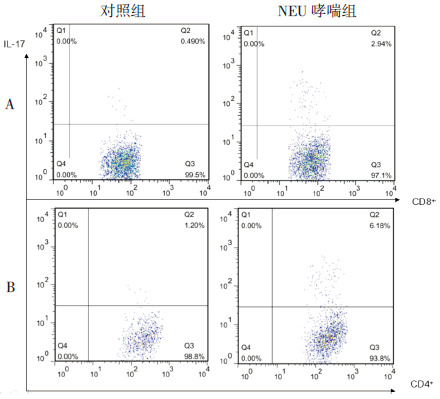 |
图 2流式检测小鼠肺脏Tc17 和Th17 细胞的比例 A 图示Tc17 细胞,B 图示Th17 细胞。 |
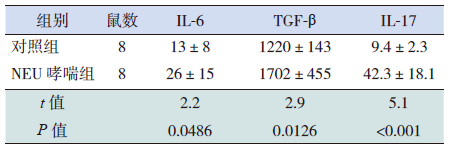
NEU哮喘组小鼠BALF中IL-6、TGF-β、IL-17浓度均明显高于对照组,差异有统计学意义(P<0.05)。见表 3。
| 表 3 两组小鼠BALF 中IL-6、TGF-β、IL-l7 水平比较 (pg/mL, x±s) |
NEU哮喘组小鼠肺脏Tc17细胞比例与Th17细胞比例呈正相关(r=0.7932,P<0.05)。见图 3。
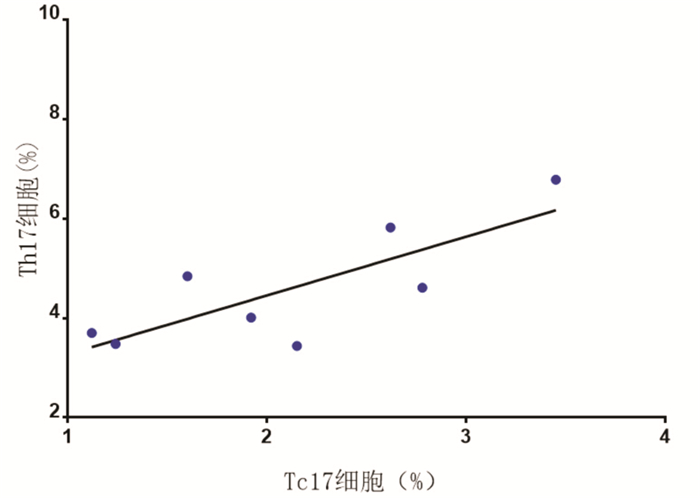 |
图 3 NEU 哮喘组小鼠肺脏Tc17 细胞比例与Th17 细 胞比例相关性 |
中性粒细胞性气道炎症与重症哮喘、激素抵抗型哮喘等密切相关[11]。目前,哮喘气道中性粒细胞增多的机制尚未完全阐明。随着研究发现,哮喘发病的经典免疫学机制Th1/Th2失衡学说不能完全解释NEU哮喘全部的临床及病理生理改变。有研究证实,在非特异性哮喘患者气道内的中性粒细胞聚集并不依赖于Th2细胞的免疫学机制,并且对部分患者应用针对 Th2 细胞靶向治疗并没有取得预期的效果[12]。近年来的研究发现,Tc17细胞主要分泌细胞因子IL-17,参与慢性炎症、自身免疫病及肿瘤等疾病的发病,与过敏性哮喘密切相关。IL-17具有强大的促炎和趋化免疫细胞的作用,IL-17与其受体结合诱导血管内皮细胞、成纤维细胞、上皮样细胞释放 IL-8、IL-6等炎症因子、趋化因子、粘附分子(ICAM1)及基质金属蛋白酶,趋化并激活中性粒细胞在气道局部浸润及破坏[13]。另有研究表明,使用抗IL-17中和抗体可以减轻哮喘小鼠的气道炎症和气道高反应,IL-17能够促进多种细胞因子分泌并参与哮喘气道中性粒细胞炎症和气道高反应的形成[7]。那么,在NEU哮喘发病中是否存在类似的机制?本研究发现NEU哮喘组肺脏Tc17细胞及BALF中的IL-17水平均高于对照组,显示Tc17细胞不仅数量增多而且功能增强,提示Tc17细胞参与了NEU哮喘发病,IL-17也很可能是Tc17细胞发挥作用的方式之一。那么,导致Tc17细胞在NEU哮喘小鼠表达增多的原因是什么?有研究表明,IL-6 和TGF-β是 Tc17 细胞初始分化的关键细胞因子[14],RORγt是 调控Tc17 细胞分化的特异性转录因子,IL-6 和TGF-β 能够协同作用促进 RORγt 的表达[8],诱导初始CD8+T 细胞向 Tc17细胞分化。本研究发现NEU哮喘小鼠BALF中的IL-6 和TGF-β浓度均高于对照组小鼠,增高的IL-6、TGF-β形成了有利于Tc17细胞优势分化的体内微环境,提示可能在IL-6和TGF-β的共同作用下,NEU哮喘小鼠初始CD8+T 细胞向 Tc17细胞分化增强,导致Tc17细胞表达增多。
近年来有较多的证据表明Th17细胞参与调控哮喘的发病[7, 15]。我们前期研究也发现NEU哮喘小鼠存在强烈的Th17细胞免疫反应,Th17细胞参与了NEU哮喘发病[16]。Tc17细胞分化和发展过程与Th17细胞具有很多相似的特征,越来越多的研究表明Th17细胞和Tc17细胞,在一些免疫性疾病发挥了合作作用。在自身免疫性脑脊髓膜炎的动物模型研究中,Huber等[17]指出Tc17细胞能够通过直接的细胞接触促进Th17细胞分化,并且Tc17细胞能够增强Th17细胞的致病力,Tc17细胞在炎症的初始阶段起着更重要的作用。Li等[9] 的研究也表明,在哮喘患者外周血以及哮喘小鼠肺脏和脾脏中高表达Tc17和Th17细胞,推测Tc17和Th17细胞能协同促进疾病的发生。同样,本研究发现,NEU哮喘小鼠肺脏的Tc17与Th17细胞均增加,并成正相关,有理由推测Th17细胞和Tc17细胞可能发挥合作或协同的功能,共同调控中性粒细胞性哮喘的发病。
总之,在本研究中,NEU哮喘组肺脏Tc17细胞表达增高,Tc17细胞可能参与了NEU哮喘的发病,增高的IL-6、TGF-β形成了有利于NEU哮喘小鼠Tc17细胞优势的体内微环境,Tc17细胞和Th17细胞可能发挥合作或协同的功能,IL-17也很可能是Tc17细胞在NEU哮喘中发挥作用的方式之一。本研究初步探讨了Tcl7细胞对中性粒细胞性气道炎症的作用及可能的免疫学机制,由于Tcl7细胞的复杂免疫学特性,若要全面阐明 Tc17 细胞在中性粒细胞性气道炎症的功能及机制,仍需进行更多的研究。
| [1] | McGrath KW, Icitovic N, Boushey HA,et al. Asthma Clinical Research Network of the National Heart L, Blood I:A large subgroup of mild-to-moderate asthma is persistently noneosinophilic[J]. Am J Respir Crit Care Med, 2012, 185(6):612-619. |
| [2] | 张硫娴, 农光民, 廖竞, 等. 诱导痰液细胞学分析对儿童支气管哮喘临床分型中的应用[J]. 实用儿科临床杂志, 2010, 25(2):129-132. |
| [3] | 廖竞, 农光民, 蒋敏, 等. 儿童重症哮喘气道中性粒细胞凋亡的研究[J]. 中华儿科杂志, 2009, 47(8):628-631. |
| [4] | Uddin M, Nong G, Ward JS, et al. Prosurvival activity for airway neutrophils in severe asthma[J]. Thorax, 2010, 65(8):684-689. |
| [5] | Newcomb DC, Peebles RS Jr. Th17-mediated inflammation in asthma[J]. Curr Opin Immunol, 2013, 25(6):755-760. |
| [6] | Ano S, Morishima Y, Ishii Y, et al. Transcription factors GATA-3 and RORgammat are important for determining the phenotype of allergic airway inflammation in a murine model of asthma[J]. J Immunol, 2013, 190(3):1056-1065. |
| [7] | Wilson RH, Whitehead GS, Nakano H, et al. Allergic sensitization through the airway primes Th17-dependent neutrophilia and airway hyperresponsiveness[J]. Am J Respir Crit Care Med, 2009, 180(8):720-730. |
| [8] | Ortega C, Fernandez AS, Carrillo JM, et al. IL-17-producing CD8+ T lymphocytes from psoriasis skin plaques are cytotoxic effector cells that secrete Th17-related cytokines[J]. J Leukoc Biol, 2009, 86(2):435-443. |
| [9] | Li K, Wang Z, Cao Y, et al. The study of the ratio and distribution of Th17 cells and Tc17 cells in asthmatic patients and the mouse model[J]. Asian Pac J Allergy Immunol, 2013, 31(2):125-131. |
| [10] | 刘晓微, 蒋敏, 农光民, 等. 中性粒细胞性支气管哮喘小鼠模型的建立及其气道高反应规律的研究[J]. 中华哮喘杂志(电子版), 2013, 7(3):1-5. |
| [11] | Jatakanon A, Uasuf C, Maziak W, et al. Neutrophilic inflammation in severe persistent asthma[J]. Am J Respir Crit Care Med, 1999, 160(5 Pt 1):1532-1539. |
| [12] | Anderson GP. Endotyping asthma:new insights into key pathogenic mechanisms in a complex, heterogeneous disease[J]. Lancet, 2008, 372(9643):1107-1119. |
| [13] | Henness S, van Thoor E, Ge Q, et al. IL-17A acts via p38 MAPK to increase stability of TNF-alpha-induced IL-8 mRNA in human ASM[J]. Am J Physiol Lung Cell Mol Physiol, 2006, 290(6):L1283-1290. |
| [14] | Tajima M, Wakita D, Noguchi D, et al. IL-6-dependent spontaneous proliferation is required for the induction of colitogenic IL-17-producing CD8+ T cells[J]. J Exp Med, 2008, 205(5):1019-1027. |
| [15] | 娄春艳, 李敏, 李丽. 哮喘小鼠气道重塑过程中CD4+CD25+调节性T细胞和Th17细胞表达的动态变化[J]. 中国当代儿科杂志, 2015, 17(9):994-1000. |
| [16] | 蒋敏. TH17细胞及其功能在中性粒细胞哮喘发病中的作用及相关分子机制[D]. 南宁:广西医科大学, 2013. |
| [17] | Huber M, Heink S, Pagenstecher A, et al. IL-17A secretion by CD8+ T cells supports Th17-mediated autoimmune encephalomyelitis[J]. J Clin Invest, 2013, 123(1):247-260. |
 2016, Vol. 18
2016, Vol. 18