自首次在动物鼠中发现脂溶性因子维生素A(vitamin A,VA),已经有100多年的历史了[1]。VA是一种脂溶性维生素,它是上皮细胞的正常生长和发育所必需的营养物质,对视网膜、呼吸系统、消化系统等的正常生长和发育具有非常重要的作用。VA具有多重生理功能,包括维持暗光下的视功能,保持细胞膜的稳定性,使皮肤和黏膜等上皮组织维持正常,促进细胞的增生、分化,骨骼代谢和机体的生长发育,维持和促进人体的免疫功能等。VA缺乏可造成夜盲症、干眼病、角膜软化、角膜溃疡、免疫功能低下,增加了感染的机会,易患呼吸系统疾病(上感、支气管炎、肺炎等)。在发展中国家,VA缺乏普遍存在,并且对婴儿发病率和病死率有显著的影响,而在发达国家,VA缺乏并不普遍,但在早产儿却是个例外。早产儿由于通过胎盘转运的VA有限,使其在出生时体内储存量较少,VA缺乏普遍存在[2],出生时低的VA水平可持续到矫正胎龄达到足月时[3],并且对新生儿期及长远的生长和健康产生影响[4]。近来关于VA对早产儿的发病率及病死率的影响越来越受到国内外的关注。
1 VA的代谢和吸收VA包括了许多脂溶性复合物,如视黄醇、视黄酯、视黄醛和视黄酸。VA是以前体的形式被吸收,动物源性食物(如肝脏、鸡蛋)包含视黄脂(大多为棕榈酸酯),而植物(如胡萝卜和绿叶蔬菜)包括了维生素原A类胡萝卜素。口服的VA能够在脂类或者水溶液中保存,尽管水溶液形式更加容易吸收,但是在脂类中稳定性更强,因此,通常用来常规补充的是脂溶性VA。在肠上皮细胞摄取前,食源性视黄酯在肠内先水解成视黄醇,然后在肠腔内同胆汁酸组成复合物。随后视黄醇依赖细胞视黄醇结合蛋白Ⅱ从肠上皮细胞转运到淋巴系统;在大多数早产儿中,视黄醇结合蛋白浓度偏低[5],使得这种转运能力下降,可能可以解释给早产儿口服补充VA的效果欠佳[6]。在以乳糜微粒的形式转移到肝脏之后,视黄醇或者以视黄酯的形式储存,或者被释放利用,在血浆中以视黄醇-视黄醇结合蛋白复合物的形式,同转甲状腺素蛋白以1 : 1结合运输。人体总储存的VA,50%~85%储存在肝脏,另外储存较多的部位是肺和视网膜。靶细胞中的视黄醇结合蛋白膜受体,调节细胞摄取视黄醇,视黄醇不可逆的氧化反应产生了视黄酸。视黄酸的同分异构体包括了全反式和顺式脂肪酸,能够激活两类核受体(视黄酸核受体和类视黄醇核受体),导致构象发生改变和调节多种靶基因[7],这可以解释VA具有系统多样性的功能。在视网膜,视黄醇可逆的氧化作用产生了第二种活性代谢产物-视黄醛,它是视紫红质的发色团,脊椎动物的光感受器分子。通过光诱导,使11-顺式视黄醛异构化为全反式视黄醛,从而引起光感受器分子激活,而开始视觉过程。见图 1。
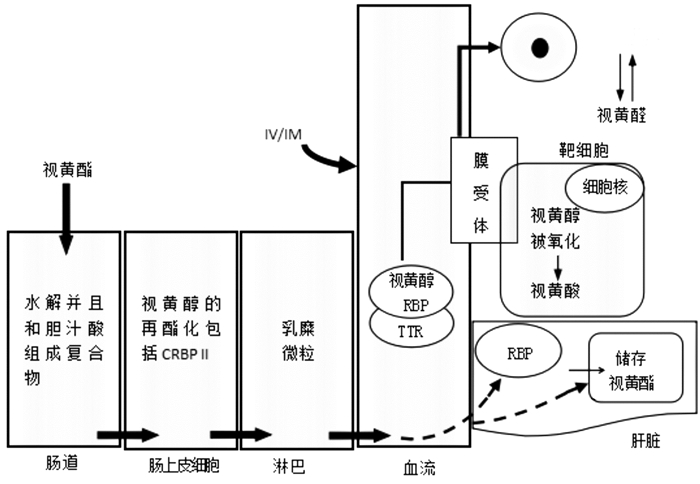 |
图 1 维生素A 的代谢和吸收 [CRBP Ⅱ ] 细胞视黄醇结合蛋白Ⅱ;[IV] 静脉注射;[IM] 肌肉注射;[RBP] 视黄醇 结合蛋白;[TTR] 转甲状腺素蛋白。 |
近来对关于VA水平与早产儿疾病的发生尤为关注,同时VA水平对新生儿病死率产生显著影响。Haider等[8]收录51 446名新生儿回顾分析,就婴儿早期病死率对于发展中国家<5 岁儿童病死率的重要性而言,VA在新生期的补充具有至关重要的作用。国外有研究表明大剂量补充VA能够降低极低、超低出生体重儿的病死率[9, 10]。
2.1 新生儿呼吸窘迫综合征肺表面活性物质(pulmonary surfactant,PS)是由II型肺泡上皮细胞合成并分泌的一种磷脂蛋白复合物。其中磷脂占了90%,蛋白占10%,磷脂中饱和磷脂占50%,不饱和磷脂占35%,蛋白中包括了SP-A、SP-B、SP-C、SP-D。VA能促进肺泡Ⅱ型上皮细胞功能成熟,孕期VA 缺乏,使PS生成减少,其中磷脂和蛋白质含量显著下降[11],而给予VA 处理后能够促进PS的生成。VA可以通过增加血管内皮细胞生长因子以及一氧化氮的生成从而促进肺的血管化,视黄酸还可通过上调肺蛋白1、Connexin 43蛋白的表达来影响小鼠肺的肺泡化[12]。Esteban Pretel等[13]通过分析VA缺乏大鼠肺泡基底膜超微结构及其中的酶胶原含量提出VA缺乏会导致肺泡功能损害,同时发生肺疾患的可能性增加。国内的临床研究发现,伴有胎膜早破的孕妇在产前联合应用VA与盐酸氨溴索可以促进胎儿肺成熟,减少新生儿呼吸窘迫综合征的发生[14]。孟君等[15]的研究表明呼吸窘迫综合征患儿血清VA浓度较对照组低,两组差异有统计学意义。而VA缺乏的晚期早产儿(胎龄34~37周)更容易发生呼吸窘迫综合征[16]。
2.2 慢性肺部疾病VA对肺形成的4个阶段,包括晚期肺泡化是不可缺少的,VA缺乏导致肺发育不良,伴随着对氧的依赖延长[9]。Moreira等[17]给178例超低出生体重儿所做的研究,将其分为VA组和对照组,两组均给予早期经鼻持续气道正压通气,气管内滴入PS等常规处理,VA组于出生的前28 d肌肉注射12剂VA,结果表明VA组的中重度支气管肺发育不良的发生率较对照组下降了11%,从33%下降至22%。Kiatchoosakun等[18]对极低出生体重儿的研究亦表明,补充VA能够减少气管插管和氧疗的时间,并能缩短住院时间。然而Londhe等[19]给早产小于胎龄儿补充相同剂量的VA,同早产适于胎龄儿相比,并不能降低支气管肺发育不良及死亡的风险,尽管适于胎龄早产儿能够增加血中视黄醇及视黄醇结合蛋白的浓度。目前得出的合理结论是:早产儿在出生时肺部缺乏VA,而肺部在生后的前几个星期对VA的需求量相对较高,尤其是那些必定要发展成慢性肺部疾病的新生儿,而目前VA的补充方式及剂量并不能完全满足肺部对VA的需求。
2.3 坏死性小肠结肠炎VA是上皮细胞生长发育所必须的,同时对伤口的愈合起着非常重要的作用。VA缺乏易影响肠上皮屏障的完整性,降低肠道黏膜免疫能力,影响肠道正常菌群的平衡,使致病性抗原趁机而入。VA 在肠道中的抗感染作用,主要体现在其对肠道屏障功能和肠道黏膜免疫功能的调节[20]。Yang等[21] 通过检测VA缺乏的大鼠肠道黏膜细胞因子的变化,提示VA缺乏可同时降低肠道黏膜中的细胞免疫和体液免疫。Ozdemir等[22]的研究表明,应用全反式视黄酸通过其抗炎及抗氧化作用对坏死性小肠结肠炎鼠模型的肠道损伤具有保护作用。目前VA同坏死性小肠结肠炎的研究仅限于动物模型,有待更深入的临床研究。
2.4 早产儿视网膜病在视觉周期中,需要有足够的视紫红质来行使正常的功能,而早产儿含有的视紫红质数量有限,可能更容易受到低氧或高氧或者其他任何有害因素的不良影响。Darlow等[10]的研究亦表明,给极低出生体重儿预防性应用VA,能够降低早产儿视网膜病(ROP)的风险。在鼠的ROP模型中,视黄酸治疗组可能通过下调血管内皮生长因子表达,从而阻止氧气诱导的视网膜病的新生血管形成[23]。Mactier等[24]的一项对胎龄<32周或者出生体重<1 501 g的双盲随机对照试验指出,早期(出生第2天开始,至少2周,或者持续直到建立口服喂养)每周3次肌肉注射10 000 IU VA,能够改善在矫正胎龄36周时有发生ROP风险的早产儿的视网膜功能。
2.5 感染VA 是维持机体正常免疫功能的重要营养物质,VA可促进机体免疫器官的生长发育,维持皮肤黏膜屏障的完整性,改变细胞膜和免疫细胞溶菌膜的稳定性,促进免疫球蛋白的生成,增强吞噬细胞和NK 细胞的功能等,从而提高机体的非特异性免疫功能,同时VA参与调节机体的特异性免疫[25]。顾志勇等[26]的研究表明VA 缺乏与新生儿肺炎、败血症发生密切相关,合并有肺炎和败血症的住院新生儿血浆VA浓度更低。Chabra等[27]报道补充VA组同对照组相比血培养阳性败血症发病率高(48% vs 12%),Uberos等[28]也报道补充VA组败血症的发病率较高,推测可能是这些研究中反复肌肉注射VA,增加了感染的机率,从而掩盖VA减少感染的事实。
2.6 动脉导管未闭动脉导管未闭是早产儿常见的临床问题,使早产儿发生脑室内出血,坏死性小肠结肠炎及支气管肺发育不良等的风险增加。动脉导管的关闭经过两个阶段。在出生后最初的数小时,导管平滑肌细胞的收缩使导管形成功能性关闭;紧接着是导管的自发性关闭,包括内膜增生和平滑肌细胞凋亡或者移位。第一个阶段的发生主要是对动脉氧分压增加的反应,是导管自发性关闭所必需的[29]。Wu等[30]的研究表明,在早产胎鼠中,导管收缩机制已经具有功能,但是对氧气敏感机制尚未发育成熟;且VA能够加速动脉导管氧气敏感机制的成熟。而给超低出生体重儿出生的前28 d补充VA,对需要手术结扎的动脉导管未闭的发病率并没有影响[17]。
2.7 脑室内出血在一组小样本新生儿中,出生时肝脏VA储存低,脑室内出血的发生率较高,也较重[31],但是产后给超低出生体重儿补充VA没有降低Ⅲ级或者Ⅳ级脑室内出血的发病率[32]。给极低出生体重儿出生后的前28 d,每周3次肌肉注射5 000 IU VA,同对照组相比脑室内出血的发生没有差异[28]。
2.8 高胆红素血症人体红细胞膜对抗氧化损伤的抗氧化机制包括了VA、VE、VC、微量元素硒以及酶,诸如过氧化氢酶、超氧化物歧化酶、谷胱甘肽过氧化物酶。但在新生儿,特别是早产儿,抗氧化保护能力有限,红细胞膜容易受氧化损伤。在一组发生高胆红素血症的早产儿同对照组相比,血VA浓度偏低,差异有统计学意义,推测早产儿由于包括VA在内的抗氧化物质含量低,使他们氧化应激增加,而更容易发生高胆红素血症[33]。在持续胆汁淤积的胆道闭锁的新生儿中,尽管补充含有多种脂溶性维生素的聚乙二醇1000维生素E琥珀酸酯,包括维生素A在内的生化脂溶性维生素缺乏仍普遍存在,并且同胆红素水平呈负相关[34]。
3 VA的管理在关于VA的文献中,使用单位较多,并易混淆,为方便使用,现归纳如下:血浆视黄醇1 μmol/L=28.6 μg/dL,1 μg/dL=10 μg/L=0.035 μmol/L; 1 μg视黄醇当量=0.00349 μmol视黄醇=3.3 IU VA,1 IU VA=0.3 μg视黄醇=0.00105 μmol视黄醇。
国内最新指南推荐给新生儿肠外营养的VA量是每日150~300 μg/kg(相当于每日495~ 990 IU/kg)[35],在临床使用的脂溶性维生素的用量是每日1 mL/kg,10 mL脂溶性维生素含VA 0.69 mg,其1 mL含VA 69 μg,达不到指南所推荐的VA的量。国外亦有研究表明,在平均胎龄30周(26+2~33周)的早产儿中,按目前的喂养策略,在出生后最初的两周,只有11%的早产儿能够达到指南所推荐的VA的摄入量[36]。故在早产儿达到完全肠内营养前的早期,而该时期恰好是早产儿生长发育的关键时期,对VA的需求量高,但是补充的VA量却远远不足。2010年欧洲儿科学,胃肠病学,肝脏病学和营养学营养委员会推荐给早产儿VA用量是每日400~1 000 μg/kg,约每日1 330~3 300 IU/kg[37]。 目前国内指南推荐给早产儿补充VA的量远少于国外。
3.1 静脉补充目前临床上通常通过静脉补充VA(在肠外营养液中加入脂溶性维生素),但是VA会被管壁吸收,且会见光分解,故在输注时需避光或者使用棕色输液器。国外建议维VA应在安全准备好脂肪乳剂后尽早静脉补充,推荐在出生后的24 h内[36]。有学者建议肠外营养时需要大约每日2 600 IU/kg VA才能保持血视黄醇浓度≥0.7 μmol/L,但是目前国内外均无单独的静脉VA制剂可用,临床上不能增加脂溶性维生素的用量以满足对VA的需要量[38]。
3.2 口服补充当肠内营养建立后,可通过口服补充VA。临床上使用的维生素AD滴剂(伊可新,<1周岁)含有400单位维生素D3和1 500单位VA。需要注意的是,不同的早产儿配方奶粉所含有VA的量是不同的,国内使用的惠氏早产儿水解奶粉,100 mL含610 IU VA,当达到完全肠内营养(150 mL/kg)时,VA的摄入量达到976 IU/kg,能够达到国内指南所推荐的量[35]。
3.3 肌肉注射尽管Esteban Pretel等[13] 的研究表明,给超低出生体重儿出生后第一个月内每周3次肌肉注射5 000 IU VA能够降低早产儿死亡及氧气依赖的风险,然而研究指出反复肌肉注射给婴儿造成疼痛,并且可增加败血症的发生率[16]。国内肌肉注射补充VA并不普及,国外目前仍建议在建立肠内营养之前给超低出生体重儿在出生的前28 d每周3次连续4周肌肉注射5 000 IU VA。
3.4 气管吸入在小猪模型中,VA联合PS一起气管内给药,VA能够被肝脏快速吸收,并且不改变PS的作用[39]。Gadhia等[40]非随机性回顾性分析了VA联合吸入NO治疗机械通气的早产儿,结果表明,同单纯吸入NO组相比,能够降低出生体重在750~999 g组的早产儿支气管肺发育不良的发病率,并且能够改善出生体重在500~749 g组的早产儿在1岁时的神经认知功能。
4 VA的毒性VA中毒主要表现为嗜睡或过度兴奋,头痛、呕吐等高颅压症状,囟门未闭者可出现前囟隆起。目前并没有关于早产儿VA中毒的报道。国外有证据表明,肌肉注射VA,剂量高达每日8 500 IU/kg, 随访到18~22个月,未见明显的不良反应[41]。
5 结论VA是一种脂溶性维生素,它对上皮细胞、视网膜、肺、胃肠道、脑及免疫系统等的正常生长和发育均有非常重要的作用。VA水平与早产儿疾病的发生越来越受到关注。大量的循证医学表明,VA水平同早产儿疾病密切相关。目前指南推荐给早产儿补充VA的量并不能很好满足其出生后生长发育的需要,而不同的给药途径又存在不同的优缺点,有必要对它们进行比较研究,评价血的生化指标及比较早产儿不同的并发症,探讨更加有效的补充方法。此外VA同PS联合使用值得更加深入的研究。
| [1] | Wolf G. A history of vitamin A and retinoids[J]. FASEB J, 1996, 10(9):1102-1107. |
| [2] | Fares S, Feki M, Khouaja-Mokrani C, et al. Nutritional practice effectiveness to achieve adequate plasma vitamin A, E and D during the early postnatal life in Tunisian very low birth weight infants[J]. J Matern Fetal Neonatal Med, 2014:1-5.[Epub ahead of print] |
| [3] | Kositamongkol S, Suthutvoravut U, Chongviriyaphan N, et al. Vitamin A and E status in very low birth weight infants[J]. J Perinatol, 2011, 31(7):471-476. |
| [4] | Civardi E, Tzialla C, Garofoli F, et al. Nutritional needs of premature infants[J]. J Matern Fetal Neonatal Med, 2011, 24 Suppl 1:27-29. |
| [5] | 谢金水, 徐燕珊, 黄妙霞. 视黄醇结合蛋白和前白蛋白评价早产儿营养状况的价值[J]. 海南医学, 2015, 26(8):1165-1167. |
| [6] | Wardle SP, Hughes A, Chen S, et al. Randomised controlled trial of oral vitamin A supplementation in preterm infants to prevent chronic lung disease[J]. Arch Dis Child Fetal Neonatal Ed, 2001, 84(1):9-13. |
| [7] | Coste K, Labbe A. A study of the metabolic pathways of vitamin A in the fetal human lung[J]. Rev Mal Respir, 2011, 28(3):283-289. |
| [8] | Haider BA, Bhutta ZA. Neonatal vitamin A supplementation for the prevention of mortality and morbidity in term neonates in developing countries[J]. Cochrane Database Syst Rev, 2011,(10):CD006980. |
| [9] | Coste K, Labbe A. A study of the metabolic pathways of vitamin A in the fetal human lung[J]. Rev Mal Respir, 2011, 28(3):283-289. |
| [10] | Darlow BA, Graham PJ. Vitamin A supplementation to prevent mortality and short and long-term morbidity in very low birth weight infants[J]. Cochrane Database Syst Rev, 2011,(10):CD000501. |
| [11] | Chailley-Heu B, Chelly N, Lelièvre-Pégorier M, et al. Mild vitamin A deficiency delays fetal lung maturation in the rat[J]. Am J Respir Cell Mol Biol, 1999, 21(1):89-96. |
| [12] | Ruttenstock EM, Doi T, Dingemann J, et al. Prenatal retinoic acid upregulates connexin 43(Cx43) gene expression in pulmonary hypoplasia in the nitrofen-induced congenital diaphragmatic hernia rat model[J]. J Pediatr Surg, 2012, 47(2):336-340. |
| [13] | Esteban Pretel G, Msrin MP, Renau-Piqueras J, et al. Vitamin A deficiency alters rat lung alveolar basement membrane:reversibility by retinoic acid[J]. J Nutr Biochern, 2010, 21(3):227-236. |
| [14] | 王少梅, 林丽羽. 盐酸氨溴索结合维生素A对未足月胎膜早破促胎肺成熟的效果[J]. 现代医院, 2013, 13(6):46-48. |
| [15] | 孟君, 吴洪涛. 新生儿呼吸窘迫综合征维生素A、矿物质水平的研究[J]. 中国儿童保健杂志, 2015, 23(11):1221-1223. |
| [16] | 程晨, 包蕾. 早产儿血清维生素A水平与新生儿呼吸窘迫综合征的相关性分析[J]. 临床儿科杂志,2015, 33(8):734-737. |
| [17] | Moreira A, Caskey M, Fonseca R, et al. Impact of providing vitamin A to the routine pulmonary care of extremely low birth weight infants[J]. J Matern Fetal Neonatal Med, 2012, 25(1):84-88. |
| [18] | Kiatchoosakun P, Jirapradittha J, Panthongviriyakul MC, et al. Vitamin A supplementation for prevention of bronchopulmonary dysplasia in very-low-birth-weight premature Thai infants:a randomized trial[J]. J Med Assoc Thai, 2014, 97 Suppl 10:S82-S88. |
| [19] | Londhe VA, Nolen TL, Das A, et al. Vitamin A supplementation in extremely low-birth-weight infants:subgroup analysis in small-for-gestational-age infants[J]. Am J Perinatol, 2013, 30(9):771-780. |
| [20] | 刘霞, 李廷玉, 陈洁. 维生素A缺乏影响肠道屏障功能的研究进展[J]. 生命科学, 2012, 24(1):32-36. |
| [21] | Yang Y, Yuan Y, Tao Y, et al. Effects of vitamin A deficiency on mucosal immunity and response to intestinal infection in rats[J]. Nutrition, 2011, 27(2):227-232. |
| [22] | Ozdemir R, Yurttutan S, Sari FN, et al. All-trans-retinoic acid attenuates intestinal injury in a neonatal rat model of necrotizing enterocolitis[J]. Neonatology, 2013, 104(1):22-27. |
| [23] | Ozkan H, Duman N, Kumral A, et al. Inhibition of vascular endothelial growth factor-induced retinal neovascularization by retinoic acid in experimental retinopathy of prematurity[J]. Physiol Res, 2006, 55(3):267-275. |
| [24] | Mactier H, McCulloch DL, Hamilton R, et al. Vitamin A supplementation improves retinal function in infants at risk of retinopathy of prematurity[J]. J Pediatr, 2012, 160(6):954-959. |
| [25] | Ross AC, Chen Q, Ma Y. Vitamin A and retinoic acid in the regulation of B-cell development and antibody production[J]. Vitam Horm, 2011, 86:103-126. |
| [26] | 顾志勇, 余加林. 维生素A与新生儿肺炎、败血症及呼吸窘迫综合征相关性的临床研究[J]. 儿科药学杂志, 2015, 21(6):11-14. |
| [27] | Chabra S, Mayock DE, Zerzan J, et al. Vitamin A status after prophylactic intramuscular vitamin A supplementation in extremely low birth weight infants[J]. Nutr Clin Pract, 2013, 28(3):381-386. |
| [28] | Uberos J, Miras-Baldo M, Jerez-Calero A, et al. Effectiveness of vitamin a in the prevention of complications of prematurity[J]. Pediatr Neonatol, 2014, 55(5):358-362. |
| [29] | Ravishankar C, Nafday S, Green RS, et al. A trial of vitamin A therapy to facilitate ductal closure in premature infants[J]. J Pediatr, 2003, 143(5):644-648. |
| [30] | Wu GR, Jing S, Momma K, et al. The effect of vitamin A on contraction of the ductus arteriosus in fetal rat[J]. Pediatr Res, 2001, 49(6):747-754. |
| [31] | Zachman RD, Samuels DP, Brand JM, et al. Use of the intramuscular relative-dose-response test to predict bronchopulmonary dysplasia in premature infants[J]. Am J Clin Nutr, 1996, 63(1):123-129. |
| [32] | Tyson JE, Wright LL, Oh W, et al. Vitamin A supplementation for extremely-low-birth-weight infants. National Institute of Child Health and Human Development Neonatal Research Network[J]. N Engl J Med, 1999, 340(25):1962-1968. |
| [33] | Turgut M, Başaran O, Cekmen M, et al. Oxidant and antioxidant levels in preterm newborns with idiopathic hyperbilirubinaemia[J]. J Paediatr Child Health, 2004, 40(11):633-637. |
| [34] | Shneider BL, Magee JC, Bezerra JA, et al. Efficacy of fatsoluble vitamin supplementation in infants with biliary atresia[J]. Pediatrics, 2012, 130(3):e607-e614. |
| [35] | 蔡威, 汤庆娅, 王莹, 等. 中国新生儿营养支持临床应用指南[J]. 临床儿科杂志, 2013, 31(12):1177-1182. |
| [36] | Mactier H, Mokaya MM, Farrell LE, et al. Vitamin A provision for preterm infants:are we meeting current guidelines?[J]. Arch Dis Child Fetal Neonatal Ed, 2011, 96(4):F286-F289. |
| [37] | Agostoni C, Buonocore G, Carnielli VP, et al. Enteral nutrient supply for preterm infants:commentary from the European Society of Paediatric Gastroenterology, Hepatology and Nutrition Committee on Nutrition[J]. J Pediatr Gastroenterol Nutr, 2010, 50(1):85-91. |
| [38] | Werkman SH, Peeples JM, Cooke RJ, et al. Effect of vitamin A supplementation of intravenous lipids on early vitamin A intake and status of premature infants[J]. Am J Clin Nutr, 1994, 59(3):586-592. |
| [39] | Singh AJ, Bronshtein V, Khashu M, et al. Vitamin A is systemically bioavailable after intratracheal administration with surfactant in an animal model of newborn respiratory distress[J]. Pediatr Res, 2010, 67(6):619-623. |
| [40] | Gadhia MM, Cutter GR, Abman SH, et al. Effects of early inhaled nitric oxide therapy and vitamin A supplementation on the risk for bronchopulmonary dysplasia in premature newborns with respiratory failure[J]. J Pediatr, 2014, 164(4):744-748. |
| [41] | Mactier H, McCulloch DL, Hamilton R, et al. Vitamin A supplementation improves retinal function in infants at risk of retinopathy of prematurity[J]. J Pediatr, 2012,160(6):954-959. |
 2016, Vol. 18
2016, Vol. 18

