巨细胞病毒(cytomegalovirus,CMV)属于疱疹病毒的一种,人群中多为无临床症状的隐匿性感染。生后14 d至3个月内的感染称为围生期CMV感染,但围生期CMV感染的临床特征及转归尚缺少系统的研究数据。本研究分析总结了近5年上海交通大学医学院附属新华医院儿内科病房收治的围生期CMV感染患儿共237例,以期提高对围生期CMV感染的认识和治疗效果的评估。
1 资料与方法 1.1 研究对象2008年1月至2012年12月我院儿内科住院治疗的围生期CMV感染患儿共237例,均符合临床诊断为围生期活动性CMV感染的标准[1, 2]:患儿于生后14 d至3个月内证实存在CMV感染,即血清CMV-IgM阳性(或和CMV-IgG阳性)或血/尿CMV-DNA扩增阳性(>1×103拷贝/mL),并出现与CMV感染相关的临床症状或体征,CMV肝炎除外婴儿期常见肝炎病毒感染,呼吸道感染除外其他常见呼吸道病毒、细菌或支原体感染。
1.2 方法回顾性分析围生期CMV感染患儿的临床表现、辅助检查结果和临床用药等临床资料。
(1)病原学检测:主要采用酶联免疫吸附试验(ELISA)检测患儿血清中CMV-IgM、IgG,采用聚合酶链反应(PCR)检测患儿血及尿中CMV-DNA拷贝数。
(2)更昔洛韦治疗的指征为:患儿存在围生期活动性CMV感染,即病原学检测阳性,并出现与CMV感染相关的临床症状或体征,如肝脾肿大、黄疸、肺部感染等。
(3)治疗方法:根据CMV感染临床诊疗指南及我院诊疗经验[2, 3, 4, 5, 6]进行治疗。更昔洛韦诱导治疗为5 mg/(kg·次),每12 h 1次,静脉滴注2周;维持治疗5 mg/(kg·次),每天1次,静脉滴注或口服。维持量治疗满2周后复查病毒学指标及肝功能,若病毒抗体转阴且肝功能指标正常后予以停药,若无明显改善,继续给予维持量治疗,总疗程不超过3个月。抗病毒治疗同时予谷胱甘肽和(或)甘利欣静脉滴注保肝治疗。
(4)疗效判定:患儿经治疗后,若临床症状、体征消失,肝脾回缩至正常,胆红素和血清丙氨酸氨基转移酶(ALT)均降至正常,复查胸片病灶消散或明显吸收则判断为治愈;若上述表现无显著改善或者加重,则判断为未治愈。
1.3 统计学分析采用SPSS 19.0统计软件进行统计学处理与分析。计数资料以百分率(%)表示,组间比较采用 Pearson χ2检验或 Fisher 精确概率法;计量资料以均值±标准差( x±s)表示,两组均值的比较采用成组t检验。对于更昔洛韦疗效的影响因素分析先采用单因素χ2检验筛选出有统计学意义的变量,再对这些变量进行多因素logistic逐步回归分析。P<0.05为差异有统计学意义。
2 结果 2.1 一般资料2008年1月至2012年12月我院儿内科收治0~3个月龄CMV感染患儿共240例,排除3例先天性症状性CMV感染(出生后14 d内病原性检测阳性且伴有临床表现),围生期CMV感染病例共237例。237例CMV感染患儿中,男154例,女83例,男女之比约为2:1;平均年龄为2.0±0.6个月;平均住院18±2.3 d。237例患儿中,早产儿31例(13.1%),平均胎龄36±0.3周,平均出生体重2.5±0.3 kg;足月儿203例(85.7%),平均胎龄38.0±0.9周,平均出生体重3.3±0.6 kg;过期产儿3例(1.3%)。其中,小于胎龄儿(SGA)42例(17.7%)。
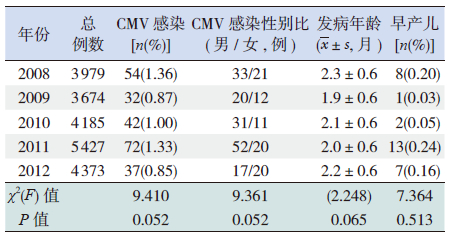
2008~2012年5年间,围生期CMV感染患儿的基本特征如性别比例、发病年龄和早产儿比例差异均无统计学意义;各年围生期CMV感染患儿占总住院患儿的比例差异亦无统计学意义(表 1)。
| 表 1 2008~2012 年围生期CMV 感染患儿一般特征 |
CMV感染患儿多为2个或2个以上系统受累。其中,2个系统受累为71.3%(169/237),3个及3个以上系统受累为14.8%(35/237),而单脏器受累仅为13.9%(33/237)。在2个系统受累的患儿中,主要有CMV肝炎合并CMV肺炎(43.1%),CMV肝炎合并心肌损害(16.7%),CMV肺炎合并呕吐、纳差、腹泻等消化系统症状(8.7%)。
围生期CMV感染主要累及消化系统和呼吸系统,表现为CMV肝炎和CMV肺炎。在CMV肝炎162例(68.4%)患儿中,以亚临床型肝炎(69例)最多,其后依次为黄疸型肝炎(43例)、无黄疸型肝炎(38例)和胆汁淤积型肝炎(12例)。CMV肺炎135例(56.9%)患儿中,因CMV肺炎2次及2次以上入院治疗者达9例。神经系统受累主要为病毒性脑炎20例(8.44%),而血液系统受累可表现为贫血12例(5.1%)和特发性血小板减少性紫癜8例(3.4%)。
2.3 辅助检查结果血CMV-IgM及血/尿CMV-DNA均阳性为3.8%(9/237),仅血CMV-IgM阳性为90.3%(214/237),仅血/尿CMV-DNA阳性为5.9%(14/237),即血CMV-IgM阳性率为94.1%,血/尿CMV-DNA阳性率为9.7%。其中,血/尿CMV-DNA扩增阳性标本范围为(1.1×103~7.8×103)拷贝/mL,平均2.8×102拷贝/mL。血和尿CMV-DNA扩增均阳性仅4例。
胸部X线呈间质性肺炎改变占67.3%(76/113);核素99mTc-EHIDA肝胆显像或磁共振胰胆管成像(MRCP)提示胆汁淤积或排泄延迟12例(5%);肝细胞组织活检病理报告提示发现CMV包涵体2例;脑干听觉诱发电位检查示中至重度异常3例。
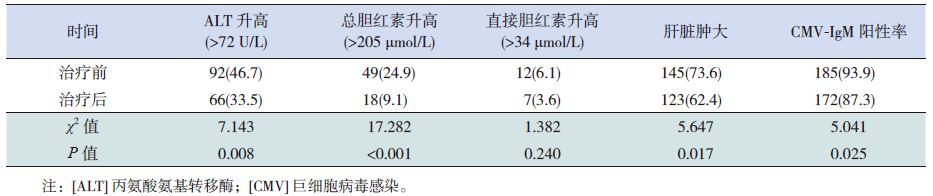
2.4 治疗与转归197例患儿(83.1%)接受更昔洛韦(山东罗欣药业股份有限公司生产)静脉滴注治疗,使用前均与家属签署知情同意书。在使用更昔洛韦抗病毒治疗的197例患儿中,诱导+维持治疗后治愈率为88.3%(174/197)。患儿经更昔洛韦诱导治疗后肝损程度及病原学检测均有明显改善,见表 2。7例患儿因更昔洛韦不良反应而停止抗病毒治疗,分别为2例用药后血常规提示外周白细胞<4.0×109/L,5例用药后肝酶显著增高(1周内上升>2倍用药前水平),加强升白细胞及保肝治疗后好转。
| 表 2 197 例CMV 感染患儿更昔洛韦治疗前后肝脏损害情况的比较 [n(%)] |
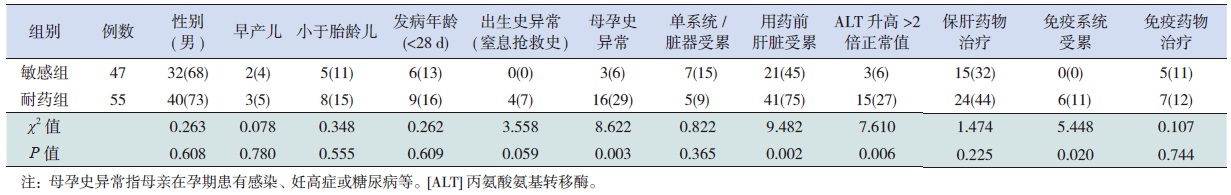
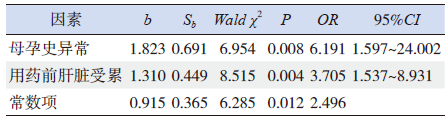
为探讨围生期CMV感染患儿对更昔洛韦诱导治疗敏感性的影响因素,现将临床资料较完整的102例患儿分为更昔洛韦耐药组(诱导治疗期间临床表现无好转)和更昔洛韦敏感组(诱导治疗期间临床表现好转伴/不伴血CMV-IgM转阴)。单因素分析显示,两组间母孕史异常、用药前患儿肝脏受累、ALT明显升高和免疫系统受累率差异具有统计学意义(P<0.05),见表 3。将上述差异有统计学意义的因素纳入多因素logistic逐步回归分析,显示母孕史异常和用药前患儿肝脏受累是影响更昔洛韦对CMV感染患儿疗效的独立危险因素,即母孕史异常的患儿出现更昔洛韦耐药的风险是无母孕史异常患儿的6.191倍,而用药前存在肝脏受累的患儿出现更昔洛韦耐药的风险是用药前肝脏未受累患儿的3.705倍(表 4)。
| 表 3 更昔洛韦敏感组与耐药组之单因素比较 [n(%)] |
| 表 4 影响CMV 感染患儿更昔洛韦诱导治疗敏感性的多因 素logistic 回归分析 |
CMV感染主要见于1岁以内的儿童,尤其是3个月以内的婴幼儿,后者可能与出生过程中接触产妇阴道分泌物或生后吮吸母乳密切相关。本研究发现,5年间围生期CMV感染患儿的基本特征(包括性别比例、发病年龄、早产儿比例)及占同期总住院患儿的比例无明显差异,故可推测近年来围生期CMV感染患儿的流行病学特征较为稳定,无明显波动。我院围生期CMV感染患儿占总住院患儿的平均比例为1.1%,低于国内文献报道的20.22%[1],考虑原因可能为检测出的CMV感染患儿为有症状的活动性感染,而其余部分无症状的隐性CMV感染患儿未被检出,但该结果尚在国外相关研究报道的0.6~12%[7, 8, 9]范围内。
先天性CMV感染是引起宫内发育受限(intrauterine growth restriction,IUGR)原因之一,发生率可高达30%左右[10, 11],而本研究发现围生期CMV感染患儿的SGA比例为17.7%,明显低于先天性CMV感染所致SGA的发生率。另一方面,先天性CMV感染也可累及神经系统,国外研究报道发生率可高达40%~60%[12, 13],且主要为神经系统发育异常。本研究发现,围生期CMV感染患儿神经系统受累仅为8.4%,明显低于先天性CMV感染,且主要为病毒性脑炎。产生该现象的原因可能与两种CMV感染类型的发生时间有关。先天性CMV感染主要由宫内感染引起,即活动性CMV感染的母亲与胎儿间通过子宫胎盘垂直传播。孕早期是胎儿神经系统和体格发育的关键时期,此时若发生CMV感染,易引起胎儿IUGR,生后发生脑发育迟缓等神经系统后遗症[14, 15]。而围生期CMV感染主要通过接触产妇阴道分泌物或生后母乳喂养等途径感染,此时患儿各组织器官发育已趋成熟,不易发生脑发育畸形,但血脑屏障尚不完善,易受病毒侵犯形成病毒性脑炎。
除神经系统外,CMV病毒主要侵犯消化系统、呼吸系统和循环系统等,引起相应的临床症状,最常见的临床类型为CMV肝炎合并CMV肺炎。CMV对肝细胞具有较高亲和力,引起肝细胞变性、坏死、凋亡和纤维增生等一系列损伤。若感染同时累及肝细胞及胆管上皮细胞,使各级胆管上皮细胞发生病变,胆汁流出不畅,导致肝内外胆汁淤积和肝脏肿大,且肿大的病变肝细胞可影响胆汁流出,同时胆管炎症、纤维化及胆管上皮增殖,最终可使胆管发生狭窄或闭锁。国外一些学者认为,CMV肝炎是一种自限性疾病,可不进行抗病毒治疗[16, 17]。我院CMV肝炎中多数病例临床表现较轻,肝脾肿大和黄疸具有一定的自限性,预后较好。但胆汁淤积型肝炎患儿病情一般较重,表现为黄疸较深,大便色浅,血清胆红素以直接胆红素值明显升高为主,影像学上可见胆汁淤积,伴/不伴少量腹腔积液。目前认为,CMV感染是引起婴幼儿胆汁淤积型肝炎最常见的致病因素,一旦CMV感染引起的肝炎治疗不及时,病程进一步发展,可能引起严重的并发症,如门静脉高压、肝硬化和肝衰竭,甚至死亡。同样,CMV也可侵犯支气管黏膜及肺泡上皮细胞引起呼吸道感染,以喘息性支气管肺炎为主,临床症状和影像学表现常缺乏一定的特异性。在研究中我们发现,反复发作或迁延不愈是婴幼儿CMV肺炎的特点之一,部分患儿可因CMV肺炎多次入院治疗。因此,对于临床表现为反复呼吸道感染,特别是合并肝功能损害和肝脾肿大者,应警惕CMV感染可能。
CMV感染人体后可产生特异性IgM和IgG,检测其抗体水平可证实感染的存在。IgM阳性即表示机体存在活动性感染,但其产生一般在感染后2~4周,阳性率介于20%~70%[18]之间,因此在先天性CMV感染患儿中敏感性较低[19]。本研究显示,围生期CMV患儿血CMV-IgM阳性率可达94.1%,提示临床上血清学检测可作为围生期CMV感染患儿的早期、快速、敏感的有效检测指标。而 血/尿CMV-DNA阳性率仅为9.7%,低于其他文献报道[19],其原因可能为:(1)患儿多为疾病早期取血/尿样本进行PCR-CMV-DNA检测,阳性率低; (2)CMV具有间歇性排毒的特点,单次单部位标本检测阳性率较低;(3)各实验室在DNA抽提方法、基因组检测位点选择、PCR反应条件等方面存在很大差异,可能会影响该检测技术的敏感性。
更昔洛韦是一种广谱的抗DNA病毒药物,对CMV作用较理想。目前推荐更昔洛韦抗病毒治疗诱导治疗+维持治疗疗程应在4周以上,本研究中也相应采用诱导2周+维持2周,并根据门诊病原学检测结果适当延长维持治疗时间,但总疗程不超过3个月[5, 20]。在使用更昔洛韦抗病毒治疗的197例患儿中,治愈率为88.3%,与胡劲涛等[21]通过Meta分析得到的更昔洛韦总有效率(91.4%)相近,证明使用更昔洛韦抗病毒治疗疗程达1个月以上效果显著。在临床工作中,影响更昔洛韦使用率的一大因素是药物的不良反应。本研究发现,虽然更昔洛韦可引起白细胞减少和肝酶升高等不良反应,但发生率较低,且加强支持治疗后可在短期内好转,总体疗效值得肯定。因此,建议对于2个及以上器官或系统受累的CMV感染或者严重的CMV肝炎患儿应积极使用更昔洛韦治疗,并在用药前后注意血象及肝功能的变化。另外,本研究通过对比更昔洛韦耐药组和敏感组后发现母孕史异常(如妊高症、糖尿病和孕期感染)和用药前患儿肝脏受累是影响更昔洛韦疗效的独立危险因素。我们推测,母孕史异常的患儿由于免疫系统发育尚不成熟更易受CMV侵犯从而在体内大量复制,影响更昔洛韦疗效。Choi等[22]通过研究发现患儿体内CMV病毒高负荷量易引起更昔洛韦耐药,而Fischer等[23]则认为CMV基因突变也可影响疗效,如UL-54基因突变与更昔洛韦敏感有关,而UL-97基因突变与耐药有关。同样,影响更昔洛韦疗效的另一因素为患儿用药前肝脏受累情况,若用药前ALT水平明显升高,可影响更昔洛韦疗效,其原因可能与更昔洛韦经肝脏代谢有关。由于本研究数据有限,影响更昔洛韦疗效的相关因素分析有待进一步多中心、大样本的随机对照研究来证实。
综上所述,本研究显示,围生期CMV感染近年的流行病学特征较为稳定。围生期CMV感染常侵犯患儿多个脏器或系统,其中以肝肺损害最为常见。更昔洛韦抗病毒治疗针对围生期CMV感染疗效明显,不良反应发生率低,母孕史异常和用药前患儿肝脏受累会增加围生期CMV患儿对更昔洛韦耐药的风险。
| [1] | 北京地区母婴巨细胞病毒感染调查协作组. 北京地区母婴巨细胞病毒感染状况调查[J]. 中华围产医学杂志, 2012, 15(8):459-461. |
| [2] | 中华医学会儿科学分会感染学组; 全国儿科临床病毒感染协作组; 《中华儿科杂志》编辑委员会. 儿童巨细胞病毒性疾病诊断和防治的建议[J]. 中华儿科杂志, 2012, 50(4):290-292. |
| [3] | 董永绥, 方峰. 巨细胞病毒感染[M]//胡亚美, 江载芳. 诸福棠实用儿科学(上册). 第7版. 北京:人民卫生出版社, 2002:816-821. |
| [4] | 于四景, 李双杰, 肖耿吉, 等. 更昔洛韦治疗巨细胞病毒感染疗程的随机对照研究[J]. 实用预防医学, 2013, 20(4):467-470. |
| [5] | 沈玲云, 蒋琼俏. 更昔洛韦治疗儿童巨细胞病毒感染两组方案的比较[J]. 现代医药卫生, 2007, 23(7):989. |
| [6] | 王丽, 钱继红, 张拥军, 等. 人巨细胞病毒肝炎综合征婴儿外周血宿主microRNA表达的变化[J]. 中华实用儿科临床杂志, 2013, 28(10):737-740. |
| [7] | Swanson EC, Schleiss MR. Congenital cytomegalovirus infection:new prospects for prevention and therapy[J]. Pediatr Clin North Am, 2013, 60(2):335-349. |
| [8] | Ivanov IS, Popov NI, Moshe RI, et al. Prevalence of cytomegalovirus infection in hospitalized infants[J]. Folia Med(Plovdiv), 2012, 54(4):45-52. |
| [9] | Narvaez-Arzate RV, Olguin-Mexquitic L, Lima-Rogel V, et al. Cytomegalovirus infection in infants admitted to a neonatal intensive care unit[J]. J Matern Fetal Neonatal Med, 2013, 26(11):1103-1106. |
| [10] | Naing Z, Rayner B, Killikulangara A, et al. Prevalence of viruses in stool of premature neonates at a neonatal intensive care unit[J]. J Paediatr Child Health, 2013, 49(3):E221-E226. |
| [11] | Pereira L, Petitt M, Fong A, et al. Intrauterine growth restriction caused by underlying congenital cytomegalovirus infection[J]. J Infect Dis, 2014, 209(10):1573-1584. |
| [12] | Hasosah MY, Kutbi SY, Al-Amri AW, et al. Perinatal cytomegalovirus hepatitis in Saudi infants:a case series[J]. Saudi J Gastroenterol, 2012, 18(3):208-213. |
| [13] | Cybulska P, Ni A, Jimenez-Rivera C. Viral hepatitis:retrospective review in a canadian pediatric hospital[J]. ISRN Pediatr, 2011, 2011:Article ID 182964, 4 pages. |
| [14] | Bale JF Jr. Fetal infection and brain development[J]. Clin Perinatol, 2009, 36(3):639-653. |
| [15] | Suzuki Y, Toribe Y, Mogami Y, et al. Epilepsy in patients with congenital cytomegalovirus infection[J]. Brain Dev, 2008, 30(6):420-424. |
| [16] | White AL, Hedlund GL, Bale JF Jr. Congenital cytomegalovirus infection and brain clefting[J]. Pediatr Neurol, 2014, 50(3):218-223. |
| [17] | Waters A, Jennings K, Fitzpatrick E, et al. Incidence of congenital cytomegalovirus infection in Ireland:implication for screening and diagnosis[J]. J Clin Virol, 2014, 59(3):156-160. |
| [18] | Lazzarotto T, Guerra B, Lanari M, et al. New advances in the diagnosis of congenital cytomegalovirus infection[J]. J Clin Virol, 2008, 41(3):192-197. |
| [19] | 杨长仪, 陈涵强, 石惠英, 等. 新生儿先天性巨细胞病毒感染的诊断及治疗探讨[J]. 中华围产医学杂志, 2009, 12(5):359-362. |
| [20] | 王卫, 刘晓红. 更昔洛韦(丽科伟)在先天性巨细胞病毒感染的临床应用[J]. 小儿急救医学, 2002, 9(3):148-150. |
| [21] | 胡劲涛, 陈平洋, 谢宗德, 等. 更昔洛韦治疗先天性巨细胞病毒感染患儿的系统评价[J]. 中国当代儿科杂志, 2010, 12(1):35-39. |
| [22] | Choi KY, Sharon B, Balfour HH Jr, et al. Emergence of antiviral resistance during oral valganciclovir treatment of an infant with congenital cytomegalovirus(CMV) infection[J]. J Clin Virol, 2013, 57(4):356-360. |
| [23] | Fischer L, Laib Sampaio K, Jahn G, et al. Generation and characterization of a GCV resistant HCMV UL97-mutation and a drug sensitive UL54-mutation[J]. Antiviral Res, 2013, 100(3):575-577. |
 2016, Vol. 18
2016, Vol. 18