新生儿高胆红素血症(neonatal hyperbiliru- binemia)是新生儿时期最常见的疾病之一,约50% ~ 70% 的足月新生儿及80% 的早产儿生后发生该病[1],亚裔较之其他人种具有更高的发病率[2]。未经治疗的新生儿高胆红素血症患儿可发生胆红素脑病等严重并发症,导致患儿死亡或遗留不可逆的神经系统后遗症,因此及时有效的治疗对降低新生儿围生期死亡率、防止胆红素脑病及其后遗症的发生具有极其重要的意义[3]。光照疗法(phototherapy,PT)是新生儿高胆红素血症的首选疗法,使用已超过50年,但迄今为止,最有效而不良反应最小的光疗模式仍在研究中。光疗的疗效主要取决于光源种类(波长)、光强度、受照皮肤范围及受照时间。由于光疗疗效与光强度密切相关,基本呈正相关,因此近年来人们逐渐开始重视光强度对光疗疗效的影响。美国儿科学会于2004年提出强光疗(intensive phototherapy)概念,指应用光强度超过30 μW/(cm2/nm)的光源进行治疗的方法[4],而传统光疗则指应用光强度约10~16 μW/(cm2/nm)的光源进行治疗。目前国外有研究提示强光疗可更好地降低血胆红素水平[5]。 亚裔新生儿发生严重非溶血性高胆红素血症几率明显高于其他人种,但目前亚裔新生儿采用强光疗治疗高胆红素血症的相关文献报道尚较少,且现有文献对强光疗治疗过程中不良反应研究较少,国内多数医院亦仍采用传统光疗治疗新生儿高胆红素血症。因此本研究通过前瞻性研究,对近年来收住北京大学人民医院NICU 的新生儿高胆红素血症患儿采用不同强度光疗进行治疗,对两种强度光疗法疗效及不良反应进行比较分析,现报告如下。
1 资料与方法 1.1 研究对象2012年4月至2014年4月收住我院 NICU 的新生儿高胆红素血症患儿按下述条件纳入研究。入组标准:胎龄37~41周,入院年龄为生后2~10 d,血胆红素水平达需光疗水平的新生儿[4]。 排除标准:(1)入院年龄>10 d;(2)患有新生儿溶血病、新生儿败血症、直接胆红素增高、先天遗传或代谢性疾病;(3)生后24 h内血胆红素水平>85 μmol/L;(4)血胆红素水平不足光疗指征或已达换血指征。对符合入组标准的患儿在入院时进行随机分组,其中强光疗组72例,传统光疗组72例。两组患儿所患其他疾病情况无差异,均按诊疗常规进行治疗。
1.2 光疗方法所有患儿入院后停止母乳喂养,采用人工喂养方法。传统光疗组采用波长425~475 nm 蓝光灯(北京三优巨龙科技有限公司光疗婴儿培养箱B-1000G 配套蓝光灯,产地:中国),光强度10~12 μW/(cm2/nm)光疗。强光疗组采用波长400~550 nm 白光灯( 美国GE-Datex Ohmeda 公司Giraffe spot PT light 光疗设备,产地:美国),光强度35~45 μW/(cm2/nm)光疗。进行光疗时用统一规格的眼罩和纸尿裤遮挡患儿的眼睛与生殖器。 光源与患儿距离控制在30±5 cm。所有治疗用光源每周进行光强度监测,如发现光强度下降,则及时更换光源。患儿入院后24 h内持续照射,间歇12 h后再照射12 h,以此类推。光疗持续时间根据患儿血胆红素水平决定,当患儿体内血胆红素水平降至可停止光疗水平后停止光疗。
1.3 光疗疗效观察指标进行光疗前、开始光疗后6 h、12 h 、24 h、 48 h及72 h分别监测患儿血总胆红素水平以及下降情况,同时监测患儿平均每小时血总胆红素下降情况,对比不同强度光疗降低血胆红素水平能力。同时记录患儿总光疗时间、总住院时间。
1.4 光疗不良反应的观察监测传统光疗组及强光疗组患儿发生临床常见并发症如腹泻病、皮疹、体温异常、青铜症等情况,同时监测患儿血常规及血钙水平,了解并发症发生情况及严重程度。
1.5 统计学分析采用SPSS 17.0统计软件分析。正态分布的计量资料以均数± 标准差(x±s)表示,组间均数的比较采用独立样本t 检验;计数资料用率(%) 表示,采用χ2 检验进行组间比较;P<0.05为差异有统计学意义。
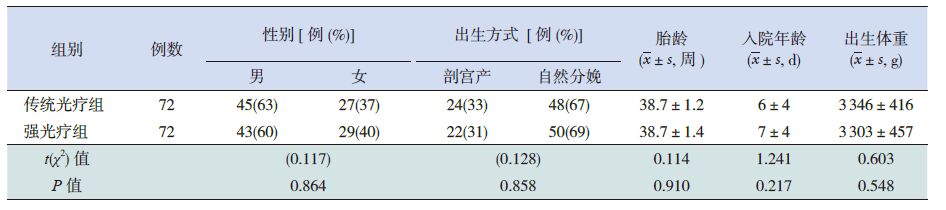
2 结果 2.1 两组一般资料的比较强光疗组与传统光疗组在入院年龄、胎龄、 性别、出生方式、出生体重等的比较中差异均无统计学意义(P>0.05),见表 1。
|
|
表 1 强光疗组及传统光疗组一般资料的比较 |
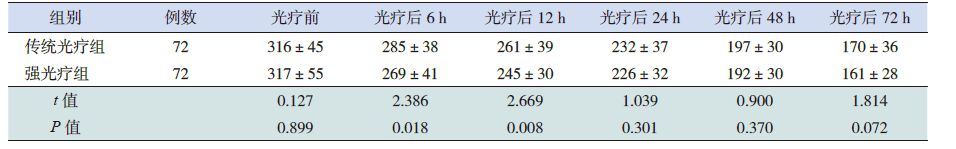
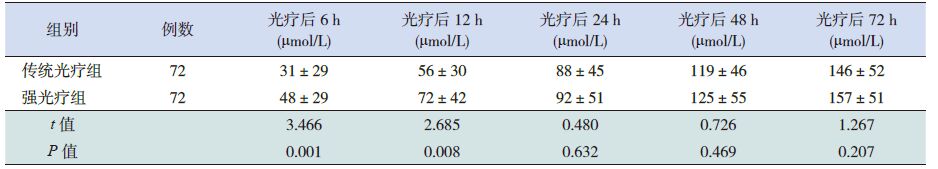
两组患儿光疗前总胆红素水平差异无统计学意义。开始光疗后6 h及12 h强光疗组患儿血总胆红素水平明显低于传统光疗组,且血总胆红素下降水平明显高于传统光疗组,差异有统计学意义(P<0.05),而在开始光疗后24 h、48 h及72 h,两组血总胆红素水平和血总胆红素下降水平差异无统计学意义(表 2~3)。强光疗组患儿总光疗时间短于传统光疗组,差异有统计学意义(58±11 h vs 64±19 h;t=2.344,P=0.020)。 而两组患儿的总住院时间差异无统计学意义(7.1±2.4 d vs 7.4±3.3 d;t=0.688,P>0.05)。
|
|
表 2 强光疗组与传统光疗组光疗后血总胆红素水平比较(x±s,μmol/L) |
|
|
表 3 强光疗组与传统光疗组光疗后血总胆红素降幅情况比较 (x±s) |
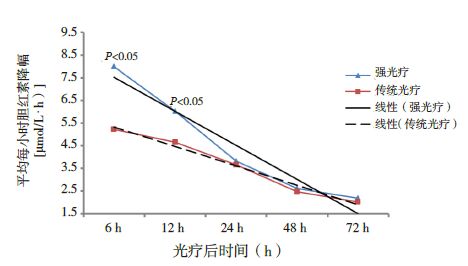
开始光疗后6 h及12 h时,强光疗组平均每小时血总胆红素降幅明显高于传统光疗组(6 h: 8.0±4.8 μmol/L vs 5.2±4.8 μmol/L,t=3.474,P<0.05;12 h:6.0±3.5 μmol/L vs 4.7±2.5 μmol/L,t=2.669,P<0.05); 光疗开始后24 h、48 h及72 h,强光疗组患儿平均每小时血总胆红素降幅仍9.58.57.56.55.54.53.52.51.5P<0.05P<0.05强光疗传统光疗线性(强光疗) 线性(传统光疗)高于传统光疗组,但差异无统计学意义。强光疗组患儿总体平均每小时血总胆红素降幅趋势线高于传统光疗组,且倾斜角大于传统光疗组(图 1)。
|
图 1 强光疗组与传统光疗组光疗后平均小时胆红素降幅情况比较 光疗后 6 h及 12 h时,强光疗组患儿平均每小时血总胆红素降幅明显高于传统光疗组(P<0.05)。线性(强光疗) 表示强光疗后平均每小时血总胆红素降幅趋势,线性(传统光疗)表示传统光疗后平均每小时血总胆红素降幅趋势。 |
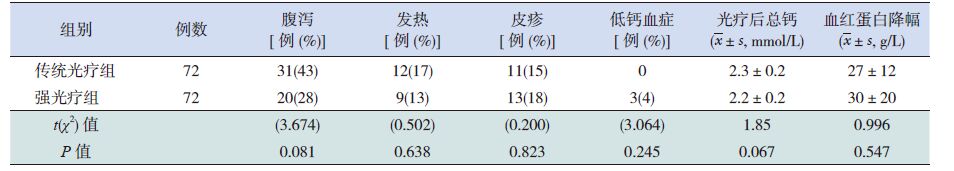
强光疗组患儿腹泻及发热发生率低于传统光疗组,但皮疹及低钙血症发生率则高于传统光疗组,差异均无统计学意义(P>0.05)。强光疗组光疗后血总钙水平稍低于传统光疗组,血红蛋白下降程度稍高于传统光疗组,但差异均无统计学意义。见表4。
|
|
表 4 强光疗组与传统光疗组光疗相关不良反应的比较 |
新生儿高胆红素血症是新生儿时期发病率极高的疾病之一,约占住院新生儿的20%~40%,由于胆红素具有神经毒性,可导致神经系统损伤,故严重高胆红素血症属于儿科急重症[6]。未经治疗的高胆红素血症患儿可发生胆红素脑病等严重并发症,约10% 患儿死于急性期,70% 遗留不可逆的神经系统后遗症,是人类听力障碍、视觉异常、智能发育迟缓以及其他神经行为异常的重要原因[7, 8],因此及时有效地治疗新生儿高胆红素血症具有极其重要的意义。
本研究采用前瞻性随机对照方法,对强光疗及传统光疗减低高胆红素血症患儿血胆红素水平的效果进行了对比。研究发现,分别利用强光疗及传统光疗治疗高胆红素血症后6 h及12 h,强光疗组患儿血总胆红素水平明显低于传统光疗组患儿,同时在开始光疗后6 h及12 h,强光疗组患儿血总胆红素水平下降程度明显高于传统光疗组,差别有统计学意义,而开始光疗后24 h、48 h及72 h时,强光疗组患儿血总胆红素水平均低于传统光疗组,同时强光疗组患儿血总胆红素下降水平亦高于传统光疗组,但差别无统计学意义,说明采用强光疗在降低血总胆红素水平方面优于传统光疗。另外,强光疗组患儿平均每小时胆红素降幅趋势线明显高于传统光疗组,说明强光疗组患儿平均每小时总胆红素总体降幅高于传统光疗组,且强光疗组趋势线的倾斜角大于传统光疗组,说明强光疗可更迅速且大幅度地降低血总胆红素水平,尤其在开始光疗的前12 h,两组平均每小时胆红素下降水平的差异有统计学意义。另外,强光疗组患儿总光疗时间明显短于传统光疗组患儿,提示强光疗较之传统光疗在治疗高胆红素血症时,尤其在光疗开始初期,可迅速达到降低胆红素水平的目的。由于患儿血中高水平的胆红素可以进入中枢神经系统,引起急性胆红素脑病,若能够及时有效地降低血胆红素水平,就可以使急性胆红素脑病得以逆转,避免慢性胆红素脑病的发生,故此,本研究提示强光疗可更为迅速且有效地降低血胆红素水平,尤其在光疗开始初期(12 h内),这为有效地逆转颅内高胆红素水平,避免胆红素脑病的发生提供了基础,同时也降低了新生儿换血术的几率,从而有效地避免相关的不良反应。
患儿持续光疗24 h后强光疗组患儿总胆红素水平虽然仍持续低于传统光疗组患儿,同时胆红素的降幅亦持续高于传统光疗组,但自开始光疗24 h后,两组平均每小时总胆红素下降趋势线逐渐接近,说明胆红素降幅逐渐减缓,且两组无明显差异,而国外文献报道多提示强光疗治疗后72 h内,患儿血中总胆红素水平持续明显低于传统光疗组(P<0.05)[9],与本研究不尽相同,考虑与采用的光疗模式(如间断或持续等)不同有关。 目前有研究显示,光疗作用于皮肤表层,使胆红素异构化并随胆汁及尿液排出,从而胆红素水平下降,但血清胆红素水平并未明显下降,大约在1~3 h后,血清胆红素会重新分布于皮肤表层,因此持续光疗相比于间断光疗并未有更好的疗效[10],且可能增加不良反应的风险,提示强光疗亦不需要持续光疗。
光疗能够较好地降低血胆红素水平,但同时也存在一些常见副反应,如发热、腹泻、皮疹、 青铜症等,此类短期并发症多在停止光疗后迅速消失。本研究发现,传统光疗组患儿发生腹泻和发热的几率高于强光疗组,而强光疗患儿发生低钙血症和皮疹的几率则高于传统光疗组,但差别均无显著性意义。光疗设备可产生热能,因此常会导致患儿出现发热,而本研究所采用的强光疗为冷光源,不会明显增加患儿热量的接受,同时强光疗组患儿总光疗时间明显短于传统光疗组,因此强光疗组患儿发生发热的几率可能会低于传统光疗组。而光疗所导致的腹泻主要与胆红素分解产物经过肠道排泄时对肠壁的刺激以及抑制肠道乳糖酶等因素有关[11],强光疗组患儿发生腹泻病几率较小,考虑与总光疗时间偏短有关。
光疗对高胆红素血症患儿红细胞及血红蛋白亦会产生影响,主要原因与光疗引起的红细胞膜光敏感氧化性损伤有关。光疗可激活氧自由基,引起患儿体内氧自由基代谢失衡,使活性氧增加,脂质过氧化酶损害,从而导致正常红细胞抗氧化能力下降,发生溶血,同时由于核黄素是光敏感物质,光疗波长与核黄素的光吸收高峰相同,因此光疗在降低胆红素水平的同时,可引起核黄素的分解,从而致体内核黄素缺乏,使红细胞谷胱甘肽还原酶活性降低,也可导致溶血的发生和加剧,使新生儿血红蛋白下降出现贫血[5, 12]。在本研究中,强光疗组患儿光疗后血红蛋白下降幅度与传统光疗组比较差异无统计学意义,提示强光疗对高胆红素血症患儿红细胞及血红蛋白的影响与传统光疗无明显差别。
光疗对血钙的影响相关报道较少,至今结论如何尚有争议,且可能的相关机制尚不明确[13, 14],目前已知的光疗后患儿可能出现低钙血症以及低钙抽搐的原因可能与光源中的紫外线引起患儿皮肤产生较多维生素D,从而导致钙质沉积于骨质,使血中的总钙以及游离钙降低有关[12],另有研究表明,可能与尿钙排出增多以及光疗抑制松果体褪黑素分泌相关[15]。本研究中,强光疗组发生低钙血症几率为4%,传统光疗组则无一例患儿发生低钙血症,且强光疗组患儿光疗后血钙水平低于传统光疗组,但差别均无显著意义,提示在进行强光疗时需要密切监测患儿血钙变化情况,必要时及时补钙治疗。
除以上短期并发症外,近年来人们逐渐开始关注光疗的远期并发症,即光疗的长期潜在危险— DNA 损伤。正常机体细胞在受到外源性理化刺激时可产生DNA 损伤,而这是导致多种疾病的原因之一。其中光辐射是引起遗传物质发生突变的重要因素。目前国外的相关体外实验研究已证实,光疗可导致染色体断裂、微粒增加、姐妹染色体损伤等。然而近年来对于光疗导致DNA 损伤的少数体内实验研究结果却存在争议,虽然有研究认为光疗并不会增加DNA 损伤[16],但国内外现有报道多倾向于认为光疗可能引起新生儿外周血淋巴细胞DNA 损伤,且DNA 的损伤可能随着光疗时间的延长,累积量的增加而明显增加[17, 18]。本研究中,使用强光疗可以更迅速地降低患儿的血胆红素水平,缩短总光疗时间,有可能从时间阈值上减少光疗对DNA 的损伤,但由于强光疗的光强度较高,因此与低光强度而总光疗时间较长的传统光疗相比,是否对DNA 损伤有不同的影响,或者是否有相关的光强度剂量与时间的警界阈值,还需要进一步研究证实。同时由于强光疗仅在光疗开始初期对患儿血胆红素水平的下降有明显作用,而后期二者的区别并无统计学意义,因此是否有可能探寻二者结合治疗新生儿高胆红素血症的模式,以降低可能的DNA 损伤发生几率,亦需要进一步的研究。
综上所述,强光疗可在开始光疗初期迅速有效地降低高胆红素患儿体内胆红素水平,避免胆红素脑病等严重并发症的发生,降低新生儿换血术的几率,缩短总光疗时间,同时与传统光疗相比,并未增加相关副反应的发生几率,因此对于亚裔新生儿高胆红素血症患儿是一种优于传统光疗的良好的治疗措施,在进行强光疗治疗时需注意监测患儿血钙水平等,并及时对症治疗。
| [1] | Bhutani VK, Stark AR, Lazzeroni LC, et al. Predischarge screening for severe neonatal hyperbilirubinemia identifies infants who need phototherapy [J]. J Pediatr, 2013, 162(3): 477-482. |
| [2] | Slusher TM, Zipursky A, Bhutani VK. A global need for affordable neonatal jaundice technologies[J]. Semin Perinatol, 2011, 35(3): 185-191. |
| [3] | Hameed NN, Na'Ma AM, Vilms R, et al. Severe neonatal hyperbilirubinemia and adverse short-term consequences in Baghdad, Iraq [J]. Neonatology, 2011, 100(1): 57-63. |
| [4] | Amer ican Academy of Pediatr ics Subcommittee on Hyperbilirubinemia. Management of hyperbilirubinemia in the newborn infant 35 or more weeks of gestation [J]. Pediatrics, 2004, 114(1): 297-316. |
| [5] | Kale Y, Aydemir O, Celik Ü, et al. Effects of phototherapy using different light sources on oxidant and antioxidant status of neonates with jaundice[J]. Early Hum Dev, 2013, 89(12): 957-960. |
| [6] | Gamaleldin R, Iskander I, Seoud I, et al. Risk factors for neurotoxicity in newborns with severe neonatal hyperbilirubinemia[J]. Pediatrics, 2011, 128 (4): e925-e931. |
| [7] | Mwaniki MK, Atieno M, Lawn JE, et al. Long-term neurodevelopmental outcomes after intrauterine and neonatal insults: a systematic review [J]. Lancet, 2012, 379(9814): 445-452. |
| [8] | Wallenstein MB, Bbutani VK. Jaundice and kernicterus in the moderately preterm infant [J]. Clin Perinatal, 2013, 40(4): 679-688. |
| [9] | Tatli MM, Minnet C, Kocyigit A, et al. Phototherapy increase DNA damage in lymphocytes of hyperbilirubinemic neonates[J]. Mutat Res, 2008, 654(1): 93-95. |
| [10] | 黄武珍, 黄翰武, 吴曙粤. 间歇光疗和持续光疗治疗新生儿高胆红素血症的meta 分析[J]. 实用医学杂志, 2015, 31(8): 1310-1313. |
| [11] | Kumar P, Murki S, Malik GK, et al. Light emitting diodes versus compact fluorescent tubes for phototherapy in neonatal jaundice: a multi-center randomized controlled trial[J]. Indian Pediatr, 2010, 47(2): 131-137. |
| [12] | 舒桂华, 徐翔, 严洁, 等. 蓝光照射治疗极低出生体重儿高胆红素血症疗效评价[J/CD]. 中华临床医师杂志(电子版), 2014, 8(17): 3190-3192. |
| [13] | 熊涛, 唐军, 母得志. 新生儿高胆红素血症光疗的副作用[J]. 中国当代儿科杂志, 2012, 14(5): 396-400. |
| [14] | 魏淑丽, 黄雪玲. 新生儿黄疸蓝光照射治疗时血钙的变化[J]. 福建医药杂志, 201l, 33(3): 79-80. |
| [15] | Hooman N, Honarpisheh A. The effect of phototherapy on urinary calcium excretion in newborns[J]. Pediatr Nephrol, 2005, 20(9): 1363-1364. |
| [16] | Gómez-Meda BC, Barros-Hernández A, Guzmán-Bárcenas J, et al. Effects of blue light phototherapy on DNA integrity in preterm newborns[J]. J Photochem Photobiol B, 2014, 141: 283-287. |
| [17] | Ramy N, Ghany EA, Alsharany W, et al. Jaundice, phototherapy and DNA damage in full-term neonates[J]. J Perinatol, 2016, 36(2): 132-136. |
| [18] | Kahveci H, Dogan H, Karaman A, et al. Phototherapy causes a transient DNA damage in jaundiced newborns[J]. Drug Chem Toxicol, 2013, 36(1): 88-92. |
 2016, Vol. 18
2016, Vol. 18

 , 刘捷
, 刘捷