随着围生医学的快速发展及医疗水平的不断提高,早产儿的存活率明显提高。由于肺泡发育不全、呼吸中枢发育不成熟、肺部发育不完善、胸廓及呼吸肌无力、免疫力低下等因素,呼吸系统疾病已成为早产儿最常见的疾病之一。因其住院时间长,花费高,给家庭、社会带来巨大的经济及心理负担,近年来引起社会高度关注。肺功能检查不仅可以鉴别呼吸系统疾病的性质、判断疾病的严重程度,同时可以协助呼吸机参数的选择、评估治疗效果、指导治疗及判断疾病预后。早产儿肺功能检查是鉴定呼吸系统成熟[1]、揭示其生长发育规律及研究呼吸系统疾病的重要手段[2]。常规的肺功能测定需要患者的积极配合,这限制了其在儿童及新生儿中的应用。而潮气呼吸肺功能检查仅需平静呼吸,操作简单,可床旁检测,因此适用于新生儿,已在临床得到逐渐广泛的应用。
呼吸暂停(apnea)是指在一段时间内无呼吸运动,主要临床症状包括:呼吸停止(时间>20 s)、心率减慢(<100次/min)或出现青紫、血氧饱和度降低(<85%)和肌张力低下。呼吸暂停的发生率与胎龄及出生体重密切相关,是新生儿尤其是早产儿的常见症状,胎龄越小,发生率越高,体重<1 000 g 者其发生率达80%[3]。早产儿呼吸暂停(apnea of prematurity,AOP)可导致低氧血症、心动过缓,增加脑室内出血、脑积水和神经系统发育异常的危险性[4],甚至危及生命。甲基黄嘌呤类药物是AOP 治疗的主要药物,咖啡因和氨茶碱均属于黄嘌呤类药物。由于咖啡因具有血药浓度易于估计、易透过血脑屏障、起效快、半衰期长、生物利用度高、不良反应小等优点,因此是AOP 治疗的首选药物。同时,研究表明枸橼酸咖啡因能明显降低极低出生体重儿支气管肺发育不良和视网膜病的发生率,降低有创机械通气时间、呼吸暂停及低氧血症的发生,同时还可以促进神经系统发育[5, 6, 7]。咖啡因在国外已有40多年的使用历史,在国内,氨茶碱是治疗AOP 的主要药物,近年枸橼酸咖啡因已开始由国外引进,且在国内得到逐渐广泛使用。关于其使用后对肺功能的影响目前仍不明确。本研究以氨茶碱治疗作为对照,探讨咖啡因治疗AOP 对患儿肺功能的影响,现报道如下。
1 资料与方法1.1 研究对象2014年5月至2015年5月我院儿科住院治疗的出生胎龄<34周的原发性呼吸暂停早产儿40例为研究对象。其中男23例,女17例;胎龄31.1±1.9周(范围27~33+1 周);出生体重1 646±375 g(范围800~2 400 g)。患儿出生后即刻从我院产科转入新生儿病房进一步治疗。
纳入标准:明确诊断为原发性呼吸暂停的早产儿。表现为呼吸停止>20 s,伴有心率减慢(<100次/ 分)或出现青紫、血氧饱和度降低和肌张力低下[8]。
排除标准:(1)围生期存在重度窒息病史、神经系统疾病及功能紊乱;(2)严重呼吸窘迫综合征等呼吸系统疾病及神经肌肉疾病;(3)败血症等感染性疾病;(4)颅内出血;(5)先天性心脏病;(6)消化系统疾病及电解质紊乱;(7)遗传代谢性疾病;(8)放弃治疗者、评估时间之前死亡者、药物治疗疗程不满者;(9)其他原因引起的继发性呼吸暂停[9]。有以上之一情况予以排除。
本研究获得患儿家长知情同意,并签署药物使用知情同意书。
1.2 分组及治疗40例AOP 患儿按随机数字法分为咖啡因组和氨茶碱组,每组各20例。两组患儿在出现原发性呼吸暂停临床表现时均给予经鼻持续气道正压通气(NCPAP)治疗,PEEP 设定为4~6 cm H2O,流量设定为4~6 L/min,根据血氧饱和度调整氧浓度,氧浓度控制在40% 以下,经皮血氧饱和度维持在90%~94%。患儿出现原发性呼吸暂停当天给予NCPAP 辅助通气并记录呼吸暂停的发生次数,在NCPAP 辅助通气及常规治疗基础上于呼吸暂停发生后24 h给予氨茶碱或枸橼酸咖啡因治疗。氨茶碱组给予氨茶碱首剂负荷量5.0 mg/kg,30 min静脉泵入,12 h后给予维持量2.5 mg/kg,每12 h1次,静脉泵入。咖啡因组给予枸橼酸咖啡因首剂负荷量20.0 mg/kg,30 min 静脉泵入,24 h后给予维持量5~10 mg/kg(维持量给予5 mg/kg 时若呼吸暂停仍频繁发作,则剂量调整为10 mg/kg[6]),每24 h 1次,静脉泵入。当患儿呼吸暂停消失后7 d停用氨茶碱或咖啡因,最长使用至纠正胎龄34周停药[7]。
所有患儿均于入院时行血培养、连续C- 反应蛋白监测,出生3 d 后行头颅MRI 检查,结合母亲资料了解产前感染因素及患儿临床表现等,综合分析排除败血症、颅内出血性疾病等继发性呼吸暂停;观察并记录药物不良反应。
1.3 肺功能检测两组患儿均于停药后行潮气呼吸肺功能检测。潮气呼吸肺功能检测由固定人员操作,操作者不参与早产儿的管理及治疗,对早产儿产前、产时及产后等情况均不知。采用MS-Diffussion 型肺功能仪进行测定。受试者于奶后1 h、平静睡眠时进行肺功能检测,取仰卧位、手足自然伸展、头中间位、颈部无支撑物、呼吸道通畅体位。扣紧面罩于鼻上,然后测定其潮气呼吸肺功能的参数。
1.4 监测指标两组早产儿均在住院过程中给予心电监护,记录呼吸暂停的发生时间、持续时间及出现呼吸暂停临床表现时经皮血氧饱和度及心率、肌张力、面色等变化情况。统计药物使用后7 d 患儿呼吸暂停发生频率及住院过程中用氧持续时间。两组患儿均于停药后行肺功能检查,记录以下肺功能参数:潮气量、每分通气量、吸气时间、呼气时间、达峰时间、达峰时间比(达到呼气峰流速的时间与呼气时间之比)、达峰容积、达峰容积比(达到呼吸峰流速的容积与呼气容积之比)、潮气呼吸呼气峰流速及75%、50%、25% 潮气量时呼气流速。每人连续测试2次,每次记录20次潮气呼吸,由电脑自动取平均值,同时描绘出流速- 容量环。
1.5 统计学分析采用SPSS 17.0统计软件对数据进行统计学分析,正态分布的计量资料以均数± 标准差(x±s)表示,两组间比较采用两独立样本t 检验,P<0.05为差异有统计学意义。
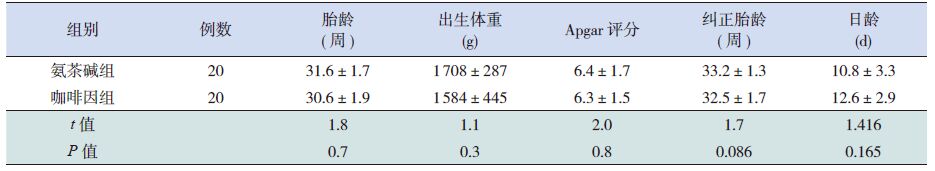
2 结果2.1 两组一般资料的比较两组早产儿出生胎龄、出生体重、5 minApgar 评分及肺功能检测时纠正胎龄及日龄差异均无统计学意义(P>0.05),见表 1。
|
|
表 1 两组患儿一般资料的比较 (x±s) |
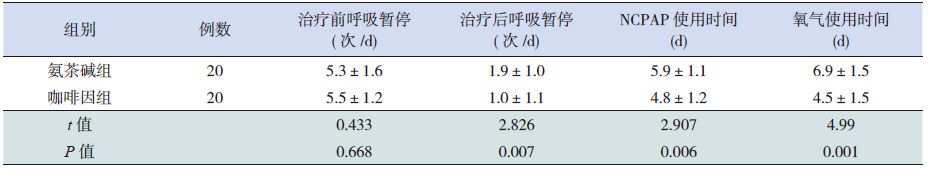
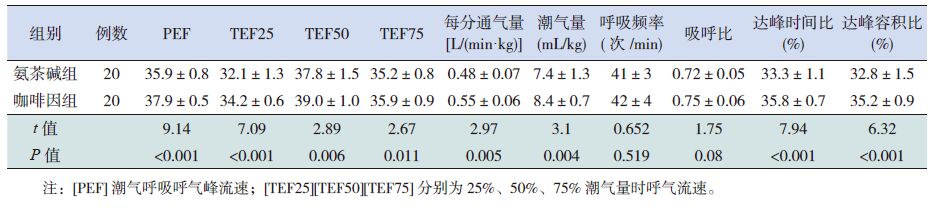
药物使用前呼吸暂停的发生频率在两组之间差异无统计学意义(P=0.668)。药物使用后7 d,两组呼吸暂停频率均减少,但咖啡因组呼吸暂停频率明显低于氨茶碱治疗组,差异有统计学意义(P=0.007)。咖啡因组每分通气量、潮气量明显增高,同时达峰时间比、达峰容积比、潮气呼吸呼气峰流速及75%、50%、25% 潮气量时呼气流速均明显高于氨茶碱组,差异有统计学意义(P<0.01)。同时,咖啡因组用氧时间少于氨茶碱组(P<0.001);咖啡因组NCPAP 使用时间较氨茶碱组短(P=0.006)。见表 2 和表 3。在治疗过程中,两组均未发现与用药相关的明显不良反应。
|
|
表 2 两组呼吸暂停发生频率、NCPAP 使用时间及用氧时间的比较 (x±s) |
|
|
表 3 两组治疗后早期肺功能参数的比较 (x±s) |
潮气呼吸肺功能的测定是评价肺脏功能的重要手段,可广泛应用于新生儿呼吸系统疾病性质及疾病程度判断,协助评估药物疗效、病情监控及疾病预测。咖啡因属于甲基黄嘌呤类药物,通过刺激延髓呼吸中枢、阻断腺苷受体、改善呼吸肌功能、增加化学感受器对CO2的敏感性、加快呼吸频率、增加每分通气量、增强膈肌收缩力、改善氧合,从而减少呼吸暂停发生次数,减少缺氧发作[10]。本研究采用枸橼酸咖啡因治疗AOP,并以氨茶碱治疗作为对照,以了解两种药物对肺功能的影响,结果显示,咖啡因组潮气量、每分通气量均明显高于氨茶碱组,其原因可能是咖啡因呼吸兴奋作用更强,在刺激呼吸中枢、阻断腺苷受体、改善呼吸肌功能、利尿、减少肺部液体渗出的同时促进气体交换作用及提高肺的顺应性,从而提高潮气量与每分通气量。本研究还显示,咖啡因组25%、50%、75% 潮气量时呼吸流速均高于氨茶碱组,提示反映肺泡弹性回缩力指标中,咖啡因组较氨茶碱组好,考虑也与咖啡因增强呼吸肌作用及提高肺顺应性有关。
达峰时间比是达到呼气峰流速的时间与呼气时间的比值,是反映气道阻塞的主要指标,在阻塞性疾病其比值下降,其值越低则阻塞越重;达峰容积比是达到呼气蜂流速的容积与呼气容积的比值,同样可用来反映气道阻塞的情况。达峰容积比与达峰时间比可较准确地判断气道可逆性。本研究表明,咖啡因治疗组达峰时间比及达峰容积比均高于氨茶碱组,提示咖啡因治疗可以减少气道阻塞,使呼吸更顺畅。
Kraaijenga 等[11] 对早产儿进行经皮膈肌肌电图研究表明,咖啡因不仅能快速、持续增加膈肌活动,同时对潮气量及呼气末肺容量有一定影响。氨茶碱和咖啡因作用机制相似,但咖啡因呼吸兴奋作用更强,不良反应更少,有效血药浓度范围更广,半衰期长,用药次数少,因此在国外已取代了氨茶碱[12]。Erenberg 等[13] 进行的多中心随机双盲对照试验,纳入9个NICU,85例胎龄28~32周且发生呼吸暂停的早产儿。在咖啡因使用的第3天,呼吸暂停的发生率即明显降低,第6天呼吸暂停发生次数减少50% 以上。本研究表明,治疗前2组早产儿AOP 发生频次无明显差异,且2种治疗方式均可降低呼吸暂停的发生,但咖啡因组降低更明显,差异有统计学意义。
支气管肺发育不良同样是早产儿呼吸系统常见疾病,具有独特的临床、影像学及组织学特征,新生儿期用氧时间长,病死率高,存活者常存在气道高反应性疾病、气道阻塞、反复呼吸道感染及生长发育落后等。迈阿密大学[5]、早产儿支气管肺发育不良调查协作组[14] 及Laughon 等[15] 的研究均表明咖啡因可降低早产儿呼吸机使用时间,进而减少支气管肺发育不良的发生。本研究显示,咖啡因组用氧时间明显短于氨茶碱组,NCPAP 使用时间亦明显短于氨茶碱组,与上述文献[5, 14, 15] 报道咖啡因可降低早产儿呼吸机使用时间一致。
机械通气中的早产儿接受咖啡因治疗后气道阻力降低,肺的顺应性提高,吸入氧浓度降低[16]。但其治疗有不良反应[13],短期内不良反应,如注射部位局部反应、喂养不耐受、便秘、胃食管反流、肠胀气、贫血、低钠血症及皮疹等与对照组比较差异无统计学意义。然而,Marcus 等[17] 和Poets等[18] 长期随访结果表明,咖啡因治疗AOP 不仅影响学龄期儿童的睡眠质量,同时可能增加其打鼾的发生。本研究发现枸橼酸咖啡因使用后,没有出现明显的腹胀、呕吐、喂养不耐受、电解质紊乱等不良反应,需要在后续研究中行长期随访,以了解其对患儿神经发育、生长发育及睡眠的影响。
由于早产儿肺液吸收延迟,刚出生的新生儿,尤其是早产儿常存在不同程度的呼吸性及代谢性酸中毒,为避免这些因素的影响,本研究肺功能的检测在药物治疗疗程完成后进行,并选择在患儿安静睡眠时进行,以减少哭闹对检测结果的影响。
总之,咖啡因治疗AOP 是安全、有效的,其改善肺功能的疗效优于氨茶碱。潮气呼吸肺功能检测无创、操作简单、可床边操作,因此适用于评估早产儿肺功能状态。但本研究样本量较小,尚需扩大样本量进一步证实本研究结果,同时需进一步行长期肺功能检测随访及评估呼吸系统相关疾病的发生,从而探索枸橼酸咖啡因治疗AOP对肺功能的远期影响。
| [1] | Hjalmarson O, Sandberg K. Abnormal lung function in healthy preterm infants[J]. Am J Respir Crit Care Med, 2002, 165(1): 83-87. |
| [2] | Mello RR, Silva KS, Costa AM, et al. Longitudinal assessment of the lung mechanics of very low birth weight preterm infants with and without bronchopulmonary dysplasia[J]. Sao Paulo Med J, 2015, 133(5): 401-407. |
| [3] | Francart SJ, Allen MK, Stegall-Zanation J. Apnea of prematurity: caffeine dose optimization[J]. Pediatr Pharmacol Ther, 2013, 18(1): 45-52. |
| [4] | Butcher-Puech MC, Henderson-Smart DJ, Holley D, et al. Relation between apnoea duration and type and neurological status of preterm infants[J]. Arch Dis Child, 1985, 60(10): 953-958. |
| [5] | ClinicalTrials.gov. Caffeine to reduce mechanical ventilation in preterm infants[DB/OL]. [February 3, 2014]. http://clinicaltrials. gov/show/NCT01751724. |
| [6] | Schmidt B, Roberts RS, Davis P, et al. Long-term effects of caffeine therapy for apnea of prematurity[J]. N Engl J Med, 2007, 357(19): 1893-1902. |
| [7] | Schmidt B, Anderson PJ, Doyle LW. Survival without disability to age 5 years after neonatal caffeine therapy for apnea of prematurity[J]. JAMA, 2012, 307(3): 275-282. |
| [8] | 陈超. 早产儿呼吸暂停的防治[J]. 小儿急救医学, 2003, 10(4): 204-206. |
| [9] | 叶鸿瑁. 常见症状和鉴别诊断[M]//邵肖梅, 叶鸿瑁, 丘小汕, 等. 实用新生儿学. 第4版. 北京: 人民卫生出版社, 2012: 245-247. |
| [10] | Aranda JV, Beharry K, Valencia GB, et al. Caffeine impact on neonatal morbidities [J]. J Matern Fetal Neonatal Med, 2010, 23(Suppl 3): 20-33. |
| [11] | Kraaijenga JV, Hutten GJ, de Jongh FH, et al. The effect of Caffeine on diaphrabmatic activity and tidal volume in preterm infants [J]. J Pediatr, 2015, 167(1): 70-75. |
| [12] | Vatlach S, Arand J, Engel C, et a1. Safety profile comparison between extemporaneous and a licensed preparation of caffeine citrate in preterm infants with apnea of prematurity[J]. Neonatology, 2013, 105(2): 108-111. |
| [13] | Erenberg A1, Leff RD, Haack DG, et al. Caffeine citrate for the treatment of apnea of prematurity: a double-blind, placebocontrolled study[J]. Pharmacotherapy, 2000, 20(6): 644-652. |
| [14] | 早产儿支气管肺发育不良调查协作组. 早产儿支气管肺发育不良发生率及高危因素的多中心回顾调查分析[J]. 中华儿科杂志, 2011, 49(9): 655-662. |
| [15] | Laughon MM, Langer JC, Bose CL, et al. Prediction of bronchopulmonary dysplasia by postnatal age in extremely premature infants[J]. Am J Respir Crit Care Med, 2011, 183(12): 1715-1722. |
| [16] | Davis JM1, Bhutani VK, Stefano JL, et al. Changes in pulmonary mechanics following caffeine administration in infants with bronchopulmonary dysplasia [J]. Pediatr Pulmonol, 1989, 6(1): 49-52. |
| [17] | Marcus CL, Meltzer LJ, Roberts RS, et al. Long-term effects of caffeine therapy for apnea of prematurity on sleep at school age[ J]. Am J Respir Crit Care Med, 2014, 190(7): 791-799. |
| [18] | Poets CF, Khan SR. Former preterm infants, caffeine was good for you, but now beware of snoring![M]. Am J Respir Crit Care Med, 2014, 190(7): 720-721. |
 2016, Vol. 18
2016, Vol. 18