川崎病(Kawasaki disease,KD) 是一种自身免疫性疾病,已经成为儿童后天性心脏疾病的主要原因[1]。目前多认为KD 是一种自限性疾病,但也可能出现冠状动脉扩张以及冠状动脉瘤等不良后果[2, 3]。同时在临床工作中发现部分KD 患儿即便在早期给予静脉丙种球蛋白(intravenousimmunoglobulin,IVIG)治疗,仍出现了冠状动脉损伤(coronary artery lesion,CAL),故早期发现CAL是KD 诊治的重点。另外部分患儿初始IVIG 治疗无反应,其原因尚不明确。研究发现,维生素D(vitamin,VitD)可以起到调节免疫功能、抑制炎症反应的作用,与自身免疫性疾病密切相关[4],并且在心血管系统疾病的发病机制中起着重要作用[5]。目前有关KD 患儿25- 羟基维生素D3 [25-(OH)D3]水平改变的相关报道较少[6],且尚无VitD 与KD患儿IVIG 治疗反应是否相关的报道。为了解KD患儿的VitD 水平及其与CAL 和IVIG 治疗无反应是否相关联,本研究检测了我院242例KD 患儿的25-(OH)D3 水平,报道如下。
1 资料与方法1.1 研究对象选择2012年1月至2015年8月于保定市儿童医院住院治疗的242例KD 患儿为研究对象,其中男138例、女104例,年龄10个月至6岁2个月,平均3.3±1.7岁。242例患儿入院时均处于病程的7 d 以内,入院前均未给予IVIG、肾上腺皮质激素及阿司匹林治疗。按照有无CAL 分为CAL 组(63例)和非冠状动脉损伤组(non-CAL,NCAL):179例。CAL 组中男39例、女24例,年龄1岁1个月至5岁10个月,平均年龄3.2±1.5岁;NCAL 组中男99例、女80例,年龄10个月至6岁2个月,平均3.4±1.7岁。
另按照IVIG 治疗效果分为IVIG 敏感组和IVIG 无反应组。IVIG 敏感组219例,患儿均在入院后给予首次IVIG,36 h内体温恢复正常并未再复升,其中男121例、女98例,年龄10个月至6岁2个月,平均年龄3.3±1.7岁;IVIG 无反应组23例,首次IVIG 治疗后无反应,其中男17例、女6例,年龄1岁1个月至5岁6个月,平均年龄3.2±1.6岁。
选择同期健康体检儿童40例为对照组,其中男22例、女18例,年龄1岁至6岁3个月,平均年龄3.3±1.4岁。另外选择同期诊断为急性上呼吸道感染的患儿40例为上感组,男23例、女17例,年龄1岁至6岁8个月,平均年龄3.4±1.6岁。4组儿童年龄、性别构成上的差异均无统计学意义(P>0.05)。
本研究中所有研究对象在近半年内均未使用过维生素D 及激素,均除外合并其他疾病且近半月内无感染性疾病病史。
本研究获得医院医学伦理委员会批准及家属书面知情同意。
1.2 诊断标准KD 诊断标准[7]:发热在5 d 以上,以下5项临床表现中至少符合4项者,并除外其他疾病:(1) 双侧球结合膜充血;(2) 多形性皮疹;(3)颈部淋巴结肿大;(4)口唇充血、皲裂,口腔黏膜弥漫性充血,草莓舌;(5)急性期掌跖红斑,手足硬性水肿;恢复期指趾末端膜状脱皮。发热在5 d 以上,临床表现不足4项者,心脏彩超出现CAL 改变,诊断为不完全性KD。
CAL 判断标准[7]:(1)冠状动脉内膜回声增强,(2)冠状动脉扩张标准:≤ 3岁,冠脉内径≥ 2.5 mm;3岁~,≥ 3.0 mm;9~14岁,≥ 3.5 mm。
无反应型KD 的判断标准[8]:首次IVIG 治疗后36 h仍发热(体温≥ 38℃),或者应用IVIG治疗2~7 d 后KD 临床症状再现(发热及至少1项其他临床表现),除外继发感染。
1.3 标本采集KD 患儿入院后( 发病后5~7 d),在予以IVIG 和阿司匹林治疗前、以及IVIG 治疗后的恢复期分别采集空腹静脉血2 mL。健康儿童及急性上呼吸道感染儿童留取清晨空腹静脉血2 mL,离心后放置于-70℃冰箱中保存备用。
1.4 血清25-(OH)D3 水平的检测采用酶联免疫法,由专人按试剂盒说明书进行检测。试剂盒购自北京博晖创新光电技术股份有限公司。
1.5 统计学分析采用SPSS 17.0统计软件进行统计分析,计量资料用均数± 标准差(x±s)表示,组间比较采用方差分析。P<0.05为差异有统计学意义。
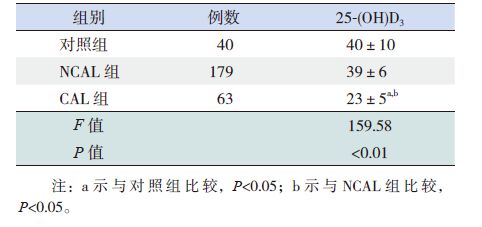
2 结果2.1 IVIG 治疗前各组25-(OH)D3 水平比较治疗前,上感组、NCAL 组及CAL 组患儿25-(OH)D3 水平均低于对照组,差异有统计学意义(P<0.05);CAL 组患儿25-(OH)D3 水平低于上感组和NCAL 组,差异有统计学意义(P<0.05);NCAL 组患儿25-(OH)D3 水平与上感组相比较,差异无统计学意义(P>0.05)。见表 1。
|
|
表 1 治疗前各组25-(OH)D3 水平分析 (x±s,μg/L) |
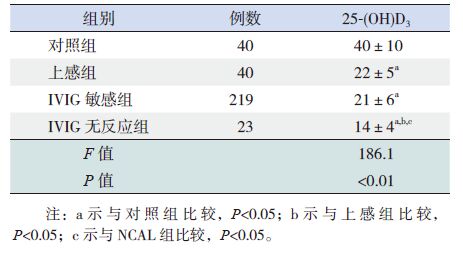
治疗前,上感组、IVIG 敏感组及IVIG 无反应组患儿25-(OH)D3 水平均低于对照组,差异有统计学意义(P<0.05);IVIG 无反应组患儿25-(OH)D3水平均低于上感组及IVIG 敏感组,差异有统计学意义(P<0.05); 但是IVIG 敏感组25-(OH)D3 水平与上感组比较无统计学意义(P=0.31)。见表 2。
|
|
表 2 治疗前各组25-(OH) D3 水平分析 (x±s,μg/L) |
IVIG 治疗后,CAL 组25-(OH)D3 水平低于NCAL 组及对照组,差异有统计学意义(P<0.05);而NCAL 组与对照组比较,差异无统计学意义(P>0.05)。见表 3。
|
|
表 3 治疗后各组25-(OH)D3 水平分析 (x±s,μg/L) |
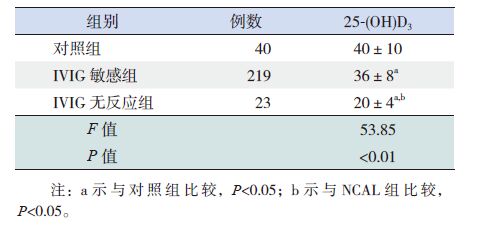
IVIG 治疗后,IVIG 无反应组25-(OH)D3 水平低于IVIG 敏感组及对照组,差异有统计学意义(P<0.05);IVIG 敏感组25-(OH)D3 水平低于对照组,差异有统计学意义(P<0.05)。见表 4。
|
|
表 4 治疗后各组25-(OH)D3 水平分析 (x±s,μg/L) |
维生素D 是重要的类固醇激素,参与了人体内多种病理生理过程,其水平的改变与多个系统的疾病相关。目前多数临床资料认为VitD 缺乏会增加心血管疾病的发病率[9],VitD 缺乏也与儿童风湿性疾病密切相关[10]。本研究显示,在IVIG治疗前,KD 和上感患儿的25-(OH)D3 水平均低于健康儿童,合并CAL 者25-(OH)D3 水平明显低于NCAL 患儿和急性上感患儿。提示25-(OH)D3 水平下降并非KD 的特异性改变,但对于KD 患儿,25-(OH)D3 水平下降越明显,则出现CAL 的可能性越大。
VitD 缺乏与多数慢性炎症有关[10]。目前认为KD 患儿在很长时间内存在血管慢性炎症[11]。本研究显示,在IVIG 治疗后,CAL 组的25-(OH)D3 水平仍低于对照组和NCAL 组。IVIG 治疗前后KD患儿持续的低25-(OH)D3 水平可能与较长时间的血管慢性炎症有关,甚至部分KD 患儿在IVIG 治疗后仍可能出现CAL。本研究还发现,IVIG 无反应的KD 患儿25-(OH)D3 水平在IVIG 治疗前后均明显低于IVIG 敏感组及健康儿童。提示25-(OH)D3水平下降越明显,出现IVIG 治疗无反应的可能性越大。
目前认为KD 患儿出现CAL 与炎症反应以及血管内皮功能障碍有关。VitD 可以通过对T、B 细胞、巨噬细胞、树突状细胞的调节起到减少TNF-α、IL-6和IL-1β 分泌的作用[12, 13, 14]。而VitD 缺乏可能导致血管内皮功能障碍[15]。因此,KD 急性期的血清VitD 水平下降可以使其抑炎作用明显下降,炎性因子大量产生,出现明显的炎症反应;同时由于血清VitD 水平的下降导致血管内皮功能障碍,因而出现冠状动脉损伤。
因此,研究川崎病患儿血清25-(OH)D3 水平的变化对于预测川崎病是否合并CAL 及静脉丙球治疗反应有一定临床意义。而予以补充维生素D 是否可能改善川崎病患儿血管内皮功能[16]、减轻炎症反应[17]、因而降低CAL 发生以及静脉丙球治疗无反应的几率,尚需要大量的临床研究来证明。
| [1] | Matsunaga A, Harita Y, Shibagaki Y, et al. Identification of 4-trimethylaminobutyraldehyde dehydrogenase (TMABADH) as a candidate serum autoantibody target for Kawasaki Disease[J]. PLoS One, 2015, 10(5): e0128189. |
| [2] | Alhammadi AH, Hendaus MA. Comorbidity of Kawasaki disease and group A streptococcal pleural effusion in a healthy child: a case report[J]. Int J Gen Med, 2013, 6: 613-616. |
| [3] | Bal AK, Prasad D, Pamintuan MAU, et al. Timing of intravenous immunoglobulin treatment and risk of coronary artery abnormalities in children with Kawasaki disease[J]. Pediatr Neonatol, 2014, 55(5): 387-392. |
| [4] | Jeffery LE, Qureshi OS, Gardner D, et al.Vitamin D antagonises the suppressive effect of inflammatory cytokines on CTLA-4 expression and regulatory function[J]. PLoS One, 2015, 10(7): e0131539. |
| [5] | Mozos I, Marginean O. Links between Vitamin D deficiency and cardiovascular diseases[J]. Biomed Res Int, 2015, 2015: 109275. |
| [6] | Stagi S, Rigante D, Lepri G, et al. Severe vitamin D deficiency in patients with Kawasaki disease: a potential role in the risk to develop heart vascular abnormalities[J]. Clin Rheumatol, 2015: 1-8. |
| [7] | Newburger JW, Takahashi M, Gerber MH, et al. Diagnosis, treatment, and long-term management of Kawasaki disease:a statement for health professionals from the Committee on Rheumatic Fever, Endocarditis and Kawasaki Disease, Council on Cardiovascular Disease in the Young, American Heart Association[J]. Pediatrics, 2004, 114(6): 1708-1733. |
| [8] | 《中华儿科杂志》编辑委员会, 中华医学会儿科学分会心血管学组, 中华医学会儿科学分会免疫学组. 川崎病专题讨论会纪要[J]. 中华儿科杂志, 2007, 45(11): 826-830. |
| [9] | 王新凤, 邓秀玲, 汪南平. 维生素D 在心血管疾病中的作用[J]. 生理科学进展, 2013, 44(3): 223-226. |
| [10] | Vojinovic J, Cimaz R.Vitamin D-update for the pediatric rheumatologists[J]. Pediatr Rheumatol Online J, 2015, 13: 18. |
| [11] | Nakamura Y. Epidemiology of Kawasaki disease[J].Nihon Rinsho, 2014, 72(9): 1536-1541. |
| [12] | Liefaard MC, Ligthart S, Vitezova A, et al.Vitamin D and c-reactive protein: a mendelian randomization study[J]. PLoS One, 2015, 10(7): e0131740. |
| [13] | Sommer A, Fabri M.Vitamin D regulates cytokine patterns secreted by dendritic cells to promote differentiation of IL-22-producing T Cells[J]. PLoS One, 2015, 10(6): e0130395. |
| [14] | Hashemi SM, Mokhtari SM, Sadeqhi M, et al. Effect of vitamin D therapy on endothelial function in ischemic heart disease female patients with vitamin D deficiency or insufficiency: a primary report[J]. ARYA Atheroscler, 2015, 11(1): 54-59. |
| [15] | 高卫卫, 李培, 施毅. 维生素D 对免疫系统的调节作用[J]. 中华哮喘杂志(电子版), 2013, 7(4): 43-46. |
| [16] | Alyami A, Soares MJ, Sherriff JL, et al. A systematic review protocol examining the effect of vitamin D supplementation on endothelial function[J]. BMJ Open, 2015, 5(6): e006835. |
| [17] | Kudo K, Hasegawa S, Suzuki Y, et al. 1α,25-Dihydroxyvitamin D(3) inhibits vascular cellular adhesion molecule-1 expression and interleukin-8 production in human coronary arterial endothelial cells[J]. J Steroid Biochem Mol Biol, 2012, 132(s 3-5): 290-294. |
 2016, Vol. 18
2016, Vol. 18