2. 首都儿科研究所临床中心实验室, 北京 100020
维生素D 在体内有着广泛的生物学效应,除参与机体钙磷代谢,影响骨骼发育外,与心血管系统疾病、糖尿病、皮肤病等均有密切关系。近年来维生素D 与免疫系统的关系引起广泛关注,维生素D 在抗感染、抑制炎症反应方面发挥着重要作用,不足或缺乏可致细胞、体液免疫功能下降[1],危重症患儿维生素D 缺乏普遍存在[2],有研究提示维生素D 缺乏与脓毒症患者的病死率密切相关,改善脓毒症患儿维生素D 营养状态有可能改善脓毒症患儿的预后[3]。血流感染患儿病情危重,病死率高,本研究观察血流感染患儿及正常儿童维生素D 水平,并对其维生素D 营养状态进行评价。
1 资料与方法1.1 研究对象与分组采用病例对照研究方法,选取2010年1月至2013年12月于我院儿童重症监护病房住院治疗且血培养呈阳性的60例感染患儿为血流感染组,其中男25例,女35例,年龄2~5岁;以重症肺炎入院者54例,脓毒性休克入院者6例;32例病程中给予机械通气;小儿危重症评分均<90分,其中<80分48例;死亡2例。血流感染组纳入标准:同时在不同部位采集血标本培养,2份均培养出同一种细菌,且患儿均有发热或低体温伴白细胞、C 反应蛋白、血清降钙素原三者之一明显升高。另随机选取60例同时期同年龄段同性别于保健门诊行健康体检的儿童作为健康对照组。该研究已获得所有入组儿童家长知情同意。
1.2 实验方法两组患儿均空腹抽取静脉血2 mL(血流感染组在血培养阳性报告次日晨空腹取血),室温下放置30 min,1 500 r/min 离心10 min,取血清置于-70℃冰箱保存。血清25(OH)D 水平是维生素D营养状况最常用的评价指标[2],本研究采用化学发光法测定两组儿童血清25(OH)D 水平(试剂盒购自索灵诊断医疗设备上海有限公司),维生素D评价标准[2, 3]:血清25(OH)D ≥ 30 μg/L 为正常,20 μg/L~ 为不足,10 μg/L~ 为缺乏,<10 μg/L 为严重缺乏。
1.3 统计学分析应用SPSS 19.0统计软件对数据进行统计学分析,正态分布计量资料采用均数± 标准差(x±s)表示,两组间比较采用t 检验;计数资料采用百分率(%)表示,两组间比较采用卡方检验。P<0.05为差异有统计学意义。
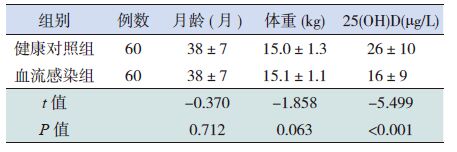
2 结果2.1 两组儿童基本资料及血清25(OH)D 水平两组儿童月龄、体重差异均无统计学意义(P>0.05),血流感染组血清25(OH)D 水平明显低于健康对照组(P<0.05),见表 1。
|
|
表 1 两组儿童基本资料及血清25(OH)D 水平比较 (x±s) |
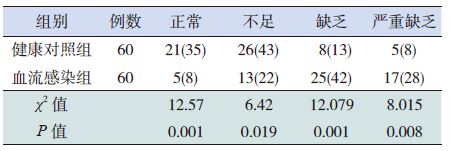
血流感染组维生素D 正常、不足的构成比均显著低于健康对照组,缺乏和严重缺乏的构成比均显著高于健康对照组(P<0.05),见表 2。
|
|
表 2 两组儿童维生素D 营养状况构成比比较 [例(%)] |
维生素D 在体内有着广泛的生物学效应,人体的维生素D 的活性形式是1,25- 二羟维生素D3[1,25(OH)2D3],与血液中效应细胞表面的维生素D受体(VDR)结合,除参与机体钙磷代谢,影响骨骼发育外,与多系统疾病均有密切关系,近年来维生素D 与免疫系统的关系引起广泛关注,不足或缺乏可致细胞、 体液免疫功能下降[1],维生素D 与呼吸系统、消化系统、心血管系统疾病的关系已有大量临床研究。
脓毒症是儿童最主要的死亡原因之一,尽管随着医学的发展,新的药物及治疗手段不断进步,然而脓毒症的发病率及病死率仍然居高不下,在美国婴幼儿严重脓毒症的发病率由2000年的0.63/1 000升高到2005年的0.89/1 000,其中新生儿严重脓毒症的发病率升高尤为明显[4, 5]。Madden等[2] 对511例入住ICU 的患儿进行研究发现危重症患儿维生素D 缺乏普遍存在,有研究提示维生素D 缺乏与脓毒症患者的病死率密切相关,改善脓毒症患儿维生素D 营养状态有可能改善脓毒症患儿的预后[3, 6]。
在脓毒症的发生、发展中炎性细胞因子起着重要作用,Bozza 等[7] 证实,死亡患者体内血清IL-1β、IL-4、IL-6、IL-8 和单核细胞趋化蛋白-1(MCP-1)的浓度显著高于存活者,其中MCP-1通过对IL-10的调节在脓毒症的发生与发展中起重要作用。Liu 等[8] 研究发现维生素D 在Toll 样受体激活与机体固有免疫抗菌反应之间的联系中起着至关重要的作用,维生素D 可以上调抗菌肽和抗菌蛋白如cathelicidin 及β-defensin 的表达,这些抗菌肽和抗菌蛋白在抗微生物感染中有着广泛作用。He 等[9] 研究表明维生素D 在激活和调控T 细胞抗原受体方面起关键作用,可以增强T 淋巴细胞的抗原识别作用。Adams 等[10] 给予骨质疏松患者补充维生素D2,每周2次,每次50 000 IU,连用5周,发现外周血单核细胞cathelicidin mRNA 表达明显升高。
Ginde 等[11] 报导81例因感染住院者中有79%的人血清25(OH)D 水平低于30 μg/L,其中53%为严重脓毒症,与血清25(OH)D 水平高于30 μg/L的感染者相比,低于30 μg/L 者在感染24 h后发生严重脓毒症的比例显著增高(29% vs 67%),引发的多器官功能障碍的风险也增加,其中4例死亡患者血清25(OH)D 水平均低于30 μg/L。Jeng等[12] 对24例成人脓毒症患者与21例健康人进行研究发现,脓毒症组血清25(OH)D 水平为16.0±8.5 μg/L,显著低于健康对照组(26.0±7.6 μg/L),脓毒症组及健康对照组维生素D 不足的比例分别为100% 及66.5%,差异有统计学意义。脓毒症患者血清维生素D 相关蛋白水平明显低于非脓毒症危重症患者,脓毒症患者血清抗菌肽LL-37浓度为13.7±2.1 μg/L,显著低于健康对照组(27.2±4.9 μg/L),低血清25(OH)D 水平与低血清LL-37浓度呈线性相关。Venkatram 等[13] 的回顾性研究发现,437例成人ICU 患者中维生素D 缺乏、不足和充足的比例分别为77.8%、16.9% 和5.3%,其中脓毒症及脓毒性休克患者血清25(OH)D 水平为13.2±9.2 μg/L,严重脓毒症患者血清25(OH)D 水平<20 μg/L 的病死率显著增加,提示低血清25(OH)D 水平影响着脓毒症的发生、发展及预后。
改善脓毒症患儿维生素D 营养状态有可能改善脓毒症患儿的预后,尽管目前临床研究不多,仍可见维生素D 干预对减轻脓毒症全身炎症反应方面的有益作用。Yamshchikov 等[14] 报导1例经抗结核药物强化治疗10个月无改善的难治性肺结核患者,检测其血清25(OH)D 水平仅7 ng/mL,在继续以前治疗方案同时给予补充维生素D2,每周3次,每次50 000 IU,连用8周,血清25(OH)D 升至81ng/mL,第10周患者肺部影像学表现明显改善,总疗程第13个月痰培养转阴,且未见维生素D 不良反应。Lippolis 等[15] 给予10头健康奶牛(实验前检测乳汁内无细菌生长)乳房内注射乳房链球菌制作乳腺炎模型,随机分为两组,治疗组每天挤奶后给予乳房感染部位注射25(OH)D 100 μg/次,每天2次,两组均未使用抗生素,第2、3、5天监测乳汁内菌落计数,结果显示维生素D 治疗组乳汁内菌落计数明显下降,体温较未治疗组下降,进食增加,提示维生素D 治疗可以减轻细菌感染的严重程度。
本研究中血流感染组血清25(OH)D 水平明显低于健康对照组,血流感染组维生素D 正常、不足的构成比均显著低于健康对照组,而缺乏、严重缺乏的构成比均显著高于健康对照组,与文献报导一致。脓毒症患儿尤其是血流感染患儿血清25(OH)D 水平明显降低,通过适量补充维生素D,改善脓毒症患儿维生素D 不足或缺乏状态可能为脓毒症的救治提供新的思路和新方法,其临床价值需要进一步探索。
| [1] | Prietl B, Treiber G, Pieber TR, et al. Vitamin D and immune function[J]. Nutrients, 2013, 5(7): 2502-2521. |
| [2] | Madden K, Feldman HA, Smith EM, et al. Vitamin D deficiency in critically ill children[J]. Pediatrics, 2012, 130(3): 421-428. |
| [3] | Nguyen HB, Eshete B, Lau KH, et al. Serum 1, 25-dihydroxyvitamin D: an outcome prognosticator in human sepsis[J]. PLoS One, 2013, 8(5): e64348. |
| [4] | Randolph AG, McCulloh RJ. Pediatric sepsis: important considerations for diagnosing and managing severe infections in infants, children, and adolescents[J]. Virulence, 2014, 5(1): 179-189. |
| [5] | Satar M, Ozlü F. Neonatal sepsis: a continuing disease burden[J]. Turk J Pediatr, 2012, 54(5): 449-457. |
| [6] | Cantorna MT, Zhu Y, Froicu M, et al. Vitamin D status, 1,25-dihydroxyvitamin D3, and the immune system[J]. Am J Clin Nutr, 2004, 80(6 Suppl): 1717S-1720S. |
| [7] | Bozza FA, Saulluh JI, Japiassu AM, et al. Cytokine profiles as markers of disease severity in sepsis: a multiplex analysis[J]. Crit Care, 2007, 11(2): R49. |
| [8] | Liu PT, Stenger S, Li H, et al. Toll-like receptor triggering of a vitamin D-mediated human antimicrobial response[J]. Science, 2006, 311(5768): 1770-1773. |
| [9] | He CS, Handzlik M, Fraser WD, et al. Influence of vitamin D status on respiratory infection incidence and immune function during 4 months of winter training in endurance sport athletes[J]. Exerc Immunol Rev, 2013, 19: 86-101. |
| [10] | Adams JS, Ren S, Liu PT, et al. Vitamin d-directed rheostatic regulation of monocyte antibacterial responses[J]. J Immunol, 2009, 182(7): 4289-4295. |
| [11] | Ginde AA, Camargo CA Jr, Shapiro NI. Vitamin D insufficiency and sepsis severity in emergency department patients with suspected infection[J]. Acad Emerg Med, 2011, 18(5): 551-554. |
| [12] | Jeng L, Yamshchikov AV, Judd SE, et al. Alterations in vitamin D status and anti-microbial peptide levels in patients in the intensive care unit with sepsis[J]. J Transl Med, 2009, 7: 28. |
| [13] | Venkatram S, Chilimuri S, Adrish M, et al. Vitamin D deficiency is associated with mortality in the medical intensive care unit[J]. Crit Care, 2011, 15(6): R292. |
| [14] | Yamshchikov AV, Oladele A, Leonard MK Jr, et al. Vitamin D as adjunctive therapy in refractory pulmonary tuberculosis: a case report[J]. South Med J, 2009, 102(6): 649-652. |
| [15] | Lippolis JD, Reinhardt TA, Sacco RA, et al. Treatment of an intramammary bacterial infection with 25-hydroxyvitamin D(3)[J]. PLoS One, 2011, 6(10): e25479. |
 2016, Vol. 18
2016, Vol. 18

 , 宋国维1
, 宋国维1