2. 郑州大学第三附属医院儿内科, 河南 郑州 450052;
3. 河南高等医学专科学校药学系, 河南 郑州 451191
婴幼儿时期由于呼吸系统生理、解剖上的特点以及免疫功能不完善等因素导致下呼吸道感染性疾病多发[1],支气管炎、支气管肺炎和毛细支气管炎在婴幼儿下呼吸道感染性疾病中占大多数,肺炎更是婴幼儿时期主要的死亡原因。上述疾病的免疫学发病机制一直是该领域的研究热点。淋巴细胞亚群分析是判断机体细胞免疫和体液免疫水平的重要指标,它能反映机体当前的免疫状态、功能及平衡情况。检测淋巴细胞亚群的流式细胞术具有高通量、敏感、特异、多参数和单细胞分析等优点,但由于技术要求和检测费用均较高,导致临床难以普遍开展。因此淋巴细胞亚群在婴幼儿下呼吸道感染性疾病的发生发展过程中所起的作用不甚明了[2, 3, 4]。本研究回顾性分析3岁以下支气管炎、支气管肺炎及毛细支气管炎患儿淋巴细胞亚群水平变化,以期进一步了解婴幼儿下呼吸道感染性疾病的免疫状态,为治疗提供指导。
1 资料与方法1.1 研究对象选取2014年1月至2015年6月郑州大学第三附属医院儿科收治的3岁以下的支气管炎(111例)、支气管肺炎(418例)及毛细支气管炎(83例)患儿为研究对象,诊断标准参照第8版《儿科学》[5],支气管肺炎按有无肺部以外的症状分为轻、重两组。
对照组选取235名同期健康体检的3岁以下婴幼儿,排除既往血液系统疾病、免疫缺陷病或风湿免疫性疾病以及近两周内有感染史者。本研究获医院医学伦理委员会批准。
1.2 试剂与仪器淋巴细胞亚群检测采用BD 公司FACSCalibur流式细胞仪、BD Multitest 试剂盒( 包括 BDMultitest CD3 FITC/CD8 PE/CD45 PerCP/CD4 APC、BD Multitest CD3 FITC/CD16+CD56 PE/CD45 PerCP/CD19 APC 和10×Multitest 溶血素)。
1.3 标本采集入院后当天采集各组婴幼儿空腹外周静脉血2 mL,EDTA 抗凝,于6 h内检测淋巴细胞亚群。
1.4 淋巴细胞亚群测定每例血标本对应标记两支流式专用管,分别加入20 μL BD Multitest CD3FITC/CD8PE/CD45PerCP/CD4APC 和20 μL BD Multitest CD3FITC/CD16+CD56 PE/CD45PerCP 试剂于试管底部; 将50 μL 充分混匀的抗凝全血移取到各管底部,震荡混匀,室温(20~25 ℃) 下避光孵育15 min;向两个管中添加450 μL 1×Multitest 溶血素,震荡混匀,室温(20~25 ℃) 下避光孵育15 min。流式细胞仪测定CD3+、CD4+、CD8+、CD19+、CD16+56+ 细胞相对计数及CD4/CD8,结果由BDMultiSET 软件自动获取。CD3+ 细胞为总T 淋巴细胞,CD3+CD4+CD8- 细胞代表辅助性T 细胞(Thelper cell,Th),CD3+CD4-CD8+ 细胞代表细胞毒性T 细胞(cytotoxic T cell,Tc)和抑制性T 淋巴细胞(suppressor T cell,Ts),CD3-CD19+ 细胞为B淋巴细胞,CD3-CD16+56+ 细胞为NK 细胞。
1.5 统计学分析采用SPSS 18.0统计软件进行统计学分析。计量资料以均数± 标准(x±s)表示。多组间均数比较采用单因素方差分析,方差不齐用Kruskal-Wallis 秩和检验;进一步两两比较采用Bonferroni检验,方差不齐用Wilcoxon 秩和检验。P<0.05为差异有统计学意义。
2 结果2.1 研究对象基本情况支气管炎患儿111例,其中男66例、女45例,年龄1个月至3岁,平均1.4±0.6岁。支气管肺炎患儿418例,其中轻症组254例(男140例、女114例,年龄4个月至3岁,平均1.5±0.8岁),重症组164例(男96例、女68例,年龄4个月~3岁,平均1.6±0.8岁)。毛细支气管炎患儿83例,其中男43例、女40例,年龄4个月至2岁,平均1.2±0.5岁。
对照组235例,其中男132例、女103例,年龄4个月至3岁,平均1.7±0.8岁。
疾病组与对照组在年龄、性别构成上差异无统计学意义(P>0.05)。
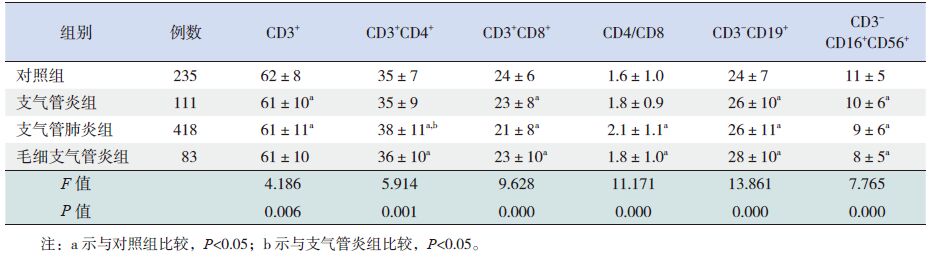
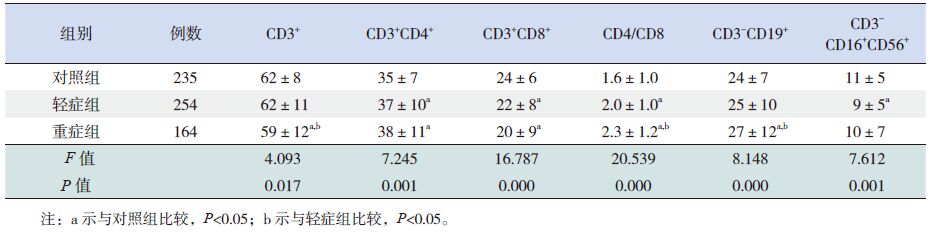
2.2 淋巴细胞亚群检测结果支气管炎组患儿总T 淋巴细胞、CD3+CD8+ 细胞和NK 细胞相对计数低于对照组,B 淋巴细胞相对计数高于对照组,差异有统计学意义(P<0.05);支气管肺炎组的总T 淋巴细胞、CD3+CD8+ 细胞和NK 细胞相对计数低于对照组,Th 细胞、CD4/CD8和B 淋巴细胞相对计数高于对照组,Th 细胞高于支气管炎组,差异有统计学意义(P<0.05);与对照组比较,毛细支气管炎组的Th 细胞、CD4/CD8和B 淋巴细胞相对计数增高,CD3+CD8+ 细胞和NK 细胞相对计数降低,差异有统计学意义(P<0.05)。见表 1。与对照组和轻症肺炎组比较,重症肺炎组的总T 淋巴细胞降低,CD4/CD8、B 淋巴细胞则明显增高,差异有统计学意义(P<0.05);轻症组患儿Th 细胞、CD4/CD8明显高于对照组,CD3+CD8+ 细胞、NK 细胞低于对照组(P<0.05)。见表 2。
|
|
表 1 各组外周血淋巴细胞亚群检测结果 (x±s,%) |
|
|
表 2 支气管肺炎轻症组与重症组外周血淋巴细胞亚群结果比较 (x±s,%) |
淋巴细胞在胸腺中发育成熟后进入外周血,参与并调节机体免疫功能,分为T 淋巴细胞、B淋巴细胞和NK 细胞。外周血成熟T 淋巴细胞均为CD3+ 细胞,再按照CD4和CD8表达情况分为不同亚群,即CD4+ 或CD8+ 亚群,各群有其特殊的免疫功能。研究表明,年龄对外周血淋巴细胞亚群有一定影响,尤其是两岁以下婴幼儿,是婴幼儿容易发生下呼吸道感染的重要原因[6, 7]。
支气管炎是各种病原引起的支气管黏膜炎症。本研究发现该组的总T 淋巴细胞、以及Tc、Ts、NK 细胞均低于对照组,B 淋巴细胞则高于对照组,提示支气管炎患儿细胞免疫功能降低、体液免疫功能相对亢进,可能与Ts 细胞比例下降,因而其抑制炎症、抑制白细胞介素-4分泌的作用减弱,Th1/Th2平衡得以恢复的免疫保护作用有关[8, 9]。
支气管肺炎是多种病原体或其他因素所导致的肺部炎症。本研究发现该组患儿T 淋巴细胞、以及Tc、Ts、NK 细胞计数低于对照组,Th 细胞、CD4/CD8、B 淋巴细胞相对计数高于对照组。提示支气管肺炎患儿存在细胞免疫功能降低并紊乱,体液免疫功能亢进。与轻症肺炎比较,重症肺炎组的T 淋巴细胞更低、B 淋巴细胞更高,说明肺炎患儿的细胞免疫紊乱程度与疾病的严重程度相关,B 细胞的代偿性升高与机体提高抗感染机制相一致[10, 11, 12],毛细支气管炎主要由病毒感染引起,呼吸道合胞病毒(RSV)是最常见的病原体[13]。毛细支气管炎患儿Th2类细胞因子增多,辅助B 细胞的增殖、分化,其合成、分泌的IgE 附着于肥大细胞表面并具有强烈的致敏性,当机体再次感染后与之结合,可使肥大细胞活化脱颗粒,释放炎性介质并发挥其生物学效应,进而导致喘息发作[14, 15]。本研究显示,毛支炎患儿的总T 淋巴细胞计数与对照组比较差异无显著性,但Th 细胞升高、Tc 及Ts 细胞降低而致CD4/CD8明显升高。正常情况下Th 和Tc 及Ts 细胞在功能上相互诱导、相互制约形成 T 细胞网络,调节机体正常免疫功能,一旦比值失衡则提示存在细胞免疫紊乱。
NK 细胞在抗感染免疫应答中可特异性地杀伤抗体包被的靶细胞,又可非特异性地杀伤病毒感染的细胞,同时也可通过分泌IFN-C 来调节细胞免疫功能。本研究中3组下呼吸道感染患儿的外周血NK 细胞均有不同程度降低,一方面说明机体在清除病原和杀伤受感染细胞过程中消耗了大量NK 细胞,另一方面也推测可能因NK 细胞比例低下而致疾病发生发展。
综上,支气管炎、支气管肺炎和毛细支气管炎患儿存在不同程度的细胞免疫功能低下或紊乱、以及体液免疫功能亢进,并且其变化程度与疾病类型及病情轻重有关。因此,对下呼吸道感染性疾病患儿进行淋巴细胞亚群检测,了解其免疫水平的改变,对于下呼吸道感染性疾病得到更好地诊治具有一定的临床意义。
| [1] | 李海珠, 吕波, 林志方, 等. 小儿急性下呼吸道感染病原体检测与临床分析[J]. 中华检验医学杂志, 2006, 29(5): 433-434. |
| [2] | Chang AB, Yerkovich ST, Gibson PG, et al. Pulmonary innate immunity in children with protracted bacterial bronchitis[J]. J Pediatr, 2012, 161(4): 621-625. e1. |
| [3] | Palamaro L, Giardino G, Santamaria F, et al. Interleukin 12 receptor deficiency in a child with recurrent bronchopneumonia and very high IgE levels[J]. Ital J Pediatr, 2012, 38(1): 46-49. |
| [4] | García C, Soriano-Fallas A, Lozano J, et al. Decreased innate immune cytokine responses correlate with disease severity in children with respiratory syncytial virus and human rhinovirus bronchiolitis[J]. Pediatr Infect Dis J, 2012, 31(1): 86-89. |
| [5] | 李昌崇. 呼吸系统疾病[M]//王卫平. 儿科学. 第8版. 北京: 人民卫生出版社, 2013: 269-284. |
| [6] | Shearer WT, Rosenblatt HM, Gelman RS, et al. Lymphocyte subsets in healthy children from birth through 18 years of age: The Pediatric AIDS Clinical Trials Group P1009 study[J]. J Allergy Clin Immunol, 2003, 112(5): 973-980. |
| [7] | Jia L, Li J, Zhang Y, et al. Age-and sex-related reference intervals of lymphocyte subsets in healthy ethnic Han Chinese children[J]. Cytometry A, 2015, 87(12): 1116-1126. |
| [8] | Nguyen TH, Casale TB. Immune modulation for treatment of allergic disease[J]. Immunol Rev, 2011, 242(1): 258-271. |
| [9] | 缪美华, 朱宏, 季正华, 等. 不同类型过敏原阳性喘息性支气管炎患儿免疫功能分析[J]. 中华检验医学杂志, 2013, 36(5): 446-448. |
| [10] | 张建梅, 陈欣, 任静, 等. 肿瘤坏死因子α、白介素6及白介素8在小儿支气管肺炎中检测的临床意义[J]. 国际呼吸杂志, 2008, 28(14): 833-834. |
| [11] | 山浩明, 张兰芳, 张琴. 小儿支气管肺炎的淋巴细胞亚群的变化[J]. 中华急诊医学杂志, 2012, 21(5): 488-490. |
| [12] | 朱晓华, 陈强, 柯江维, 等. 支气管肺炎患儿免疫功能变化的临床分析[J]. 中国当代儿科杂志, 2013, 15(3): 175-178. |
| [13] | Cormier SA, Shrestha B, Saravia J, et al. Limited type I interferons and plasmacytoid dendritic cells during neonatal respiratory syncytial virus infectionpermit immunopathogenesis upon reinfection[J]. J Virol, 2014, 88(16): 9350-9360. |
| [14] | Rosenwasser LJ, Busse WW, Lizambri RG, et al. Allergic asthma and an anti-CD23 mAb (IDEC-152) Results of a phase I, single-dose, dose-escalating clinical trial [J]. J Allergy Clin Immunol, 2003, 112(3): 563-570. |
| [15] | 董琳, 李昌崇, 陈小芳, 等. 呼吸道合胞病毒毛细支气管炎血清TH2类细胞因子及粘附分子水平的研究[J]. 中华儿科杂志, 2002, 40(4): 235-236. |
 2016, Vol. 18
2016, Vol. 18