原发性免疫性血小板减少症(immunethrombocytopenia,ITP)是儿童常见的良性出血性疾病,以血小板(PLT)破坏过多或生成减少,引起皮肤、黏膜、内脏出血为主要临床表现。其发病原因目前还不清楚,诊断仍是排除性诊断[1, 2]。越来越多的研究表明细胞免疫功能紊乱在ITP 发病中发挥重要作用。Th17细胞是新发现的效应性CD4+T 细胞亚群,以特异性分泌IL-17A 为主要特征,发挥其强大的促炎症反应作用。CD4+CD25+调节性T 细胞(Treg)是存在于正常人体内的一种抑制性T 细胞亚群,通过抑制自身反应性T 细胞的免疫反应、抑制T 细胞的活化及分泌抑制性细胞因子等,在自身免疫性疾病中发挥重要作用。Th17/Treg 细胞比例失衡是否参与了儿童ITP 发病过程,是否可以作为评估ITP 治疗的指标,目前还存在争议。本文通过检测ITP 患儿经丙种球蛋白治疗前后外周血 Th17、Treg 的比例变化,初步探讨Th17/Treg 失衡在儿童ITP 发病及治疗中的作用。
1 资料与方法1.1 研究对象选取2015年5月1日至2015年8月31日在郑州大学第一附属医院儿科就诊的32例ITP 患儿作为研究对象,所有病例均行骨髓穿刺检查,符合我国ITP 诊断标准[3, 4],排除其他引起PLT 减少的疾病如再生障碍性贫血、白血病、骨髓增生异常综合征、结缔组织病等。其中男18例,女14例,中位年龄2岁6个月(2个月至12岁),PLT 计数为1~38×109/L;选取同期健康体检儿童22例作为健康对照组,其中男12例,女10例,中位年龄3岁3个月(6个月至12岁)。ITP 组与健康对照组年龄、性别差异无统计学意义(P>0.05)。标本采集前均已签署知情同意书。
1.2 治疗方法所有ITP 患儿均采用静脉输注免疫球蛋白(IVIG)治疗,常用剂量:每日400 mg/kg,使用3~5 d;或每日0.8~1.0 g/kg,使用1 d 或连用2 d 后,应用泼尼松每日1.5~2 mg/kg(最大不超过60 mg/d),分次口服,至PLT>100×109/L 后稳定1~2周,逐渐减量直至停药。辅以抗感染、止血等对症支持治疗。
1.3 实验仪器与试剂FITC 标记的鼠抗人CD4单克隆抗体(100TST)、APC 标记的鼠抗人CD25单克隆抗体(100TST)、PE 标记的鼠抗人CD127单克隆抗体(0.1 mg)、APC、PE 分别标记的同型抗体、APC 标记的鼠抗人CD3单克隆抗体(100TST)、FITC 标记的鼠抗人CD8单克隆抗体(100TST)、PE 标记的鼠抗人IL-17A 单克隆抗体(100TST)、溶血素、固定/ 破膜剂、刺激剂/ 蛋白转运抑制剂、RPMI 1640培养液均购自美国Becton Dickinson 公司。流式细胞检测采用FACS Calibur 型流式细胞仪。
1.4 实验方法清晨采集初诊ITP 患儿治疗前、IVIG 应用后及健康对照组儿童空腹肝素钠抗凝外周血3~4 mL,所有标本均于采集后8 h内处理,标本采集应在明确诊断后进行,对于合并感染的患儿应在感染控制后进行。
取100 μL 肝素钠抗凝全血,分别加FITC 标记的鼠抗人CD4单抗20 μL、APC 标记的鼠抗人CD25单抗20 μL 及PE 标记的鼠抗人CD127单抗2.5 μL,混匀,室温避光孵育20 min,加红细胞裂解液2 mL,混匀,室温避光孵育15 min,待管内液体透亮后,以1 500 r/min 离心5 min,然后弃上清加500 μL PBS 重悬细胞(2次),规定时间内上流式细胞仪检测。
取肝素钠抗凝血100 μL,用RPMI 1640培养液1 : 1等体积稀释,调整细胞浓度在1×106/mL,其中加入刺激剂2 μL,于37℃恒温隔水培养箱中孵育4~6 h,加CD8-FITC 和CD3-APC 各20 μL,混匀,避光孵育20 min,加红细胞裂解液2 mL,混匀,室温避光孵育10 min,待管内液体透亮后,以1 500 r/min 离心5 min,然后弃上清。加入固定破膜剂250 μL,4℃下避光孵育20 min,以1 mLwash buffer 洗涤1次,1 500 r/min 离心5 min,然后弃上清。加100 μL wash buffer 重悬细胞,加入IL-17-PE 20 μL,混匀,4℃下避光孵育30 min,以1 mL wash buffer 洗涤1次,1 500 r/min 离心5 min,然后弃上清,以500 μL PBS 悬浮细胞,规定时间内上流式细胞仪检测。
1.5 疗效判断在ITP 的疗效判断时,需至少检测两次PLT水平,且两次检测之间隔7 d 以上。分完全反应(治疗后PLT ≥ 100×109/L,且没有出血表现)、有效(治疗后PLT ≥ 30×109/L,并且至少比基础PLT 数增加2倍,且没有出血表现)、激素依赖(需要持续使用皮质激素,使PLT ≥ 30×109/L 或避免出血)、无效(治疗后PLT<30×109/L 或者PLT 数增加不到基础值的2倍或者有出血表现)。
1.6 统计学分析采用SPSS 21.0统计软件对数据进行统计学分析,符合正态分布和方差齐性的计量资料采用均数± 标准差(x±s)表示,两组之间比较采用t检验;不符合正态分布的计量资料采用中位数(四分位间距)[M(P25,P75)] 表示,组间比较采用Wilcoxon 检验。P<0.05为差异有统计学意义。
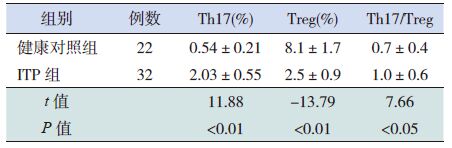
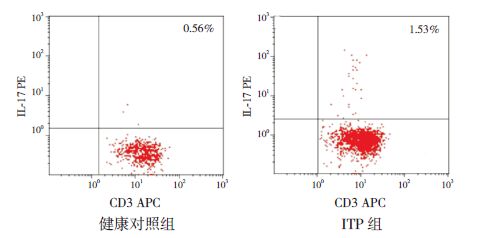
2 结果2.1 两组外周血中Th17、Treg 及Th17/Treg 比值的比较ITP 患儿Treg(CD4+CD25+CD127low) 占CD4+细胞的比例明显低于健康对照组,Th17(CD3+CD8-IL-17+)占CD4+ 细胞的比例及Th17/Treg 比值则高于健康对照组,差异有统计学意义(P<0.05),见表 1,图 1~2。
|
|
表 1 两组外周血Th17、Treg 细胞比例及Th17/Treg 比值的比较 (x±s) |
|
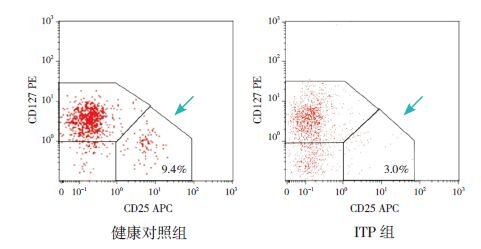
图 1 Treg 细胞流式检测图 箭头所指区域即为Treg细胞所在区域。 |
|
图 2 Th17细胞流式检测图 右上象限区域即为Th17所在区域。 |
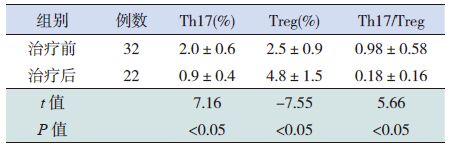
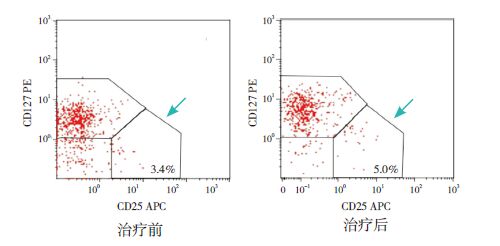
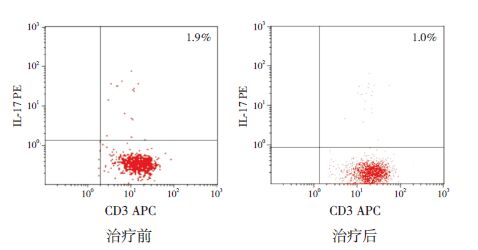
Treg 及Th17/Treg 比值的比较ITP 患儿治疗前Th17占CD4+ 细胞的比例及Th17/Treg 比值均明显高于治疗后,Treg 占CD4+细胞的比例则明显低于治疗后,差异均有统计学意义(P<0.05),见表 2,图 3~4。
|
|
表 2 两组外周血Th17、Treg 细胞比例及Th17/Treg 比值的比较 (x±s) |
|
图 3 ITP 患儿IVIG 治疗前后Treg 细胞流式检测图 箭头所指区域即为Treg 细胞所在区域。 |
|
图 4 ITP 患儿IVIG 治疗前后Th17细胞流式检测图 右上象限区域即为Th17细胞所在区域。 |
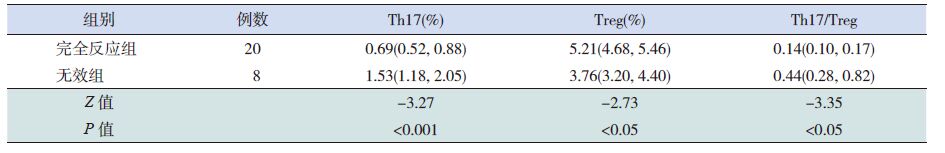
值的比较32例ITP 初诊患儿治疗后,20例完全反应,4例有效,8例治疗无效,4例有效患儿由于例数限制无法进行疗效评价,仅比较完全反应组与无效组,结果显示:完全反应组Th17、Th17/Treg 比值均低于无效组(P<0.05),Treg 细胞的比例在两组间比较差异无统计学意义(P<0.05)。见表 3。
|
|
表 3 治疗后不同疗效患儿Th17、Treg 细胞比例及Th17/Treg 比值的比较 [M(P25,P75)] |
ITP 的病因错综复杂,尚未完全阐明,多数学者认为细胞免疫学异常、体液免疫学异常及巨核细胞异常共同参与了ITP 的发病。ITP 虽为自限性疾病,仍有部分患儿经正规治疗效果欠佳,最终进展为难治性或慢性ITP,因此对该疾病发病机制的探讨就显得十分有必要。
Th17是一种新的CD4+T 细胞亚型,以特异性分泌IL-17为主要特征。IL-17是新发现的重要的促炎因子,具有多重生物学活性,可以诱导中性粒细胞增殖、成熟以及趋化,促进多种类型的细胞产生促炎性细胞因子,还可以和其他一些细胞因子相互作用,进而引起细胞浸润和组织破坏,影响感染、肿瘤和自身免疫的病理过程[5]。近几年研究发现,Th17与再生障碍性贫血[6, 7]、风湿性关节炎[8]、系统性红斑狼疮[9]、银屑病[10] 等多种自身免疫性疾病的发生及疾病进展程度密切相关。Treg 在分化及功能上与Th17相互拮抗,在机体免疫防御及稳定维护中发挥重要作用。有研究表明,Treg 与Th17共同参与ITP 发病,且二者的失衡在ITP 的发生发展中发挥重要作用。目前这方面的研究多集中在成人ITP,而在儿童中的研究相对较少,并且结论尚存在争议。Liu 等[11] 证实CD4+CD25+Treg 数量在ITP 活动期及未缓解期比其在正常对照组及缓解期ITP 是显著减少的。Aboul-Fotoh 等[12] 指出CD4+CD25+Treg 在ITP 活动期显著减少,而其在ITP 完全缓解期则显著增加,推测CD4+CD25+Treg 计数对于诊断和预测儿童ITP 发生发展具有一定的指导意义。常大雨等[13] 认为Treg的减少可能是导致慢性ITP 免疫调节功能紊乱的机制之一,而Th17可能与慢性ITP 的发展无关。本实验通过流式细胞术测定免疫性血小板减少症患儿外周血单个核细胞中Th17、Treg 的比例,结果显示ITP 组外周血Th17占CD4+T 细胞的比例、Th17/Treg 比值均明显高于正常对照组,而Treg 占CD4+T 细胞的比例显著低于正常对照组。提示原发性ITP 患儿中存在Th17/Treg 比例失衡,与多数学者的实验结果基本一致。
ITP 为良性自限性疾病,多数患儿预后良好,约10%~20% 的ITP 患儿虽经正规治疗仍有可能转化为慢性或难治性ITP,目前ITP 的一线治疗主要为激素与丙种球蛋白冲击治疗。陈诚等[14] 研究表明,ITP 患儿激素治疗后较治疗前Treg 占CD4+T细胞的比例较治疗前升高,推测激素可能通过诱导Treg 扩增从而达到治疗的目的。Ephrem 等[15]通过动物实验证实免疫球蛋白冲击疗法使Treg 功能恢复,从而纠正Th17/Treg 比例失衡,使炎症反应受到抑制。丙种球蛋白治疗儿童ITP 的机制除了中和血小板抗体外,是否影响细胞免疫功能,目前暂无文献报道。本研究将治疗前后相关指标进行比较,结果显示ITP 组患儿治疗前外周血Th17占CD4+T 细胞的比例、Th17/Treg 比值均明显高于治疗后,Treg 占CD4+T 细胞的比例显著低于健康对照组。进一步研究Th17/Treg 比值对预后的影响,对治疗后完全反应组与无效组进行比较,结果显示完全反应组Th17占CD4+T 细胞的比例、Th17/Treg 比值均低于无效组,Treg 占CD4+T 细胞的比例则变化不大,推测丙种球蛋白还可以通过调节细胞免疫功能进而达到治疗ITP 的目的。
综上所述,原发性ITP 患儿外周血中存在Th17/Treg 比例失衡,丙种球蛋白冲击治疗可调节该细胞比例变化进而改善ITP 患儿细胞免疫功能。应用丙种球蛋白治疗ITP 时检测Th17/Treg 比值的变化,可对其疗效有一定的预测作用。
| [1] | Neunert C, Lim W, Crowther M, et al. The American Society of Hematology 2011 evidence-based practice guideline for immune thrombocytopenia[J]. Blood, 2011, 117(16): 4190-4207. |
| [2] | Cuker A, Cines DB. Immune thrombocytopenia[J]. Hematology Am Soc Hematol Educ Program, 2010, 2010: 377-384. |
| [3] | 中华医学会血液分会血栓与止血学组. 成人原发免疫性血小板减少症诊治的中国专家共识(修订版)[J]. 中华血液学杂志, 2011, 32(3): 214-216. |
| [4] | 刘文君, 徐倩. 关于“儿童原发性免疫性血小板减少症诊疗建议”的解读[J]. 中华妇幼临床医学杂志(电子版), 2014, 10(2): 145-149. |
| [5] | Miossec P. IL-17 and Th17 cells in human inflammatory diseases[J]. Microbes Infect, 2009, 11(5): 625-630. |
| [6] | de Latour RP, Visconte V, Takaku T, et al. Th17 immune responses contribute to the pathophysiology of aplastic anemia[J]. Blood, 2010, 116(20): 4175-4184. |
| [7] | Kordasti S, Marsh J, Al-Khan S, et al. Functional characterization of CD4+ T cells in aplastic anemia[J]. Blood, 2012, 119(9): 2033-2043. |
| [8] | 姚血明, 曹跃鹏, 马武开, 等. 类风湿性关节炎患者外周血 Th17细胞/调节性T 细胞比例增加并与疾病活动相关[J]. 细胞与分子免疫学杂志, 2015, 31(1): 81-84. |
| [9] | 蔡小燕, 罗敏, 林小军, 等. Th17和Treg 细胞在系统性红斑狼疮患者外周血中的表达[J]. 中华医学杂志, 2012, 92(7): 460-463. |
| [10] | Lowes MA, Russell CB, Martin DA, et al. The IL-23/T17 pathogenic axis in psoriasis is amplified by keratinocyte responses[J]. Trends Immunol, 2013, 34(4): 174-181. |
| [11] | Liu B, Zhao H, Poon MC, et al. Abnormality of CD4+CD25+ regulatory T cells in idiopathic thrombocytopenic purpura[J]. Eur J Haematol, 2007, 78(2): 139-143. |
| [12] | Aboul-Fotoh Lel-M, Abdel Raheem MM, El-Deen MA, et al. Role of CD4+CD25+ T cells in children with idiopathic thrombocytopenic purpura[J]. J Pediatr Hematol Oncol, 2011, 33(2): 81-85. |
| [13] | 常大雨, 欧阳建, 周荣富, 等. 慢性特发性血小板减少性紫癜CD4+T 细胞亚群变化的特点[J]. 中华内科杂志, 2010, 49(3): 213-216. |
| [14] | 陈诚, 王佳, 李义德, 等. 免疫性血小板减少症患儿外周血 CD4+CD25+ 调节T 细胞和Th17细胞的变化[J]. 宁夏医科大学学报, 2013, 35(8): 864-867. |
| [15] | Ephrem A, Chamat S, Miquel C, et al. Expression of CD4+CD25+ regulatory T cells by intravenous immunoglobulin: a critical factor in controlling experimental autoimmune encephalomyelitis[J]. Blood, 2008, 111(2): 715-722. |
 2016, Vol. 18
2016, Vol. 18