哮喘是一种有多种细胞和炎性介质以及细胞因子参与的,以慢性气道炎症和气道高反应性为主要特征的变态反应性疾病。随着社会发展、人们生活环境以及生活模式的改变,近些年来儿童哮喘发病率在全球范围内有逐渐上升的趋势[1]。儿童哮喘既受环境因素的影响又受遗传因素的影响,国内外均有研究发现多种基因与哮喘的易感性相关[2],如CHI3L1基因[3]、CRTH2基因[4]、CDHR3基因[5] 等,国外Klaus 等[5] 发现IL1R1基因与哮喘的遗传易感性存在相关性,国内暂未见该基因与哮喘的相关性研究,由于种族及人群差异,本研究探讨IL1R1 基因的SNP 位点(rs1558641 和rs949963)的多态性与我国中部地区儿童哮喘的易感性是否相关,以进一步揭示哮喘的遗传学发病机制。
1 资料与方法 1.1 研究对象将2013年6月至2015年6月在我院儿科住院治疗的208例哮喘患儿纳入本研究,其中男性患儿114例,女性患儿94例;年龄2岁5个月至9岁7个月(4±3岁)。病例入选标准:(1)符合中华医学会儿科学分会呼吸学组制定的支气管哮喘诊断标准[6];(2)排除先天性心肺疾病、自身免疫性疾病、遗传性疾病等。收集同时期在我院体检正常的223名儿童作为健康对照组,其中男118例,女105例;年龄2岁6个月至10岁(4±3岁);均排除了各系统的疾病。哮喘组与健康对照组在年龄及性别比例上差异无统计学意义(分别P=0.315、0.694)。两组儿童均来自于我国中部地区。本研究得到患儿家属知情同意以及医院医学伦理委员会的批准。
1.2 IL1R1基因多态性分析抽取两组儿童静脉血2 mL,利用酚氯仿抽提乙醇沉淀的方法提取基因组DNA。以DNA 为模版利用引物F1(GAGAACAGACGGCAGTAAAAGC)和R1(CATTTACTCATTACTCCATGGGAAG) 扩增含有SNP(rs1558641) 的片段; 利用引物F2(GGATACTTTCAGGAAATCAAATCACAG) 和R2(CTGGCCTCTAGTACATTTCTTTCTG) 扩增含有SNP(rs949963) 的片段。PCR 总反应体系为25 μL,含有10倍PCR 反应缓冲液2.5 μL,10 mMdNTP 混合液1 μL,10 μM 引物各1 μL,TAKARA公司 Taq 酶1 U(5 U/μL); 反应条件:94 ℃3 min;94℃ 30 s,56℃ 30 s,72℃ 30 s,共35个循环。分别取5 μL 扩增的产物利用内切酶HindIII(TAKARA 公司)以及Pml I(TAKARA 公司)进行酶切,然后利用2.5% 琼脂糖电泳分析。
1.3 血清IL1R1水平的测定收集哮喘组患儿急性期及健康对照组的外周静脉血后,离心收集血清,利用ELISA 试剂盒(USCN公司)测定血清中IL1R1的水平。
1.4 统计学分析采用SPSS 19.0软件进行数据的统计分析。频率计数法计算哮喘组和健康对照组基因型和等位基因频率,利用Hardy-Weinberg 遗传平衡定律检验各组是否具有群体代表性。各组间基因型频率分布和等位基因频率分布比较采用χ2 检验;计量资料以均数± 标准差(x±s)表示,两组间比较采用成组t 检验。P<0.05为差异有统计学意义。
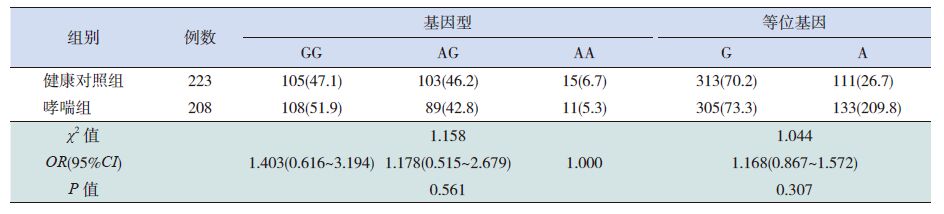
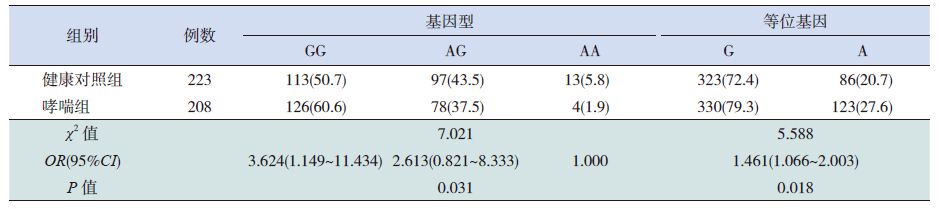
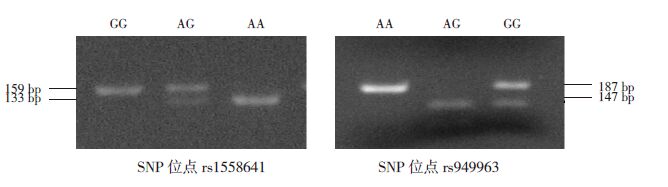
2 结果 2.1 IL1R1基因SNP 位点基因型的确定及频率分布哮喘组及健康对照组均利用Hardy-Weinberg遗传平衡定律检验,均符合该定律(P>0.05),说明两组均具有群体代表性。该基因SNP 位点rs1558641的基因型确定的方法为PCR 产物经酶切电泳后GG 基因型显示159 bp 条带,AA 基因型显示133 bp 的电泳条带,而AG 基因型显示以上两条带(图 1)。SNP 位点rs949963经酶切以后AA基因型显示187 bp 的条带,GG 基因型显示147 bp的条带,AG 基因型显示以上两条带(图 1)。统计结果显示,哮喘组SNP 位点(rs1558641)的3种基因型及等位基因分布与健康对照相比差异无统计学意义(P>0.05),见表 1。而哮喘组SNP 位点(rs949963)的3种基因型与健康对照组相比差异具有统计学意义(P=0.031),等位基因频率差异也具有统计学意义(P=0.018),G 等位基因为风险因子(OR=1.461),见表 2。
|
图 1 IL1R1基因两个SNP 位点基因型的确定 SNP 位点rs1558641的3种基因型别为:GG、AG 和AA;SNP 位点rs949963的3种基因型为:AA、AG 和GG。 |
|
|
表 1 IL1R1基因SNP 位点(rs1558641)的基因型及等位基因频率分布[n(%)] |
|
|
表 2 IL1R1基因SNP 位点(rs949963) 的基因型及等位基因频率分布[n(%)] |
哮喘组血清IL1R1水平(0.78±0.42 pg/mL)高于健康对照组(0.53±0.21 pg/mL),差异具有统计学意义(t=2.643,P=0.011)。SNP 位点(rs949963)GG 基因型的哮喘患儿血清IL1R1的水平为0.84±0.39 pg/mL,其他基因型(AA+AG)的患儿IL1R1的水平为0.59±0.25 pg/mL,两者比较差异具有统计学意义(t=2.292,P=0.028)。
3 讨论支气管哮喘是儿童最常见的慢性呼吸道疾病,该疾病反复发作,严重影响儿童的健康与学习生活。近年来,世界各国儿童哮喘的患病率不断上升;我国儿科哮喘协作组进行的全国规模的儿童哮喘患病率调查显示我国儿童哮喘的患病率也存在上升的趋势[7]。哮喘作为一种多因素复杂性疾病,其发病与遗传基因以及生长环境因素有关,目前全基因组关联研究发现200多个与哮喘相关的基因,且部分基因在多个人群中得到验证[5]。
IL1R1基因位于2号染色体q12区域,含有23个外显子,编码IL1R1细胞因子,该蛋白属于IL-1受体家族,是IL-1α、IL-1β 以及IL-1RA 的受体[8];研究表明IL1R1蛋白可与PIK3R1、Myd88蛋白以及IL1RAP 等相互作用在调节细胞代谢以及许多细胞因子诱导的免疫及炎症反应中发挥重要作用[9, 10, 11]。
本研究显示哮喘组患儿血清中IL1R1因子水平高于健康对照组儿童,推测可能的原因为哮喘是由于多种炎症细胞及细胞因子相互作用导致的气道炎症反应[1],巨噬细胞在一些因子的刺激下产生大量的IL-1α、IL-6以及TNF-α[12],过量的IL-1导致机体内IL1R1水平的升高。
SNP 位点(rs1558641) 位于IL1R1基因5’端的非编码区,本研究发现该基因的多态性与哮喘的易感性不相关,推测该位点虽然位于IL1R1基因的启动子区域,但不影响该基因的转录翻译过程。国外有研究小组发现IL1R1基因的该位点与哮喘的发病相关[5],本研究结果与之存在差异,可能的原因是人群及种族的差异或者是本研究纳入的样本量较小所导致。
本研究显示,SNP 位点(rs949963)的基因型频率与健康对照相比存在显著差异,G 等位基因为风险因子;且ELISA 的结果显示GG 基因型的患儿血清中IL1R1因子的水平高于其他基因型的患儿,提示携带GG 基因型的人群患哮喘的风险更大。该位点位于IL1R1基因的内含子区域,该SNP 位点的多态性与IL1R1基因的表达水平相关,推测可能的原因为该位点与调节该基因转录翻译的位点存在连锁效应,但进一步的分子机制需要进一步研究。
综上所述,本研究发现IL1R1基因SNP 位点(rs949963)的多态性与我国中部地区儿童哮喘的易感性相关,且该多态性影响患儿血清中IL1R1的水平,该结论对进一步认识哮喘的致病机制提供了帮助。但本研究仍存在一定的局限性,即本研究为单中心研究,样本量较小,今后应进行多地区、多种族、多中心的进一步分析,并在细胞及动物水平进一步阐述哮喘的发病机制。
| [1] | Daley D, Park JE, He JQ, et al. Associations and interactions of genetic polymorphisms in innate immunity genes with early viral infections and susceptibility to asthma and asthma-related phenotypes[J]. J Allergy Clin Immunol, 2012, 130(6): 1284-1293. |
| [2] | Ferreira MA, Matheson MC, Tang CS, et al. Genome-wide association analysis identifies 11 risk variants associated with the asthma with hay fever phenotype[J]. J Allergy Clin Immunol, 2014, 133(6): 1564-1571. |
| [3] | 李基明, 张慧芬, 沈晓丽. CHI3L1 基因单核苷酸多态性与儿童哮喘易感性的相关性研究[J]. 中国当代儿科杂志, 2015, 17(2): 144-148. |
| [4] | Campos Alberto E, Maclean E, Davidson C, et al. The single nucleotide polymorphism CRTh2 rs533116 is associated with allergic asthma and increased expression of CRTh2[J]. Allergy, 2012, 67(11): 1357-1364. |
| [5] | Klaus B, Patrick S, Kasper N, et al. A genome-wide association study identifies CDHR3 as a susceptibility locus for early childhood asthma with severe exacerbations[J]. Nat Genet, 2014, 46(1): 51-55. |
| [6] | 中华医学会儿科学分会呼吸学组. 儿童支气管哮喘诊断与防治指南[J]. 中华儿科杂志, 2008, 46(10): 745-753. |
| [7] | 全国儿科哮喘协作组. 第三次中国城市儿童哮喘流行病学调查[J]. 中华儿科杂志, 2013, 51(10): 729-732. |
| [8] | Müller M, Herrath J, Malmström V. IL-1R1 is expressed on both Helios(+) and Helios(-) FoxP3(+) CD4(+) T cells in the rheumatic joint[J]. Clin Exp Immunol, 2015, 182(1): 90-100. |
| [9] | Reddy SA, Huang JH, Liao WS. Phosphatidylinositol 3-kinase in interleukin 1 signaling. Physical interaction with the interleukin 1 receptor and requirement in NFkappaB and AP-1 activation[J]. J Biol Chem, 1997, 272(46): 29167-29173. |
| [10] | Hung CY, Jiménez-Alzate Mdel P, Gonzalez A, et al. Interleukin-1 receptor but not Toll-like receptor 2 is essential for MyD88-dependent Th17 immunity to Coccidioides infection[J]. Infect Immun, 2014, 82(5): 2106-2114. |
| [11] | Acuner Ozbabacan SE, Gursoy A, Nussinov R, et al. The structural pathway of interleukin 1 (IL-1) initiated signaling reveals mechanisms of oncogenic mutations and SNPs in inflammation and cancer[J]. PLoS Comput Biol, 2014, 10(2): e1003470. |
| [12] | Jin Y, Liu L, Zhang S, et al. Cadmium exposure to murine macrophages decreases their inflammatory responses and increases their oxidative stress[J]. Chemosphere, 2016, 144: 168-175. |
 2016, Vol. 18
2016, Vol. 18

 , 吴宏辉, 张翔
, 吴宏辉, 张翔