小于胎龄儿(small for gestational age,SGA)是指出生体重和(或)身长低于同胎龄同性别正常参考值第10百分位数的新生儿[1]。SGA 可发生于早产儿、足月儿和过期产儿,据估计全球婴儿中2.3%~10.0% 为SGA,我国不同地区SGA 发生率不同,约为6.61%,其中早产儿中发生率为13.1%,足月儿中发生率为6.05%[2]。SGA 发展成矮身材的危险性是适于胎龄儿(appropriate gestational age,AGA)的5~7倍[3]。大多数SGA 在出生6~12个月实现追赶生长。2~3岁时,约90% SGA 可实现追赶生长[4]。2001年美国食品与药物管理局(FDA)批准对于2岁时仍未出现充分追赶生长的生长落后的SGA 可采用重组人生长激素(recombinanthuman growth hormone,rhGH)治疗[5]。然而,rhGH治疗SGA 矮小症的剂量目前国内并不统一。本研究将37例SGA 矮小症患儿随机分组,采用不同剂量rhGH 进行治疗,旨在探讨不同剂量rhGH 对患儿生长速率(height velocity,HV)、身高标准差积分(height standard deviation score,HtSDS)增长的影响及相关不良反应的发生情况。
1 资料与方法 1.1 研究对象2011年1月至2014年2月因身材矮小于我院儿科门诊就诊并接受rhGH 治疗的37例SGA 患儿为研究对象,其中男性20例,女性17例,年龄3.0~10.9岁(平均6.5±2.3岁),骨龄≤年龄,身高均低于同年龄同性别正常儿童的-2 SD,排除全身系统性疾病及遗传代谢疾病、染色体病等,排除生长激素分泌(growth hormone,GH)不足,从未接受过生长激素治疗。
1.2 治疗方案与分组入选病例根据接受rhGH(长春金赛药业有限责任公司研发的赛增水剂)治疗剂量的不同分为两组:小剂量组(20例),治疗剂量为每日0.1~0.15 IU/kg;大剂量组(17例),治疗剂量为每日0.16~0.2 IU/kg。rhGH 均于每晚睡前1 h下注射,疗程为6~24个月。每3个月复查身高、体重及一般体检,并监测血常规、尿常规、甲状腺功能、空腹血糖、胰岛素样生长因子(IGF-1)和胰岛素样生长因子结合蛋白-3(IGFBP-3)等的变化。
1.3 评估指标统计两组患儿rhGH 治疗后3、6、9、12及24个月时HtSDS 较治疗开始前的增长值即ΔHtSDS及HV 的变化,身高标准参照2005年9省/ 市儿童体格发育调差数据[6],并对比治疗后3、6、9、12及24个月时血清IGF-1和IGFBP-3的增长,以及治疗期间血糖的变化。诊断及治疗随访策略参照《基因重组人生长激素儿科临床规范应用的建议》[4]。
1.4 统计学分析采用SPSS 20.0统计学软件进行统计学分析与处理。呈正态分布的定量资料以均值± 标准差(x±s)表示,两组间比较采用t 检验。定性资料以率(%)表示,组间比较采用χ2 检验;对各个剂量组的HtSDS 分别同血清IGF-1与IGFBP-3进行一元线性回归分析,以判断是否具有相关性。P<0.05示差异有统计学意义。
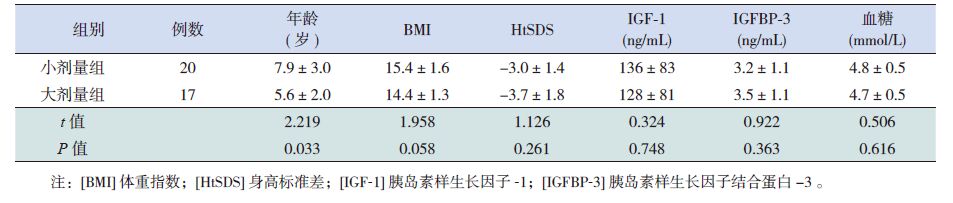
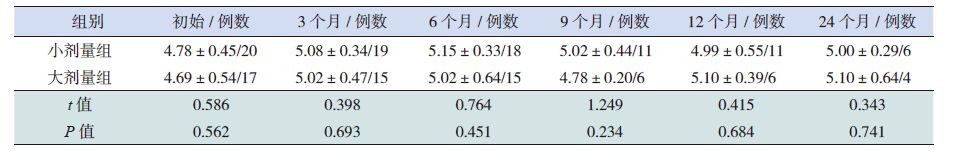
2 结果 2.1 一般资料大剂量组17例患儿中,女性9例,男性8例,开始治疗年龄平均5.6±2.0岁(范围3.0~9.1岁)。小剂量组20例患儿中,女性8例,男性12例,开始治疗年龄平均7.9±3.0岁(范围3.2~10.9岁)。两组均不伴有甲状腺功能异常。治疗前两组年龄比较差异有统计学意义,性别构成比较差异无统计学意义,治疗前BMI、HtSDS、IGF-1、IGFBP-3及空腹血糖比较差异亦无统计学意义(表 1)。
|
|
表 1 两组患儿治疗前一般资料的比较(x±s) |
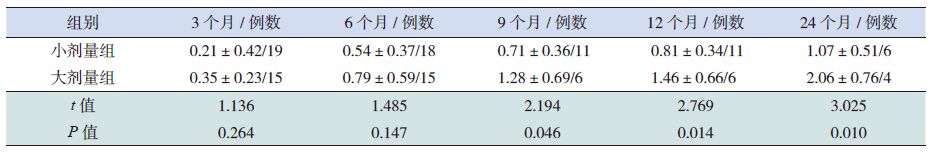
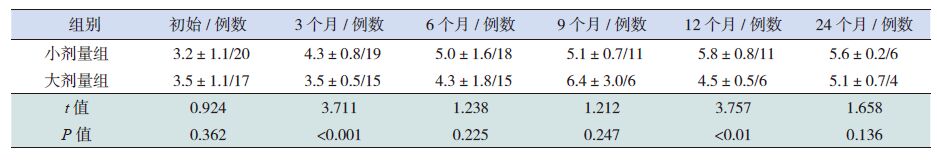
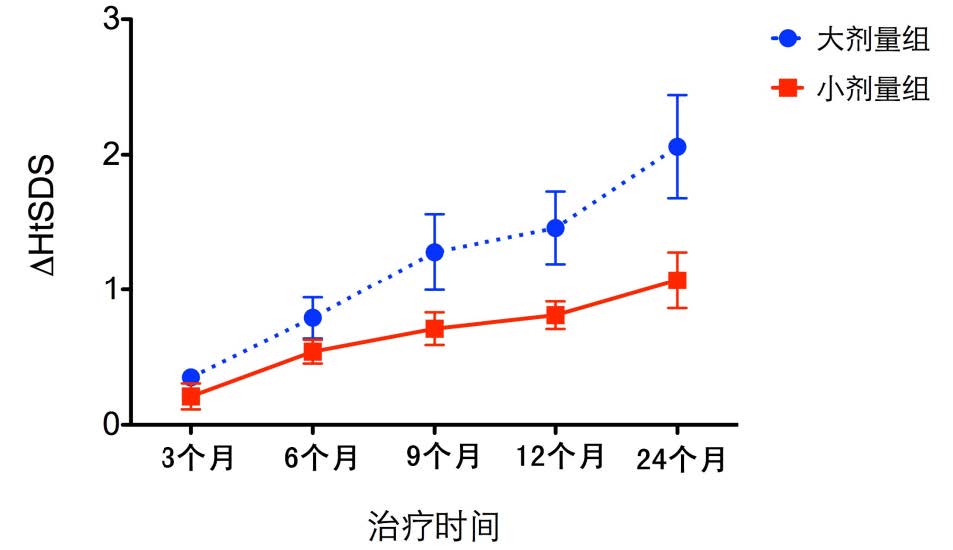
大小剂量组治疗后HtSDS 均提高,对两组在治疗第3、6、9、12、24个月时ΔHtSDS 进行比较,显示大剂量组在治疗后9个月、12个月及24个月ΔHtSDS 高于小剂量组,差异有统计学意义,见表 2 及图 1。
|
|
表 2 两组治疗后ΔHtSDS 的变化(x±s) |
|
图 1 两组治疗后ΔHtSDS 增长曲线图 a 示与小剂 量组比较,P<0.05。 |
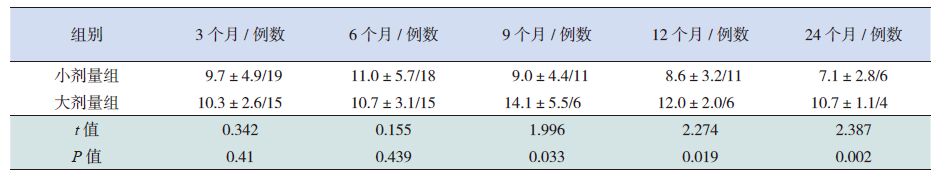
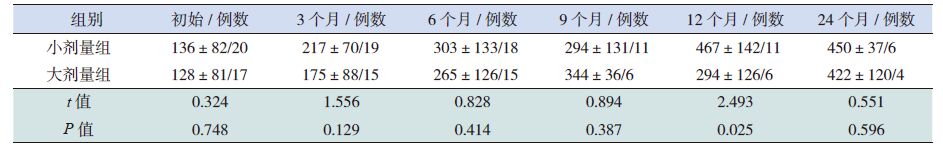
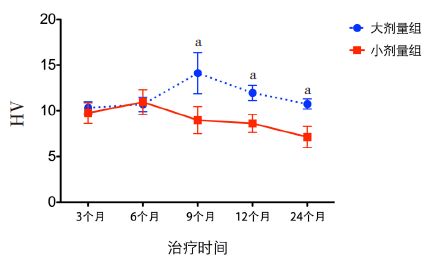
大剂量组治疗后9个月HV 达最高(14.1±5.5 cm/ 年),其后生长速度有所下降; 小剂量组在治疗后6个月时HV 最高,为11.0±5.7 cm/ 年,治疗后24个月时HV 却降至7.1±2.8 cm/ 年。两组HV 进行比较,自治疗后9个月开始差异便有统计学意义,大剂量组HV 较小剂量组升高更早更明显(表 3 及图 2)。
|
|
表 3 两组HV 的比较(x±s,cm/ 年) |
|
图 2 两组HV 的比较 a 示与小剂量组比较,P<0.05。 |
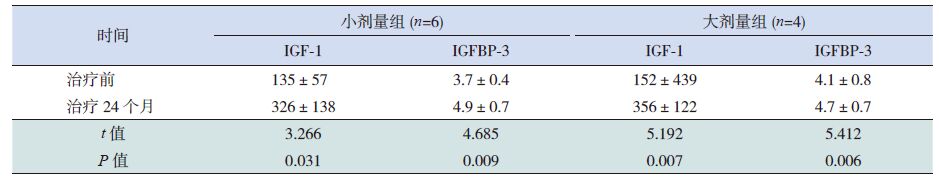
后两组患儿血清IGF-1与IGFBP-3均有明显增长(表 4)。治疗后12个月小剂量组血清IGF-1均值高于大剂量组,治疗后3、6、9及24个月两组比较差异无统计学意义(表 5)。治疗后3个月及12个月小剂量组血清IGFBP-3均值高于大剂量组,两组其他观察时间点血清IGFBP-3值差异无统计学意义(表 6)。
|
|
表 4 大剂量及小剂量组治疗前后IGF-1及IGFBP-3值的比较(x±s,ng/mL) |
|
|
表 5 大小剂量组治疗后血清IGF-1的变化(x±s,ng/mL) |
|
|
表 6 大小剂量组治疗后血清IGFBP-3的变化(x±s,ng/mL) |
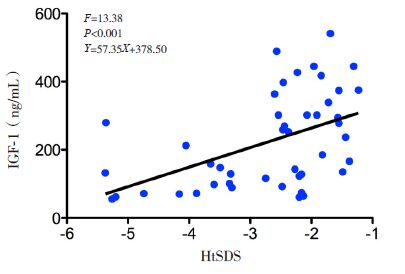
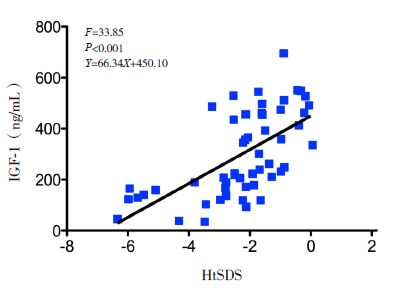
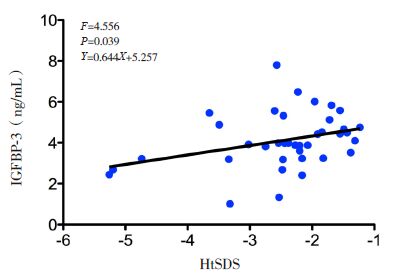
一元线性回归分析显示,两组治疗后血清IGF-1及IGFBP-3值与HtSDS 均呈线性回归,均有统计学意义(图 3~6)。
|
图 3 大剂量组治疗后IGF-1与HtSDS 回归分析 |
|
图 4 小剂量组治疗后IGF-1与HtSDS 回归分析 |
|
图 5 大剂量组治疗后IGFBP-3与HtSDS 回归分析 |

|
图 6 小剂量组治疗后IGFBP-3与HtSDS 回归分析 |
治疗过程中,大小剂量组各有1例患儿出现一过性空腹血糖轻微升高(均为6.1 mmol/L),未予特殊处理后均降至正常范围,余均在正常范围内。大小剂量组治疗后空腹血糖值比较差异无统计学意义(表 7)。两组治疗过程中甲状腺功能均无异常,且未见其他明显不良反应。
|
|
表 7 两组治疗后空腹血糖的比较(x±s,mmol/L) |
自2001年FDA 批准rhGH 治疗2岁后仍未出现充分追赶生长的SGA 矮小症以来,rhGH 已广泛用于SGA 矮小症的治疗。Hokken-Koelega 等[7] 的一项长期研究结果显示,采用rhGH 治疗2年后,70% 身材矮小SGA 身高进人正常范围,治疗10年后91% 进入正常范围。国内建议SGA 矮小症治疗指征为:(1)出生体重和(或)身长低于同胎龄、同性别正常参考值第10百分位;(2)>4岁身高仍低于同年龄、同性别正常儿童平均身高2 SD。开始治疗的年龄、身高、父母身高及rhGH 剂量对最终身高都起着重要作用[4]。美国FDA 推荐SGA矮小症的rhGH 最佳剂量为每周0.48 mg/kg(相当于每日0.2 IU/kg,即每日0.067 mg/kg),治疗时间为2~6年。rhGH 治疗早期,HV 与rhGH 初始剂量呈正比,剂量越大,HV 越快。但对于SGA 矮小症rhGH 治疗剂量的选择国内并无统一定论。我国矮身材儿童治疗指南对SGA 矮小症rhGH 的推荐剂量为每日0.15~0.2 IU/kg[8];而我国rhGH 儿科临床规范应用建议其治疗剂量为每日0.1~0.2 IU/kg,因其存在一定程度的生长激素抵抗,建议rhGH 治疗剂量高于其他病种[4]。本研究以每日0.15 IU/kg为界分组,比较大小剂量治疗效果及不良反应的差异,为临床用药的剂量选择提供理论基础。
本研究显示,大小剂量治疗均可以提高HtSDS,大剂量组在治疗9个月后ΔHtSDS 较小剂量组便出现显著优势,提示相对较小剂量而言,大剂量对于SGA 身高改善效果好,增长值更大。欧洲一项多中心研究[9] 报道使用低剂量组(每日0.033 mg/kg,相当于每日0.1 IU/kg) 和高剂量组(每日0.067 mg/kg,相当于每日0.2 IU/kg)治疗的患儿分别于治疗5.5年和2.5年后身高增长达到2 SD,提示高剂量组较低剂量组可较早达到显著追赶生长的治疗效果。Van Pareren 等[10] 的研究纳入平均年龄为8岁的54例SGA 矮小症患儿,随机分为小剂量组(每日0.033 mg/kg,即每日0.1 IU/kg)和大剂量组(每日0.067 mg/kg,即每日0.2 IU/kg),两组治疗7.9年和7.5年后,终身高与对照组比较分别提高1.2 SD 和1.4 SD,大剂量组较小剂量组稍高,但差异不大。但Maiorana 等[11] 在对4项rhGH 治疗SGA 矮小症的对照试验里的391例患儿终身高进行Meta 分析时发现,两个不同剂量治疗组之间并没有明显的差异。本研究显示大剂量组治疗2年后HtSDS 增长较小剂量组更明显,与国外大多报道[9, 10, 12, 13] 相符。
本研究中,大小剂量组在治疗一段时间后均有HV 减慢的现象,大剂量组在治疗后3个月时HV 最低,为10.3±2.6 cm/ 年,在治疗9个月时HV 达最高,为14.1±5.5 cm/ 年,其后生长速度有所下降;小剂量组在治疗6个月时HV 最高,为11.0±5.7 cm/ 年,治疗24个月时HV 降至最低(7.1±2.8 cm/ 年),两组HV 进行比较,自治疗9个月开始差异便有统计学意义,提示大剂量组HV 较小剂量组升高更明显,这也与本研究ΔHtSDS 的增长相符合。国外的研究也证实了这一点。意大利一项随机多中心试验[14] 研究了26例青春期前不伴有生长激素缺乏的SGA 矮小儿童,治疗第1年均以每周0.23 mg/kg(相当于每日0.1 IU/kg) 剂量rhGH 治疗,在治疗1年左右所有儿童的HV 明显增加;在第2年将患儿随机分为A 组(13例,每周0.23 mg/kg,约为每日0.1 IU/kg) 和B 组(13例,每周0.46 mg/kg,约为每日0.2 IU/kg)继续治疗,结果显示A 组患儿第2年的HV 有明显减慢,而B 组则维持了之前的HV。而2年治疗结束后,A 组患儿中有8例SGA 矮小儿身高达到正常范围;而B 组内完成2年治疗的11例SGA 矮小儿身高全部达到正常范围。此研究亦表明,SGA 矮小症的治疗方案建议应做到个体化治疗,观察第1年的身高增长速度以了解rhGH 治疗效果。结合本研究,因大剂量较小剂量HV 增长更早更显著,临床用药时第1年治疗剂量可选择大剂量(每日0.16~0.20 IU/kg),其后根据第1年增长速度进行个体剂量调整,使患儿得到更好的治疗效果。
SGA 矮小的主要原因是GH-IGF-1轴的功能障碍,其主要体现在激素缺乏或激素抵抗。GH 促进肝脏分泌IGF-1,IGF-1与IGFBP-3相结合介导GH 的生长、代谢调节过程。最近的研究发现胰岛素样生长因子-1受体(insulin-like growth factor 1receptor,IGF-1R)变异与SGA 的发生相关[15, 16]。有人假设,至少有2.5%的SGA 新生儿存在IGF-1R 基因缺陷[17]。而rhGH 治疗身材矮小SGA 的机制便是提高血清IGF-1水平,促进软骨生长而促进发育[18]。我国rhGH 儿科临床规范应用指南建议每3~6个月监测一次血清IGF-1水平。本研究也观察到使用rhGH 后,两组患儿血清IGF-1及IGFBP-3水平均升高,且IGF-1及IGFBP-3水平与HtSDS均呈正相关,亦支持GH-IGF-1轴对SGA 生长发育有调控作用的理论。
SGA 成年后患胰岛素抵抗、2型糖尿病、血脂代谢异常和心血管疾病的风险要高于AGA[19],尤其是有T2DM 或代谢综合征族史的SGA 患儿,其机制尚不明确,大量研究认为胰岛素抵抗是关键。而rhGH 可降低细胞对胰岛素的敏感性,降低外周组织的葡萄糖利用率,长期使用可使血糖升高[20]。因此对于rhGH 治疗SGA 这一不良反应应予以重视,用药期间和停药后的较长时间内都需严密监测空腹血糖、空腹胰岛素及糖化血红蛋白水平。本研究中两组患儿治疗期间均有1例出现一过性空腹血糖轻微升高,未予特殊处理后降至正常,余均在正常范围内,显示两种剂量治疗后对空腹血糖没有明显影响。国外多年的应用经验显示rhGH 治疗SGA 矮小儿童无论剂量多少以及治疗时间长短,均具有良好的疗效及安全性[5]。结合本研究结果,提示无论rhGH 剂量大小,短期内对SGA 矮小症患儿糖代谢影响较小,使用安全。
目前报道rhGH 治疗的相关不良反应还有良性颅高压、甲状腺功能低下、股骨头滑脱、脊柱侧弯、诱发肿瘤的可能性、色素痣、手脚变大等[4, 21]。而本研究大小剂量组在治疗过程中均无甲状腺功能异常,亦无上述其他不良反应的出现。
综上所述,rhGH 治疗SGA 矮小症疗效确切,大剂量rhGH 较小剂量rhGH 治疗SGA 矮小使ΔHtSDS 及HV 提高更显著,同时无论剂量大小均可提高血清IGF-1及IGFBP-3水平,促进生长,且不良反应小,安全性较高。对于SGA 追赶生长失败的患儿,应早期应用rhGH 治疗,且大剂量的治疗效果更好。由于本研究是回顾性研究,两组起始治疗年龄比较差异有统计学意义,可能系根据既往临床经验而选择剂量造成。同时本研究样本数有限,且随着随访时间延长其病例数逐步减少,因此需要设计良好的前瞻性研究,进一步明确大剂量与小剂量rhGH 治疗SGA 矮小效果的差异性。使用rhGH 治疗过程中应严密监测血清IGF-1、IGFBP-3、胰岛素水平、空腹血糖及甲状腺功能等水平,根据患儿对rhGH 治疗的反应及身高的增加,综合判断进一步治疗剂量,及时调整。
| [1] | Jancevska A, Tasic V, Damcevski N, et al. Children born small for gestational age (SGA) [J]. Prilozi, 2012, 33(2): 47-58. |
| [2] | 中华医学会儿科学分会新生儿学组. 我国小于胎龄儿现状分析[J]. 中国实用儿科杂志, 2009, 24(3): 177-180. |
| [3] | De Zegher F, Hokken Koelega A. Growth hormone therapy for children born small for gestational age: high gain is less dose dependent over the long term than over the short term[J]. Pediatrics, 2005, 115(4): e458-462. |
| [4] | 中华医学会儿科学分会内分泌遗传代谢学组; 《中华儿科杂志》编辑委员会.基因重组人生长激素儿科临床规范应用的建议[J]. 中华儿科杂志, 2013, 51(6): 426-432. |
| [5] | Henwood MJ, Grimberg A, Moshang T Jr. Expanded spectrum of recombinant human growth hormone therapy[J]. Curr Opin Pediatr, 2002, 14(4): 437-442. |
| [6] | 李辉, 季成叶, 宗心南, 等. 中国0-18岁儿童、青少年身高、体重的标准化生长曲线[J]. 中华儿科杂志, 2009, 47(7): 487-492. |
| [7] | Hokken-Koelega A, van Pareren Y, Arends N. Effects of growth hormone treatment on cognitive function and head circumference in children born small for gestational age[J]. Horm Res, 2005, 64(Suppl 3): S95-S99. |
| [8] | 中华医学会儿科学分会内分泌遗传代谢学组. 矮身材儿童诊治指南[J]. 中华儿科杂志, 2008, 46(6): 428-430. |
| [9] | de Zegher F, Albertsson-Wikland K, Wollmann HA, et al. Growth hormone treatment of short children born small for gestational age: growth responses with continuous and discontinuous regimens over 6 years[J]. J Clin Endocrinol Metab, 2000, 85(8): 2816-2821. |
| [10] | Van Pareren Y, Mulder P, Houdijk M, et al. Adult height after long-term, continuous growth hormone (GH) treatment in short children born small for gestational age: results of a randomized, double-blind, dose-response GH trial[J]. J Clin Endocrinol Metab, 2003, 88(8): 3584-3590. |
| [11] | Maiorana A, Cianfarani S. Impact of growth hormone therapy on adult height of children born small for gestational age[J]. Pediatrics, 2009,124(3): e519-e531. |
| [12] | Carel JC, Chatelain P, Rochiccioli P, et al. Improvement in adult height after growth hormone treatment in adolescents with short stature born small for gestational age: results of a randomized controlled study[J]. J Clin Endocrinol Metab, 2003, 88(4): 1587-1593. |
| [13] | van Dijk M1, Bannink EM, van Pareren YK, et al. Risk factors for diabetes mellitus type 2 and metabolic syndrome are comparable for previously growth hormone-treated young adults born small for gestational age (sga) and untreated short SGA controls[J]. J Clin Endocrinol Metab, 2007, 92(1): 160-165. |
| [14] | Sas T, Mulder P, Hokken-Koelega A. Body composition, blood pressure, and lipid metabolism before and during longterm growth hormone (GH) treatment in children with short stature born small for gestational age either with or without GH deficiency[J]. J Clin Endocrinol Metab, 2000, 85(10): 3786-3792. |
| [15] | Saenger P, Reiter E. Genetic factors associated with small for gestational age birth and the use of human growth hormone in treating the disorder [J/OL]. Int J Pediatr Endocrinol, 2012, 2012(1): 12. |
| [16] | Klammt J, Kiess W, Pfäffle R. IGF-1R mutations as cause of SGA[J]. Best Pract Res Clin Endocrinol Metab, 2011, 25(1): 191-206. |
| [17] | Leal Ade C, Canton AP, Montenegro LR, et al. Mutations in insulin-like growth factor receptor 1 gene (IGF-1R) resulting in intrauterine and postnatal growth retardation[J]. Arq Bras Endocrinol Metabol, 2011, 55(8): 541-549. |
| [18] | Trivin C, Souberbielle JC, Aubertin G, et a1. Diagnosis of idiopathic growth hormone deficiency: contributions of data on the acid-labile subunit, insulin-like growth factor (IGF)-I and -II, and IGF binding protein-3[J]. J Pediatr Endocrinol Metab, 2006, 19(4): 481-489. |
| [19] | 吴洁, 毛萌. 小于胎龄儿与胰岛素抵抗的研究进展[J]. 实用儿科临床杂志, 2006, 21(2): 117-119. |
| [20] | Hales CN, Desai M, Ozanne SE. The thrifty phenotype hypothesis: how does it look after 5 years?[J]. Diabet Med, 1997, 14(3): 189-195. |
| [21] | Bell J, Parker KL, Swinford RD, et a1. Long-term safety of recombinant human growth hormone in children[J]. J Clin Endocrinol Metab, 2010, 95(1): 167-177. |
 2016, Vol. 18
2016, Vol. 18