2. 重庆医科大学附属深圳市儿童医院放射科, 广东 深圳 518038;
3. 重庆医科大学附属深圳市儿童医院血液科, 广东 深圳 518038;
4. 重庆医科大学附属儿童医院血液科, 重庆 400014
急性淋巴细胞白血病(acute lymphoblasticleukemia,ALL)约占儿童恶性肿瘤的1/3,是儿童时期最常见的恶性肿瘤,随着治疗方案的不断改进,儿童ALL 的生存率已经提高到约90%[1],但中枢神经系统复发仍然是导致其治疗失败的重要因素。头颅MRI 对颅脑、脊髓病变尤其是颅骨骨髓浸润等早期病变的发现,明显优于CT 等其它影像学手段[2]。美国St. Jude 儿童医院要求ALL 患儿于再诱导的第一周和维持治疗阶段进行头部MRI检查,以评价化疗对中枢神经系统的影响[3];BFM2009方案则要求每个患儿在再诱导化疗阶段均行头部MRI 检查[4]。但国内外方案并没有将治疗前头颅MRI 检查作为必需的评价手段。本研究旨在应用头颅MRI 观察ALL 患儿治疗前后的影像学变化,进一步评价诱导化疗对颅脑损伤的影响。现报道如下。
1 资料与方法 1.1 研究对象2014年3月至2015年6月期间,重庆医科大学附属深圳市儿童医院血液科住院治疗的ALL 患儿62例,其中男41例、女21例;年龄1~13岁、中位年龄3.2岁,其中1岁~ 29例(47%),3岁~16例(26%),6~13岁17例(27%)。高危(highrisk,HR)21例(34%),非高危41例(66%):中危(intermedium risk,IR)25例、标危(standardrisk,SR)16例。外周血WBC<20×109/L 者38例(61%),WBC ≥ 20×109/L 者24例(39%)。中枢神经系统白血病1例。
1.2 ALL 诊断及分型标准ALL 的诊断及临床危险度分型按照广东地区儿童急性淋巴细胞白血病2008化疗协作组方案(GD2008 ALL 方案)制定的标准。GD2008 ALL方案在GZ2002 ALL 化疗方案[5] 的基础上,对危险分度标准保持不变,但对SR、IR 的治疗作了调整,并且推出HR 治疗方案。
1.3 纳入标准①符合GD2008 ALL 方案确诊为ALL 的初诊患儿;②在我院住院并完成诱导缓解化疗;③排除既往有神经系统症状、体征及影像学异常的患儿。
1.4 分组和治疗方案按GD2008 ALL 方案,将62例患儿分为高危及非高危两组;另外根据血常规将62例患儿分为WBC<20×109/L 及WBC ≥ 20×109/L 两组。所有确诊患儿均按GD2008 ALL 化疗协作组方案,3个月完成诱导缓解方案VDLP+CAM 化疗。
1.5 头颅MRI 检查所有患儿均在化疗前行头颅MRI 检查,其中28例患儿于化疗3个月后临床达完全缓解时复查头颅MRI,MRI 的初查及复查均使用3.0T Skyra 磁共振仪(德国西门子),两次扫描序列一致。所有图像由我院两名放射科神经组医师及一名神经专科临床医师进行分析。
1.6 统计学分析采用SPSS 16.0软件进行统计分析。计数资料以百分比(%)表示,组间比较采用χ2 检验。P<0.05为差异有统计学意义。
2 结果 2.1 诱导化疗前后头颅MRI 脑实质变化62例ALL 患儿化疗前行头颅MRI 检查,发现脑萎缩4例(7%):其中高危组3例(75%)、非高危组1例(25%);感觉传导束异常信号2例(3%):高危及非高危组各占1例。28例化疗后复查头颅MRI 的患儿,新出现脑萎缩3例(11%)、1例脑萎缩加重,均为高危组病人;2例有感觉传导束异常信号的患儿病灶消失。见表 1,图 1。
|
|
表 1 28例随访患儿资料 |
|
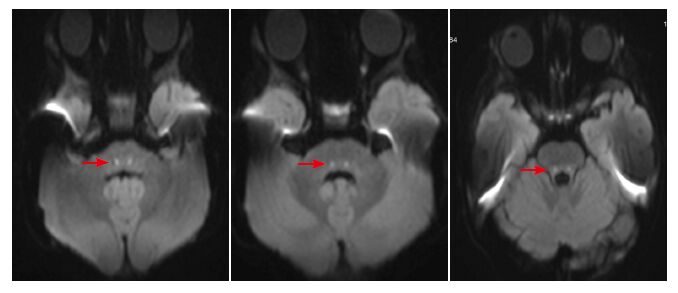
图 1 化疗前脑桥延髓感觉传导束受累 (序号12) DWI 显示双侧脑桥及延髓背侧异常信号(箭头所示),提 示感觉传导束受累。 |
化疗前头颅MRI 提示,33例(53%) 出现颅骨骨髓浸润,其中WBC<20×109/L 者16例(48%)、WBC ≥ 20×109/L 者17例(52%),WBC ≥ 20×109/L 组发生颅骨骨髓浸润的比率(71%) 明显高于WBC<20×109/L 组(42%)(χ2=4.876,P<0.05)。化疗前33例颅骨骨髓浸润的患儿中,高危者15例(45%)、非高危者18例(55%),高危组发生颅骨骨髓浸润比率(71%)高于非高危组(44%)(χ2=4.226,P<0.05)。化疗后复查MRI,11例(33%)颅骨骨髓浸润消失。见图 2。
|
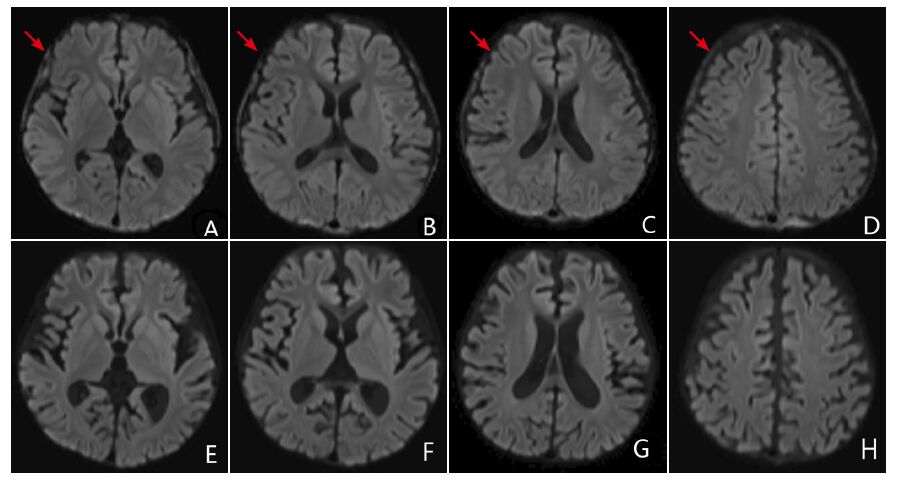
图 2 化疗前后颅骨骨髓浸润及脑萎缩变化(序号19) 图A,B,C,D:DWI 显示化疗前颅骨板障异常信号 (箭头所示),提示颅骨骨髓浸润,脑沟及脑室扩大提示脑萎缩;图E,F,G,H:DWI 显示化疗后颅骨板障异常信号消失, 脑沟及脑室扩大更加明显,提示脑萎缩加重。 |
儿童急性白血病(acute leukemia,AL)的颅脑损伤可分为两类成因:治疗前由原发病变所致的中枢神经系统(central nervous system,CNS)病变,包括脑血管并发症(脑出血、脑梗塞)和CNS 浸润(脑膜、软组织等浸润);治疗后出现的副作用包括脑萎缩、脑白质病变、大脑后部可逆性脑病综合征、继发颅内第二肿瘤以及免疫抑制所致的CNS 感染等[6, 7, 8]。其中由原发病变所致相对较少,占10% 左右[9]。本研究未发现化疗前有脑出血、脑梗塞等脑血管并发症及脑膜浸润等病变,可能与样本量偏少有关,也可能与研究对象均为ALL有关,因为急性髓细胞白血病(AML)更易出现CNS 损害[10]。Porto 等[10] 在总结135例儿童白血病头颅MRI 资料中发现,部分患儿化疗前存在脑萎缩。本研究也证实部分患儿化疗前存在脑萎缩。另外,本研究发现2例患儿出现脑桥延髓背侧的双侧对称性纵行长T1长T2信号,提示上行感觉传导束受累。Satomic 等[11] 报道,1例唐氏综合征合并ALL 的患者化疗后发现脊髓后索及侧索严重的脱髓鞘空泡变性,病变从延髓一直延续至腰髓,类似于脊髓亚急性联合变性。但目前国内外尚未发现ALL 患者由于疾病本身导致上行感觉传导束受累的相关报道。本研究中,化疗前头部MRI 提示感觉传导束异常信号的2例患儿由于年龄小,无法完全配合完成相关皮肤痛温觉及深感觉的体格检查,对于这类患儿是否在化疗前就存在上行感觉传导束受累尚需收集更多病例资料加以证实。
目前国内外关于DWI 应用于颅骨骨髓浸润的诊断报导很少。本研究在对ALL 儿童进行头颅DWI 扫描时发现,部分患儿化疗前出现了颅骨板障高信号,经诱导化疗后异常信号消失,提示颅骨高信号为颅骨骨髓浸润;同时还发现WBC ≥ 20×109/L 组和高危组的患儿出现颅骨骨髓浸润的比率较高,提示外周血白细胞数目及临床危险度分型可能是影响颅骨骨髓浸润的重要因素。另外,本研究还发现,1例中枢神经系统白血病患儿的外周血白细胞明显升高,颅骨板障信号增高也非常明显。那么,颅骨骨髓浸润是否与白血病中枢神经系统浸润有关还需要进一步研究证实。白血病细胞进入CNS 的方式主要有:通过血行转移由血管内皮进入CNS,并与外周血淋巴细胞数目、血小板减少及血脑屏障是否成熟有关;或者通过被浸润的颅骨骨髓直接扩散入脉络膜,到达脑脊液,进而侵犯脑实质或软脑膜[12]。国内报道指出,MRI/CT 显示的脑实质或脑膜块状白血病细胞浸润为中枢神经系统白血病诊断标准之一[5],但并没有将颅骨骨髓浸润纳入诊断条件。本研究提示部分非高危组患儿化疗前也出现了颅骨骨髓浸润,虽然经诱导缓解后浸润消失,但这部分患儿中枢神经系统白血病的风险是否增高?其远期预后如何?目前国内外均没有相关研究,值得关注。
ALL 儿童治疗后出现的颅脑损伤可由化疗、放疗和骨髓移植导致,尤其是中枢神经系统白血病的预防性治疗可导致相关颅脑并发症[13]。既往认为脑萎缩是颅脑放疗的副作用,且与白质损伤有关,但也有研究认为化疗药物对脑萎缩的影响要比放疗的影响大[14]。本研究发现,化疗后有出现脑萎缩加重或新发的,但几率并不高,而且未发现脑血管病变、脑白质病变等并发症,考虑与观察的时间比较短有关。
本研究发现ALL 儿童化疗前后均可出现包括颅骨骨髓浸润在内的颅脑损伤,颅骨骨髓浸润与外周血白细胞数目及危险度分型的关系,提示外周血白细胞及临床危险度高者出现颅骨浸润的可能性更大。另外,值得关注的是,化疗前非高危组相当一部分患儿出现颅脑损伤、尤其是颅骨骨髓浸润,有必要对这部分患儿的长期疗效进行评估,如果其长期生存率明显低于无浸润组,这组患儿可能需要调整治疗方案,并重新评价颅脑MRI 在ALL 危险度分层中的作用。
| [1] | Inaba H, Greaves M, Mullighan CG. Acute lymphoblastic leukaemia[J]. Lancet, 2013, 381(9881): 1943-1955. |
| [2] | 李钱程, 张龚巍, 张欣贤, 等. 儿童急性白血病中枢神经系统颅脑浸润CT 与MRI 表现[J]. 临床放射学杂志, 2015, 34(10): 1642-1645. |
| [3] | Bhojwani D, Sabin ND, Pei D, et al. Methotrexate-induced neurotoxicity and leukoencephalopathy in childhood acute lymphoblastic leukemia[J]. J Clin Oncol, 2014, 32(9): 949-959. |
| [4] | Moricke A, Zimmermann M, Reiter A, et al. Long-term results of five consecutive trials in childhood acute lymphoblastic leukemia performed by the ALL-BFM study group from 1981 to 2000[J]. Leukemia, 2010, 24(2): 265-284. |
| [5] | 方建培, 罗学群, 屠立明, 等. GZ-2002急性淋巴细胞白血病化疗方案治疗非高危儿童急性淋巴细胞白血病多中心协作临床研究[J]. 中国小儿血液与肿瘤杂志, 2011, 16(2): 60-65. |
| [6] | Badr MA, Hassan TH, El-Gerby KM, et al. Magnetic resonance imaging of the brain in survivors of childhood acute lymphoblastic leukemia[J]. Oncol Lett, 2013, 5(2): 621-626. |
| [7] | 何莉, 熊婕, 胡宛如, 等. 儿童急性淋巴细胞白血病并发可逆性后部白质脑病综合征1例[J]. 中国当代儿科杂志, 2011, 13(3): 261-262. |
| [8] | Ulu EMK, Tore HG, Bayrak A, et al. MRI of central nervous system abnormalities in childhood leukemia[J]. Diagn Interv Radiol, 2009, 15(2): 86-92. |
| [9] | Temming P, Jenney MEM. The neurodevelopmental sequelae of childhood leukaemia and its treatment[J], Arch Dis Child, 2010, 95(11): 936-940. |
| [10] | Porto L, Kieslich M, Schwabe D, et al. Central nervous system imaging in childhood leukemia[J]. Eur J Cancer, 2004, 40(14): 2082-2090. |
| [11] | Satomi K, Yoshida M, Matsuoka K, et al. Myelopathy mimicking subacute combined degeneration in a Down syndrome patient with methotrexate treatment for B lymphoblastic leukemia: report of an autopsy case[J]. Neuropathology, 2014, 34(4): 414-419. |
| [12] | 周溦, 李军民. 急性淋巴细胞白血病中枢浸润的机制及早期评估[J]. 中国实用血液学杂志, 2013, 21(5): 1361-1364. |
| [13] | Reddick WE, Laningham FH, Glass JO, et al. Quantitative morphologic evaluation of magnetic resonance imaging during and after treatment of childhood leukemia[J]. Neuroradiology, 2007, 49(11): 889-904. |
| [14] | Iuvone L, Mariotti P, Colosimo C,et al. Long-term cognitive outcome, brain computed tomography scan, and magnetic resonance imaging in children cured for acute lymphoblastic leukemia[J]. Cancer, 2002, 95(12): 2562-2570. |
 2016, Vol. 18
2016, Vol. 18