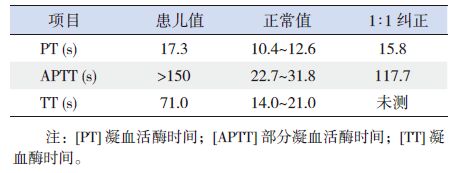
患儿男,8岁,2岁时外伤后易流血不止,反复皮肤瘀斑及关节血肿。7岁因膝关节血肿无法行走,就诊于当地医院,血常规检查示血小板数正常,肝肾功能无异常。多次行凝血功能检查,示凝血活酶时间(PT)15~21.2 s( 参考值10.5~13.5 s),活化部分凝血活酶时间(APTT)及凝血酶时间(TT)测不出;凝血因子活性Ⅷ23.4%(参考值50%~150%),凝血因子Ⅸ 3.7%(参考值60%~120%)。诊断为血友病乙,予凝血酶原复合物输注无明显效果。就诊于我院后查血、尿、便常规及肝肾功能、心肌酶均正常。血管性血友病因子vWF(-)。凝血功能及APTT 纠正试验结果见表 1,提示正常血浆纠正试验仅部分纠正。Ⅷ因子抑制物阴性,凝血因子活性检测:F Ⅷ :C19.4%,F Ⅸ 6.8%,F Ⅺ 10.8%,F Ⅻ 9.0%,均降低,但经过稀释试验显示凝血因子Ⅷ、Ⅸ活性均正常,提示血液中存在凝血因子抑制物。抗凝血酶AT- Ⅲ为181%,蛋白S 活性为62%,蛋白C 活性为0。鼠药等毒物筛查(-)。狼疮抗凝物、抗心磷脂抗体谱为阴性;血清免疫固定电泳(-)。全身弥散加权成像未见明显异常。抗核抗体ANA、抗可提取组织抗原抗体抗ENA(-)、抗中性粒细胞胞浆抗体ANCA(-)。乙肝、丙肝、梅毒、艾滋抗体均阴性,EB 病毒抗体IgA、IgM 均阴性,TORCH-IgM,真菌D 葡聚糖试验、降钙素原均阴性,淋巴细胞培养+ 干扰素A+B 均阴性。
|
|
表 1 患儿入院后凝血功能检查结果 |
本患儿临床特点主要为自幼起病,慢性病程,反复出血倾向。患儿初步筛查血小板计数及功能正常,以凝血时间APTT 及TT 延长为主,且表现出如血流不止、关节血肿等类似血友病表现,高度提示先天遗传性疾病或终身出血倾向。APTT 明显延长者,需行正常人血浆1 : 1纠正试验,如能纠正,提示为体内凝血因子缺乏,如完全不被纠正,提示为抗凝物存在;如能部分纠正,提示可能有凝血因子抑制物存在,需进一步寻找。本患儿血浆纠正试验为部分纠正,但获得性血友病常见的抗凝物检测如凝血因子Ⅷ抑制物、抗心磷脂抗体、狼疮抗凝物为阴性,提示该患儿存在临床少见抗凝物。可将凝血酶诱导的血小板聚集试验作为过筛试验,以帮助确定体内抗凝物作用的靶点为凝血酶。通过检索文献发现国际上已有报道Pittsburgh 突变导致α1抗胰蛋白酶抗凝血酶功能增强,故进一步行血清蛋白电泳图谱检查及基因检测。
3 进一步检查(1)凝血酶诱导的血小板聚集试验:血小板对浓度为1 U/mL 的凝血酶无聚集,而凝血酶终浓度为2 U/mL 时,血小板聚集恢复正常,提示血浆中存在凝血酶的抑制物;而ADP 诱导的血小板聚集试验正常。通过凝血酶诱导的血小板聚集试验,确定体内抗凝物作用的靶点为凝血酶。
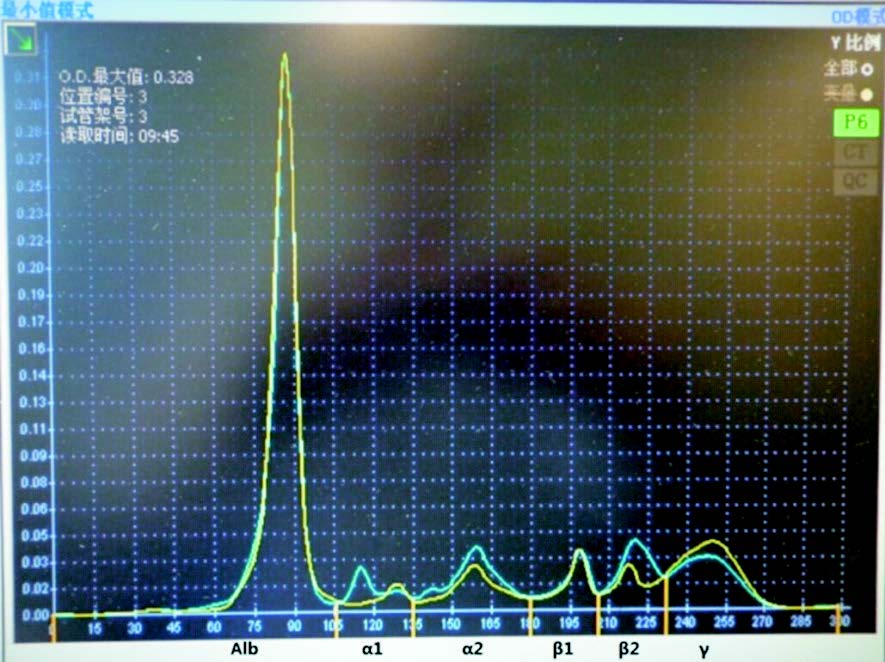
(2)血清蛋白电泳:血清蛋白电泳图谱可见α1蛋白峰异常(图 1),提示患儿体内存在α1蛋白异常。
|
图 1 血清蛋白电泳图谱 可见α1有异常蛋白峰(箭 头所示)。黄色线:正常对照;蓝色线:患者。 |
(3)基因检测确定病因系α1抗胰蛋白酶的Pittsburgh 突变。α1抗胰蛋白酶Pittsburgh 突变的特征是α1抗胰蛋白酶活性中心358位上的甲硫氨酸- 丝氨酸(Met-Ser)为甲硫氨酸- 精氨酸(Met-Arg)所取代。这一氨基酸替代使α1抗胰蛋白酶原本的抗弹性蛋白酶活性丧失,而其抗凝血酶活性却显著增强,造成出血倾向。
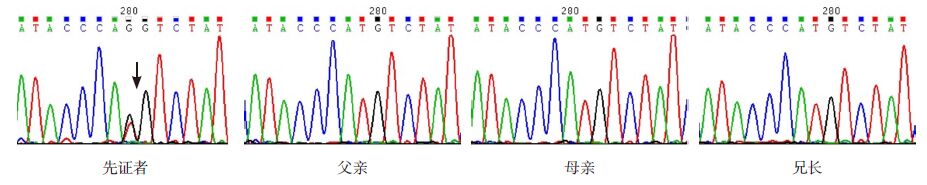
4 确诊依据根据患儿临床出血表现的特点以及最终的基因检测分析结果,该患儿确诊为α1抗胰蛋白酶的Pittsburgh 突变。确诊依据包括:(1)患儿反复皮肤瘀斑、关节血肿;(2)筛查血小板数、vWF 正常,凝血功能APTT、PT 明显延长,且不为正常1 : 1血浆完全纠正;(3)TT 明显延长;(4)凝血酶诱导的血小板聚集试验(+),随着凝血酶浓度增高,血小板聚集功能逐渐恢复正常;(5)SERPINA1基因分析检测到Pittsburgh 突变。经外周血α1抗胰蛋白酶基因SERPINA1(NM_000295.4)基因检测发现患儿为新生杂合Pittsburgh 突变:c.1145T>G,p.M382R 。测序结果见图 2。
|
图 2 患儿全家SERPINA1基因Pittsburgh 突变测序图 先证者为杂合错义突变c.1145T>G,p.M382R(箭头 所指为突变位点),其父母及兄长该位点均为野生型,可见先证者为新生突变。 |
患儿经基因诊断确诊为α1抗胰蛋白酶Pittsburgh 突变后,向家长宣教减少诱因,并积极治疗感染、外伤等急性应激反应,以减少α1抗胰蛋白酶的大量产生。患儿目前病情平稳,规律随访中,暂未出现大出血等表现。
6 讨论凝血功能异常是小儿血液科医师常遇到的临床问题,而抗凝血酶物质存在导致终身出血倾向非常罕见,Pittsburgh 突变的特征是α1抗胰蛋白酶活性中心358位上的甲硫氨酸- 丝氨酸(Metser)为甲硫氨酸- 精氨酸(Met-Arg)所取代,导致抗凝血酶功能增强,因第1例于1978年美国匹兹堡报告[1],故现在命其为匹兹堡突变(Pittsburghmutation)。α1抗胰蛋白酶Pittsburgh 突变使α1抗胰蛋白酶原本的抗弹性蛋白酶活性丧失,而其抗凝血酶活性却显著增强,造成出血倾向[2, 3, 4]。临床罕见,儿科医师认识不足,同时临床表现的隐匿性导致容易出现漏诊,而与血友病类似的出血倾向又容易误诊。正常α1抗胰蛋白酶在许多炎症性肺疾病(如肺气肿、肺囊性纤维化、急性呼吸道窘迫综合征和急慢性支气管炎等)的发病机制中占有重要地位。其生理功能在于抑制肺脏弹性蛋白酶的活性,保护肺部不受弹性蛋白酶的酶解损伤,对凝血酶的抑制作用较弱。α1抗胰蛋白酶Pittsburgh 突变使α1抗胰蛋白酶原本的抗弹性蛋白酶活性丧失,而其抗凝血酶活性却显著增强,造成出血倾向[5, 6]。这种出血倾向与临床上常见的其他出血性疾病相比又有自身的特点,需加以鉴别。
既往文献报道了3例α1抗胰蛋白酶Pittsburgh突变,其中1例男性幼儿生后4周出现消化道出血[7],表现为呕血及便血,反复血尿、血便、多处血肿,18个月时轻微外伤后反复出血不易止住,至10岁时反复出血住院50多次,14岁时死于大出血;1例15岁男孩脊柱侧弯手术前发现凝血功能异常[8],PT、APTT、TT 均明显延长,经基因确诊明确诊断,术后表现为出血倾向,不易止住;1例为16岁女孩黄体破裂大量出血不易止[2],为我院血液科报道,系一家系报道,APTT、PT、TT 均明显延长,其父亲表现为数次外伤后严重出血,APTT、PT 均明显延长。结合本例患儿,提示α1抗胰蛋白酶Pittsburgh 突变主要表现为自幼出现的出血倾向,但此类出血多有明确的诱因,如外伤、手术等应激状况,且不能为正常血浆完全纠正。
最终诊断需SERPINA1基因测序确诊。该病主要需要与出血性疾病进行鉴别诊断,如血小板减少性紫癜、血友病、血管性血友病、获得性血友病等。通过血常规、PT、APTT 检测、vWF 抗原检测、狼疮抗凝物等可提供鉴别诊断的重要依据。如甲型血友病多表现为APTT 明显延长,但1 : 1血浆纠正试验可使APTT 恢复至正常范围。
7 结语α1抗胰蛋白酶Pittsburgh 突变导致出血倾向是一种非常罕见的疾病[9]。同时本例患儿蛋白C活性极低,系代偿性改变,可能维持了患儿出凝血的平衡[8, 9]。本例患儿为新生突变,其父母及哥哥均无突变,结合Hua 等[2] 所报道的家系,父亲及孩子均为杂合的Pittsburgh 突变,证明Pittsburgh突变引发的凝血功能异常可能为常染色体显性遗传模式。此病因罕见,诊断较困难,易造成不同程度的误诊,特别是对于一些严重出血的病例,可能威胁患儿生命。此病目前无有效治疗,因此提高儿科医师对本病的认识十分重要,掌握此病的临床特点和诊断流程,早期诊断,避免不必要的手术,对家长进行宣教,嘱患儿尽量减少外伤,具有非常重要的意义。
| [1] | Lewis JH, Iammarino RM, Spero JA, et al. Antithrombin Pittsburgh: an alpha1-antitrypsin variant causing hemorrhagic disease[J]. Blood, 1978, 51(1): 129-137. |
| [2] | Hua B, Fan L, Liang Y, et al. Alpha1-antitrypsin Pittsburgh in a family with bleeding tendency[J]. Haematologica, 2009, 94(6): 881-884. |
| [3] | Emmerich J. Alpha1-antitrypsin and the maintenance of hemostatic balance[J]. Haematologica, 2009, 94(6): 762-763. |
| [4] | Schapira M, Ramus MA, Jallat S, et al. Recombinant alpha 1-antitrypsin Pittsburgh (Met 358—Arg) is a potent inhibitor of plasma kallikrein and activated factor XII fragment[J]. J Clin Invest, 1986, 77(2): 635-637. |
| [5] | Heeb MJ, Bischoff R, Courtney M, et al. Inhibition of activated protein C by recombinant alpha 1-antitrypsin variants with substitution of arginine or leucine for methionine358[J]. J Biol Chem, 1990, 265(4): 2365-2369. |
| [6] | Scott CF, Carrell RW, Glaser CB, et al. Alpha 1-antitrypsin-Pittsburgh: a potent inhibitor of human plasma factor XIa, kallikrein, and factor XIIf[J]. Trans Assoc Am Physicians, 1985, 98: 344-351. |
| [7] | Owen MC, Brennan SO, Lewis JH, et al. Mutation of antitrypsin to antithrombin. alpha 1-antitrypsin Pittsburgh (358 Met leads to Arg), a fatal bleeding disorder[J]. N Engl J Med, 1983, 309(12): 694-698. |
| [8] | Vidaud D, Emmerich J, Alhenc-Gelas M, et al. Met 358 to Arg mutation of alpha 1-antitrypsin associated with protein C deficiency in a patient with mild bleeding tendency[J]. J Clin Invest, 1992, 89(5): 1537-1543. |
| [9] | Emmerich J, Alhenc-Gelas M, Gandrille S, et al. Mechanism of protein C deficiency in a patient with arginine 358 alpha 1-antitrypsin (Pittsburgh mutation): role in the maintenance of hemostatic balance[J]. J Lab Clin Med, 1995, 125(4): 531-539. |
 2016, Vol. 18
2016, Vol. 18

 , 王薇, 马菁苒
, 王薇, 马菁苒