新生儿缺氧缺血性脑病(hypoxic-ischemicencephalopathy,HIE)是小儿严重的神经系统疾病,病情严重的患儿病死率高,存活者常留有脑瘫、智力低下等神经系统的后遗症。其发病机制尚不完全明确,临床治疗亦缺乏特异性的治疗方案[1]。研究认为细胞坏死、凋亡及自噬是神经元细胞死亡的主要方式。凋亡及自噬为延迟发生,给临床治疗带来了时间窗。明确自噬及凋亡在HIE 的作用及机制,是寻找治疗靶点的关键。多项研究提示多种死亡机制参与了脑缺血后神经元损伤[2, 3]。自噬及凋亡发生的具体机制尚不明确,但是抑制自噬及抗凋亡可逆转神经元损伤,提示抑制自噬及抗凋亡可能成为治疗HIE 的新思路[1]。
PINK1(phosphatase and tensin homolog deletedon chromosome ten induced putative kinase 1) 是一种蛋白激酶,存在于线粒体外膜,在一些高能耗的组织器官,如心、脑、肌肉中高表达[4]。研究发现PINK1能够调控线粒体自噬[5, 6, 7]。越来越多的研究显示线粒体自噬参与了细胞程序性死亡[8, 9, 10]。PINK1可以通过磷酸化丝氨酸蛋白酶Omi/HtrA2来促进细胞凋亡[11];在慢性阻塞性肺病的小鼠模型中,敲除PINK1基因能够明显抑制细胞自噬发生[12]。因此我们推测PINK1可能参与了HIE 过程中的细胞自噬及凋亡的过程。本研究通过建立新生小鼠缺血缺氧性脑损伤(hypoxic-ischemic brain damage,HIBD)模型,模拟HIE 发病过程,通过敲除小鼠PINK1基因,检测小鼠缺血缺氧脑组织中细胞凋亡及自噬情况,研究PINK1基因的敲除对新生小鼠脑损伤中凋亡及自噬的作用,为HIE 的发病机制及寻找新的治疗靶点提供基础实验依据。
1 材料与方法 1.1 主要试剂8% 氧气和92% 氮气混合气(四川大学华西第二医院中央供气站);2,3,5- 氯化三苯基四氮唑(TTC,Sigma,美国);二氨基联苯胺(DAB)显色试剂盒(北京天根生化科技公司);ECL 底物化学发光试剂(Pierce 公司,美国);BCA 蛋白定量检测试剂盒(北京百泰克生物技术有限公司);原位细胞凋亡检测试剂盒(AP,Roche);聚偏氟乙烯(PVDF)膜(O.Roche 公司,瑞士);兔抗鼠β-actin抗体、辣根过氧化物酶标记的抗兔IgG 抗体(SantaCruz 公司,美国);胎牛血清(Gibco 公司,美国);兔抗鼠活化型半胱天冬酶-3(CC3)抗体(CST 公司,美国);兔抗鼠LC3抗体(Novus 公司,美国);荧光标记山羊抗兔IgG 抗体(GeneCopoeia 公司,美国);4,6- 二脒基-2- 苯基吲哚(DAPI)染液(上海碧云天生物技术有限公司);引物的设计与合成由苏州金唯智生物科技公司完成。
1.2 实验动物及分组10日龄野生型(PINK1+/+)新生C57BL/6小鼠和PINK1基因敲除型(PINK1-/-)新生C57BL/6小鼠各72只,雌雄不限,由四川大学华西第二医院姜长安实验室提供。野生型和基因敲除型新生小鼠均分为假手术组及模型组,即野生型假手术组(wild-type sham-operated group,SWT)、野生型模型组(wild-type model group,MWT)、基因敲除假手术组(knock-out sham-operated group,SKO)以及基因敲除模型组(knock-out model group,MKO),每组36只。
1.3模型建立通过改良Rice-Vannucci 法[13] 建立新生小鼠HIBD 模型。将C57BL/6小鼠进行术前称重及编号,乙醚麻醉,于手术台上固定;常规消毒铺巾,颈部正中偏右作长约6 mm 切口;分离并用5-0丝线双重结扎右侧颈总动脉;缝合皮肤切口,术后恢复1 h,然后放入缺氧舱中给予含8% 氧气和92%氮气混合气2.5 h(氧流量2 L/min),即为HIBD模型。而后置于常氧母鼠笼中饲养。假手术组仅作颈部皮肤切口分离右侧颈总动脉,不予结扎,缝合切口,不做缺氧处理。操作过程保持恒温。
1.4 聚合酶链式反应法检测PINK1 基因表达用高压灭菌1.5 mL 离心管,加入适量50 mMNaOH,酒精消毒鼠尾及器械后,剪尾尖1~2 mm置于其中,100℃水浴40 min,观察组织基本溶解时涡漩数秒,加入1 mol/L tris-HCl(pH:8.3),涡漩数秒后14 000转/min 离心5 min,取上清即得基因组DNA。取1 μL DNA 分别加入引物、2×Master Mix 等组成26 μL 反应体系。Pink1引物序列:Common:5'-GAGCCTGAAGTGCAAACTCC-3';WT:5'-GCTCTGGCTTCTGAGGAAGA-3';KO:5'-CTAAAGCGCATGCTCCAGAC-3'。反应条件:95 ℃ 预变性2 min;95 ℃ 变性15 s,64 ℃ 退火15 min,72 ℃ 延伸75 s,3个循环;95 ℃ 变性 15 s,61℃退火15 min,72℃延伸75 s,3个循环;95℃变性15 s,58℃退火15 min,72℃延伸75 s,3个循环;95℃变性15 s,55℃退火15 min,72℃ 延伸75 s,33个循环;最后72℃延伸75 s。PCR产物经1% 琼脂糖凝胶电泳后,在凝胶成像仪长波紫外光下观察条带结果。野生型小鼠扩增片段为350 bp。
1.5 TTC 染色法观察脑组织梗死程度缺氧缺血后24 h,每组取9只小鼠麻醉后,直接取脑,将脑组织放置于脑切片模具中,-20℃冻10~15 min。从视交叉开始沿冠状位向后切片,切片厚度为2 mm。切片后置于2% 浓度的TTC 中,37℃温箱孵育30 min,期间保证脑片均匀接触染液,多聚甲醛固定后观察结果。染色结果红色为正常组织,白色为梗死组织。每个脑组织标本选取4张脑片评估梗死程度,梗死体积通过梗死面积积分公式计算得到[14]。
1.6 TUNEL 法检测脑组织凋亡情况缺氧缺血后24 h,每组取9只小鼠脑组织,固定后放入包埋模框,填入琼脂糖,待琼脂糖完全凝固,修理琼脂糖模块,将组织块固定到托盘上,于震荡切片机上切片,厚度为40 μm,挑片,置于6孔板中,PBS 洗5 min×3,于含0.1% TRITON X-100的0.1% 柠檬酸钠溶液中冰上作用5 min,PBS 洗5 min×3,按比例滴加TUNEL 反应液,37 ℃ 作用1 h,PBS 洗5 min×3,加入DAPI 孵育5 min,PBS 洗5 min×3,滴加抗荧光淬灭剂,封片,在激光共聚焦显微镜(Olympus 公司,日本)下观察结果,每个标本观察3张脑组织切片,每张脑组织切片随机选取3~4个视野,计数凋亡细胞,计算凋亡指数=(凋亡细胞/ 总细胞数)×100%。
1.7 免疫组化法检测促凋亡蛋白CC3 表达水平及分布缺氧缺血后24 h,每组分别取9只小鼠脑组织,常规固定、脱水、包埋制做石蜡切片。将切片脱蜡,梯度酒精水化,微波抗原修复,PBS 充分淋洗后,3% H2O2封闭内源性过氧化氢酶室温避光10 min,PBS 充分淋洗后,山羊血清封闭20 min,加兔抗小鼠CC3抗体(1 : 150)4℃过夜。PBS 充分淋洗后,滴加生物素化的抗兔IgG 抗体孵育20 min,PBS充分淋洗后,滴加HRP- 链酶卵白素,37℃孵育20 min,PBS 充分淋洗后,DAB 显色,适时终止显色, 苏木素复染,适时终止显色,脱水后中性树脂封片,于光学显微镜下(Olympus 公司,日本)观察、拍照。镜下阳性细胞显色为棕黄色。每个标本观察3张脑组织切片,每张脑组织切片随机选取3~4个视野,采用Image Pro Plus 6.0图像分析软件对其进行定量分析。
1.8 免疫荧光法检测自噬相关蛋白LC3表达水平及分布缺氧缺血后24 h,每组取9只小鼠脑组织,固定后放入包埋模框,填入琼脂糖,待琼脂糖完全凝固,修理琼脂糖模块,将组织块固定到托盘上,于震荡切片机上切片,厚度为40 μm,挑片,置于6孔板中,PBS洗5 min×3,于含0.3% TRITON X-100的PBS 溶液中作用30 min,PBS 洗5 min×3,封闭液封闭1 h,置于4℃冰箱,滴加一抗孵育过夜;滴加荧光素标记的二抗,湿盒避光室温孵育1 h;PBS 洗5 min×3,加入DAPI 孵育5 min,PBS 洗5 min×3,滴加抗荧光淬灭剂,封片,在激光共聚焦显微镜下观察结果、拍照。
1.9 Western blot 法检测自噬相关蛋白LC3表达水平LC3是自噬过程中的关键调控蛋白,当细胞自噬被激活时,在Atg4调控下由LC3- Ⅰ型蛋白向LC3- Ⅱ型蛋白(膜结合形式)转变,对自噬体的形成起关键调控作用,LC3- Ⅱ与LC3- Ⅰ的比值常用作检测细胞自噬启动程度的指标[15, 16]。因此本研究采用Western blot 法进一步检测比对两组脑组织中LC3 Ⅱ /LC3 Ⅰ的比值。缺氧缺血后24 h,每组取9只小鼠右侧脑组织,加入蛋白裂解液提取总蛋白,BCA 蛋白定量检测试剂盒测定蛋白浓度,调整蛋白浓度至同一浓度,以60 μg/ 孔上样,在12% 十二烷基硫酸钠- 聚丙烯酰胺凝胶中110 V电泳90 min 后,以0.3 A 转膜70 min 将蛋白转印至PVDF 膜上。5% 脱脂牛奶室温下封闭1h加入一抗,置于摇床室温孵育1h4℃过夜。β-actin抗体作为内参。TBST 洗膜3次,每次7 min,加入辣根过氧化物酶标记的二抗,室温孵育1 h,洗膜3次,每次7 min。在膜上加ECL 发光剂,将膜放入凝胶成像仪成像。采用Quantity one 4.6.2(美国)软件行定量分析。
1.10 统计学分析采用SPSS 19.0统计软件对数据进行统计学处理,计量资料采用均数± 标准差(x±s)表示,两组间比较采用t 检验,多组间比较采用单因素方差分析,组间两两比较采用SNK-q 检验。P<0.05为差异有统计学意义。
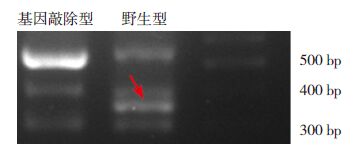
2 结果 2.1 野生型和基因敲除型新生小鼠PINK1基因表达情况PCR 结果表明,野生型(PINK1+/+)小鼠出现一条350 bp 的条带,基因敲除型(PINK1-/-)小鼠未出现350 bp 的条带,见图 1。
|
图 1 野生型和基因敲除型新生小鼠PINK1基因的 表达 野生型(PINK1+/+)小鼠PINK1基因扩增片段长度为 350 bp(箭头所示),PINK1基因敲除(PINK1-/-)小鼠未扩增出 350 bp 片段。 |
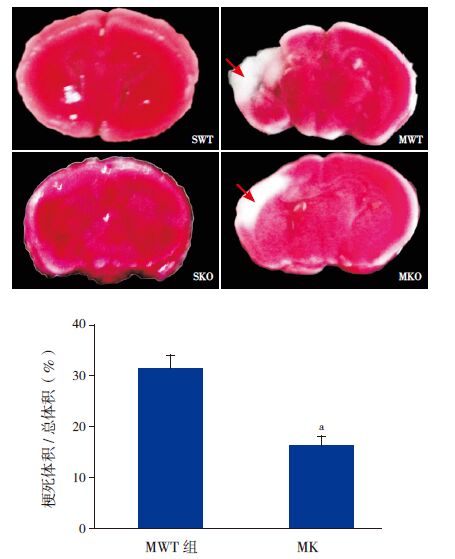
脑组织TTC 染色结果表明:与假手术组相比,新生小鼠缺氧缺血后24h组织梗死明显。MKO组脑梗死体积占脑总体积百分数(16%±3%)低于MWT 组(31%±4%)(t=9.0,P<0.05),提示PINK1基因敲除可致新生小鼠缺氧缺血后24h组织梗死程度减轻。见图 2。
|
图 2 野生型和基因敲除型新生小鼠脑梗死程度比较 上图为TTC 染色结果,箭头所示为梗死区域。下图为统计图(n=9), a 示与MWT 组相比,P<0.05。 |
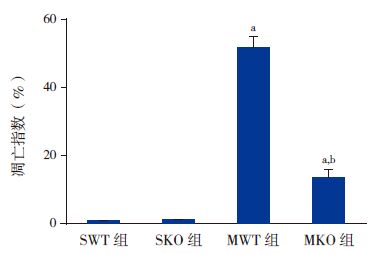
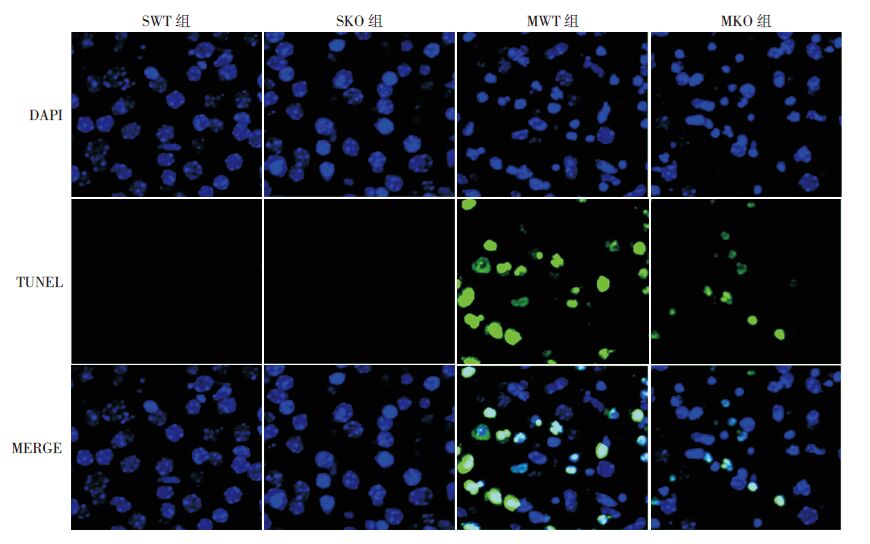
TUNEL 结果表明:SWT 组(0.76%±0.12%)与SKO 组(0.89%±0.36%)几乎不存在细胞凋亡;与各假手术组相比,两模型组凋亡阳性细胞数均明显增加(P<0.05),且MKO 组(13.2%±2.5%)凋亡指数低于MWT 组(51.9%±3.4%)(P<0.05),提示PINK1基因敲除可致新生小鼠缺氧缺血后24h组织细胞凋亡减少。见图 3~4。
|
图 3 各组新生小鼠脑组织细胞凋亡指数比较(n=9) a 示与各型假手术组比较,P<0.05;b 示与MWT 组比较, P<0.05。 |
|
图 4 TUNEL 染色法检测各组新生小鼠脑组织细胞凋亡情况(DAPI,×400) SWT 组和SKO 组几乎不存在 凋亡细胞,MWT 组和MKO 组凋亡细胞均明显增加,且MKO 组凋亡细胞数明显少于MWT 组,阳性凋亡细胞呈绿色荧光。 |
免疫组化结果表明:SWT 组(0.011±0.002)与SKO 组(0.009±0.004)几乎不表达凋亡蛋白;与假手术组相比,MKO 组(0.0878±0.033) 和MWT 组(0.151±0.048)CC3蛋白表达明显增加(P<0.05),且MWT 组CC3蛋白表达水平明显高于MKO 组(P<0.05)。提示PINK1基因敲除新生小鼠在缺氧缺血后24h组织凋亡蛋白CC3表达明显减弱。见图 5~6。
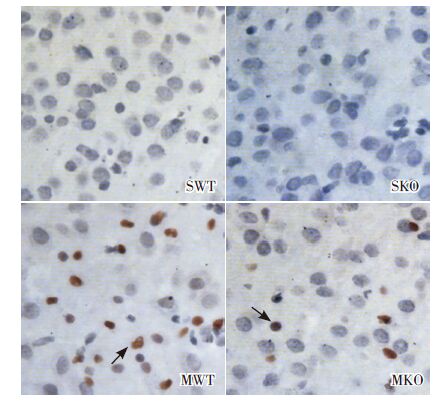
|
图 5 免疫组化检测各组新生小鼠脑组织凋亡蛋白 CC3表达 (DAB 显色,×400),SWT 组和SKO 组均几乎 不表达CC3蛋白;MWT 组和MKO 组CC3蛋白表达均明显增加, CC3蛋白阳性表达呈棕色(箭头所示)。 |
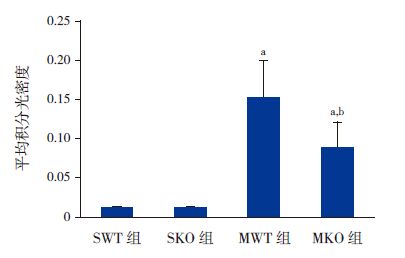
|
图 6 各组新生小鼠脑组织凋亡蛋白CC3表达比较 (n=9)a 示与SWT 组和SKO 组比较,P<0.05;b 示与MWT 组比较,P<0.05。 |
免疫荧光结果表明:SWT 组与SKO 组自噬相关蛋白LC3荧光点数很少;与假手术组相比,两组模型组LC3荧光点数明显增多;与MWT 组相比,MKO 组LC3荧光点数减少,分布弥散,密集程度降低(图 7)。Western blot 结果表明,与SWT 组(0.206±0.049)和SKO 组(0.186±0.061)相比,MWT(0.590±0.117)和MKO 组(0.382±0.089)LC3 Ⅱ /LC3 Ⅰ的比值均升高(P<0.05);且MKO组低于MWT 组(P<0.05)。提示PINK1基因敲除新生小鼠在缺氧缺血后24h组织自噬指标LC3 Ⅱ /LC3 Ⅰ比值明显下降(图 8)。
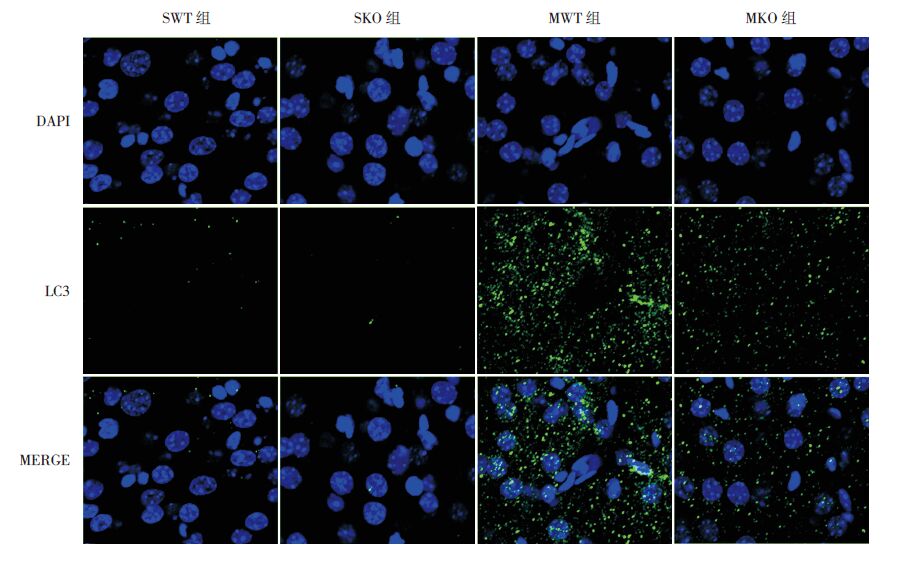
|
图 7 各组脑组织自噬相关蛋白LC3表达 (免疫荧光,×400)SWT 组和SKO 组LC3荧光点数很少;MWT 组 和MKO 组LC3荧光点数明显增多;MKO 组LC3荧光点数及聚集程度较MWT 组减少。 |
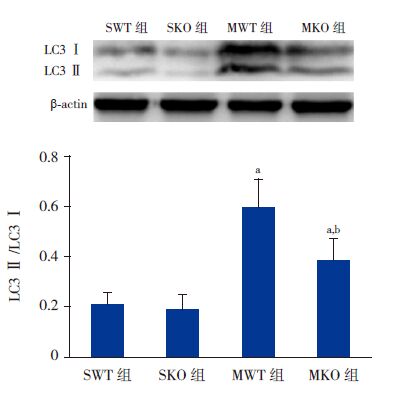
|
图 8 Western blot 检测各组脑组织自噬相关蛋白LC3 表达 上图为电泳条带图,下图为统计图(n=9),a 示与SWT 组和SKO 组比较,P<0.05;b 示与MWT 组比较,P<0.05。 |
细胞凋亡是缺氧缺血时脑损伤的重要机制之一,减少caspase-3表达或增加Bcl-2表达等抗凋亡手段均能对缺氧缺血性脑损伤起到保护作用[1]。PINK1是最早在遗传性帕金森病的筛查中发现的突变基因位点[17]。目前研究认为PINK1能够通过调节线粒体自噬调节细胞凋亡[9, 10, 11]。本研究发现,野生型和基因敲除型假手术组小鼠之间凋亡指标无差异,说明PINK1基因敲除后不会诱发正常脑组织的细胞发生凋亡。与假手术组小鼠相比,缺氧缺血小鼠脑组织发生大量细胞凋亡,是缺氧缺血脑损伤细胞死亡的重要途径。敲除PINK1可以明显降低脑组织细胞凋亡的发生。我们推测敲除PINK1基因后,线粒体膜蛋白发生改变,线粒体损伤介导的细胞凋亡途径被抑制,从而抑制了细胞凋亡的发生。
无论是局灶性缺血还是全脑缺血动物模型中[2, 3],缺氧缺血均能激活脑组织细胞自噬。Puyal等[2] 发现在新生大鼠短暂性大脑中动脉闭塞模型中,缺血核心区自噬体指标LC3 Ⅱ水平在再灌注后2h始升高,并持续至24 h,电子显微镜下观察可见大量自噬体的形成。不同的研究结果表明,在缺氧缺血性脑损伤中,自噬激活的程度和持续时间不同,对脑组织的作用存在差异。在正常情况下及轻度缺氧缺血时,存在一定水平的自噬维持细胞稳态;而在严重缺氧缺血状态下,自噬被过度激活促进细胞死亡[6, 7]。本研究发现,野生型和基因敲除型假手术组小鼠之间自噬指标无差异,说明PINK1基因敲除后不会激活正常脑组织的细胞自噬。与假手术组小鼠比较,缺氧缺血小鼠脑组织自噬明显被激活,而过度的自噬导致脑组织损伤加重。与野生模型组相比,PINK1基因敲除模型组脑组织LC3荧光点数分布弥散,点状聚集减少,密集程度降低;LC3蛋白表达减弱,同时LC3 Ⅰ向LC3 Ⅱ的转化也减少,说明敲除PINK1可明显抑制细胞自噬水平。我们推测敲除PINK1后,由于线粒体外膜缺乏PINK1蛋白,细胞自噬的识别反应受到干扰,抑制了细胞自噬的发生。本研究发现了PINK1在HIBD 模型中对细胞自噬及细胞凋亡的影响,但具体的分子机制尚需进一步阐明。本研究初步揭示抑制PINK1对新生10日龄小鼠缺血缺氧脑损伤可能具有神经保护作用,为HIE 治疗提供了新思路。
| [1] | Dixon BJ, Reis C, Ho WM, et al. Neuroprotective strategies after neonatal hypoxic ischemic encephalopathy[J]. Int J Mol Sci, 2015, 16(9): 22368-22401. |
| [2] | Puyal J, Vaslin A, Mottier V, et al. Postischemic treatment of neonatal cerebral ischemia should target autophagy[J]. Ann Neurol, 2009, 66(3): 378-389. |
| [3] | Wang JY, Xia Q, Chu KT, et al. Severe global cerebral ischemiainduced programmed necrosis of hippocampal CA1 neurons in rat is prevented by 3-methyladenine: a widely used inhibitor of autophagy[J]. J Neuropathol Exp Neurol, 2011, 70(4): 314-322. |
| [4] | Deas E, Plun-Favreau H, Wood NW. PINK1 function in health and disease[J]. EMBO Mol Med, 2009, 1(3): 152-165. |
| [5] | Youle RJ, Narendra DP. Mechanisms of mitophagy[J]. Nat Rev Mol Cell Biol, 2011, 12(1): 9-14. |
| [6] | Springer W, Kahle PJ. Regulation of PINK1-Parkin-mediated mitophagy[J]. Autophagy, 2011, 7(3): 266-278. |
| [7] | Green DR, Galluzzi L, Kroemer G. Mitochondria and the autophagy-inflammation-cell death axis in organismal aging[J]. Science, 2011, 333(6046): 1109-1112. |
| [8] | Su Z, Yang Z, Xu Y, et al. Apoptosis, autophagy, necroptosis, and cancer metastasis[J]. Mol Cancer, 2015, 14: 48. |
| [9] | Lalaoui N, Lindqvist LM, Sandow JJ, et al. The molecular relationships between apoptosis, autophagy and necroptosis[J]. Semin Cell Dev Biol, 2015, 39: 63-69. |
| [10] | Wu HJ, Pu JL, Krafft PR, et al. The molecular mechanisms between autophagy and apoptosis: potential role in central nervous system disorders[J]. Cell Mol Neurobiol, 2015, 35(1): 85-99. |
| [11] | Niemi NM, MacKeigan JP. Mitochondrial phosphorylation in apoptosis: flipping the death switch[J]. Antioxid Redox Signal, 2013, 19(6): 572-582. |
| [12] | Mizumura K, Cloonan SM, Nakahira K, et al. Mitophagydependent necroptosis contributes to the pathogenesis of COPD[J]. J Clin Invest, 2014, 124(9): 3987-4003. |
| [13] | Nakanishi N, Tu S, Shin Y, et al. Neuroprotection by the NR3A subunit of the NMDA receptor[J]. J Neurosci, 2009, 29(16): 5260-5265. |
| [14] | Swanson RA, Morton MT, Tsao-Wu G, et al. A semiautomated method for measuring brain infarct volume[J]. J Cereb Blood Flow Metab, 1990, 10(2): 290-293. |
| [15] | Satoh J, Motohashi N, Kino Y, et al. LC3, an autophagosome marker, is expressed on oligodendrocytes in Nasu-Hakola disease brains[J]. Orphanet J Rare Dis, 2014, 9: 68. |
| [16] | Xiong T, Qu Y, Mu D, et al. Erythropoietin for neonatal brain injury: opportunity and challenge[J]. Int J Dev Neurosci, 2011, 29(6): 583-591. |
| [17] | Scarffe LA, Stevens DA, Dawson VL, et al. Parkin and PINK1: much more than mitophagy[J]. Trends Neurosci, 2014, 37(6): 315-324. |
 2016, Vol. 18
2016, Vol. 18

