新生儿缺氧缺血性脑损伤(hypoxic-ischemicbrain damage,HIBD)性疾病的患儿常遗留精神运动发育障碍、睡眠觉醒周期颠倒[1]、激素内分泌节律紊乱[2] 等问题,严重影响患儿生存质量。前期研究发现:HIBD 后褪黑素(melatonin,MT)分泌降低,褪黑素受体1[3]、糖皮质激素受体[4]、胰岛素样生长因子1[5] 基因表达水平下调,而皮质酮[4]、生长激素[6] 等相关基因表达水平升高,表明缺氧缺血可导致多器官系统功能的节律紊乱。此外,越来越多的证据表明缺氧可影响钟基因的表达[7],提示生物钟系统的紊乱也可能参于HIBD 的发病。Clock 是哺乳动物昼夜生物钟节律的一个重要正性调节因子,主要生理作用是直接影响哺乳动物节律周期性和持续性。一旦生物钟系统表达异常,常导致肿瘤、糖尿病、高血压、脂肪代谢障碍、睡眠障碍等疾病发生率的增加[8]。
松果体作为一个神经内分泌器官,既发挥中枢昼夜节律振荡器的功能,又能合成MT 而发挥内分泌输出效应。有研究发现松果体中包含了以细胞微粒子形式存在的小RNA(microRNA,miRNA)[9],miRNA 普遍存在于真核细胞中,进化上高度保守,表达具有时空特异性。成熟miRNA 主要通过与靶mRNA 的3'- 非编码区、5'- 非编码区和编码区域的碱基互补配对抑制靶mRNA 翻译,在转录后水平调控靶基因表达[10]。目前miRNA 的研究主要集中在肿瘤疾病的诊断,最近的研究发现miRNA还是昼夜节律的重要调节因子[11]。因此,本研究拟应用miRNA 表达谱芯片、实时荧光定量PCR(RT-PCR)等相关技术来检测HIBD 新生大鼠松果体miRNA 差异表达,探索miRNA 在HIBD 节律紊乱中的作用。
1 材料与方法 1.1 实验动物分组和HIBD 模型制作选择SPF 级健康7日龄Sprague-Dawley(SD)新生大鼠,雌雄不限,均在光照- 黑暗交替条件下饲养,由母鼠自由哺喂,所有实验动物均购自上海斯莱克实验动物有限责任公司。
将新生大鼠随机分成HIBD 模型组和假手术组,HIBD 模型的制作根据Rice-Vannucci 法[12],新生SD 大鼠乙醚吸入麻醉,仰卧位固定于手术板,颈部正中作1 cm 纵型切口,分离左颈总动脉并双层丝线永久性结扎,缝合切口后置于37℃暖箱中恢复2 h,然后置于37℃暖箱中的密闭常压低氧舱,给予湿化的8% 氮氧混合气2 h,流量为1.5 L/min,测氧仪监测氧浓度,模型制作完毕后送回母鼠身边饲养。假手术组仅分离出左颈总动脉,不予结扎,不予低氧处理。
1.2 miRNA 的基因芯片筛选分别取模型制造后24hHIBD 模型组和假手术组各6只大鼠,断头取脑后,低温快速分离出松果体组织,常规方法抽提RNA,分光光度仪测定RNA 浓度和纯度,所取样本OD260/OD280比值均大于1.8。应用Exiqon 公司生产的miRNA 芯片miRCURY(TM) LNA Array(v.18.0) 进行检测,对HIBD 模型组和假手术组松果体样本进行差异表达的miRNA 的筛选,操作步骤按试剂盒操作流程进行。杂交芯片图像扫描后,所得数据使用Genepix Pro V6.0软件分析,通过原始值减去背景值来修正,并用中值标准化,分别计算出两种样本中miRNA 的标准值及比值。
1.3 miRNA 的RT-PCR 验证根据miRNA 基因芯片结果,筛选出HIBD模型组较假手术组表达明显上调的miRNA 有miRNA-200a-3p、-9a-5p、-375-3p、-141-3p、-182等;表达明显下调的miRNA 有miRNA-291a-5p、-935、-125b-1-3p、-294、-204-3p 等,对其中部分miRNA 进行RT-PCR 验证。分别取模型制造后24hHIBD 模型组和假手术组各6只大鼠,松果体组织总RNA 提取方法同1.2小节。
(1)引物设计:从miRbase 中调取基因芯片筛选出的HIBD 松果体中差异性表达的miRNA序列,根据通用茎环引物法[13],并利用PrimerPremier 5.0引物设计软件设计PCR 引物。引物序列见表 1。
|
|
表 1 miRNA 引物序列 |
(2)cDNA 制备及RT-PCR:取2.0 μg 上述组织样本抽提的总RNA 作为初始模板,进行逆转录后,采用RT-PCR 技术测定松果体细胞中miRNA的相对表达量。PCR 反应体系内含cDNA 2 μL,2*SYBR Green PCR minaster Mix 10 μL,miRNA 上下游引物各1 μL,用去离子水补至反应体积为20 μL。按上述反应体系加样,每个样品重复3次,荧光定量PCR 仪上进行PCR 扩增,设置反应条件为:95℃预变性10 min;95℃变性15 s,60℃退火15 s,72℃延伸30 s,72℃收集荧光,共45个循环。循环结束后做相应的溶解曲线,运用Light Cyler480自带的软件进行实时数据收集和定量分析,记录相应Cp 值,基因相对表达量采用公式2-ΔCt 方法计算,以此判定各样本中 miRNA 表达量的差异。
1.4 miRNA-182在各组织中的表达差异基因芯片鉴定同时采用RT-PCR 方法结论一致的miRNA 确定为有意义的共同差异表达miRNA,其中miRNA-182是本研究鉴定得到的候选miRNA 之一。
miRNA 的组织分布及表达量与其功能有密切关系[14],因此需进一步验证miRNA-182在不同组织的表达情况。取正常7日龄SD 大鼠3只,颈椎脱臼法处死后分别取肺、肠、胃、肾、大脑皮层、松果体组织,冰冻粉粹标本后,按常规方法抽提RNA,按上述方法进行cDNA 合成并行RT-PCR 检测,判定各样本中miRNA-182的表达差异。
1.5 HIBD 后松果体中miRNA-182及钟基因Clock mRNA 的表达情况本研究利用TargetScan、PicTar 和miRanda3种生物信息学分析软件预测miRNA-182下游可能的靶基因,取3者交集发现,钟基因家族中的Clock 可能是其潜在作用靶点,行RT-PCR 检测HIBD 后松果体中miRNA-182与Clock 基因有无表达变化相关性。
分别于HIBD 后0 h( 为中午12时,余推算)、24 h、48h72 h 4个时间点( 地点、光线均相同),每组各取6只新生大鼠,松果体组织总RNA 提取方法同1.2小节。采用RTPCR法检测松果体中miR-182及钟基因Clock 的表达水平变化。引物序列如下:钟基因Clock:F:5'-TGCCAGATCATGAGAAGATG-3',R:5'-CGCTGCTCTAGCTGGTCTTT-3'。内参β-actin:F : 5 ' -C C C A T C T A T G A G G G T T A C G C -3 ' ,R :5'-TTTAATGTCACGCACGATTTC-3’。反应体系和反应条件同1.3小节。
1.6 统计学分析运用SPSS 17.0统计软件对数据进行统计学分析,正态分布计量资料以均数± 标准差(x±s)表示,若方差齐性,则两组间比较采用t 检验,多组间比较采用方差分析;若方差不齐,则采用Kruskal-Wallis H 检验,差异有统计学意义时采用Nemenyi 法行组间两两比较,P<0.05为差异有统计学意义。
2 结果 2.1 miRNA 的基因芯片筛选结果根据HIBD 模型组及假手术组标准化数值,计算每个基因的差异倍数(Fold change,FC)来观察表达差异。FC>2及<0.5的共有209个miRNA表达,其中表达上调的有92个,表达下调的有117个。与假手术组相比,挑选出HIBD 造模后24h达上调倍数最高的11个miRNA 有miRNA-200a-3p、-9a-5p、-375-3p、-141-3p、-9a-3p、-182、-7a-5p、-200c-3p、-106b-5p、-30c-5p、-19b-3p; 表达下调倍数最高的10个miRNA 有miRNA-291a-5p、-935、-125b-1-3p、-294、-204-3p、-21-3p、-300-5p、-207、-665、-433-5p,见表 2。
|
|
表 2 HIBD 组与假手术组松果体中差异表达的miRNAs |
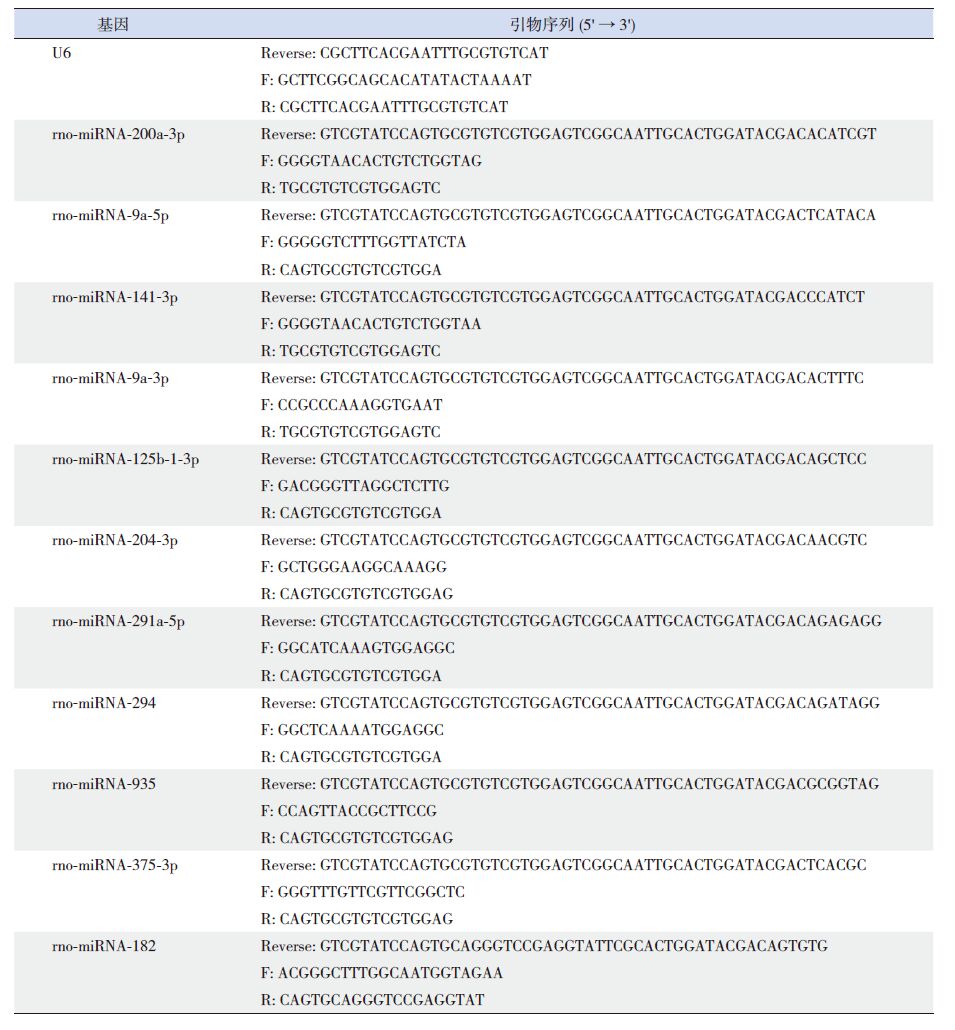
RT-PCR 结果与芯片结果一致的有miRNA-200a-3p、-375-3p、-141-3p、-182在 HIBD 后表达明显上调,miRNA-935、-204-3p、-294在HIBD 后表达明显下调,部分结果如下(表 3)。在HIBD组与假手术组中,miRNA-182、-375-3p、-141-3p及-200a-3p 的差异表达有统计学意义(P<0.05),且本研究发现RT-PCR 检测的几个miRNA 中,miR-182在HIBD 松果体样本中稳定高表达。
|
|
表 3 假手术组和HIBD 组新生大鼠松果体miRNA 的表达水平比较(x±s,×10-5) |
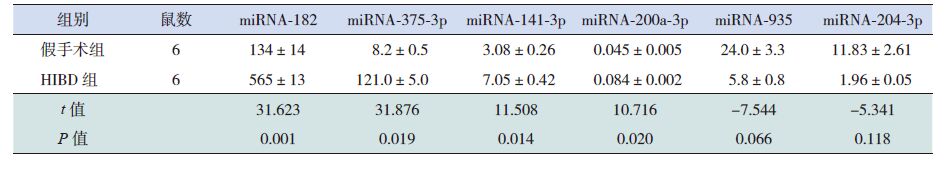
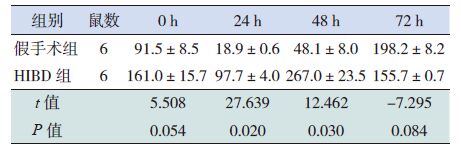
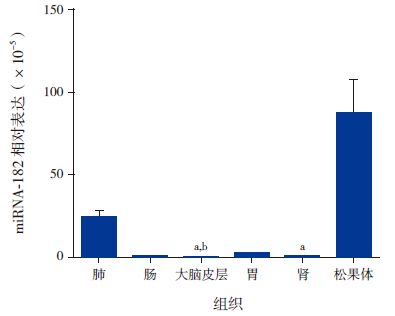
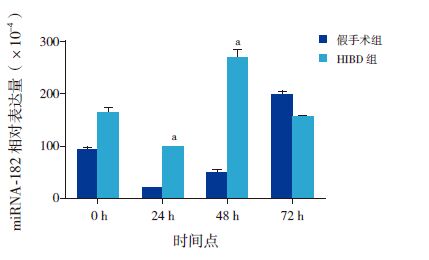
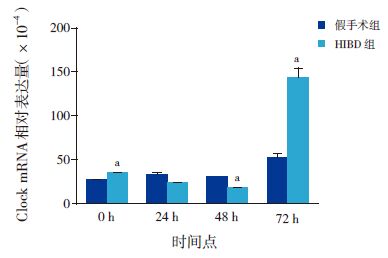
miRNA-182在正常7日龄新生SD 大鼠松果体组织中呈高表达,在肺组织中有表达,在其他脏器如胃肠、大脑皮层、肾脏中表达微量(图 1)。miRNA-182在各组织间的表达差异有统计学意义(H=16.392,P=0.006),其中miRNA-182在大脑皮层及肾组织中的表达量较松果体组织中明显减低(P<0.05),miRNA-182在大脑皮层中的表达量较肺组织中明显减低(P<0.05)。于对应时间点的假手术组(P<0.05);而HIBD 后0 h、72 h miR-182的表达水平与对应时间点假手术组相比,差异无统计学意义(P>0.05)(图 2,表 4)。与对应时间点假手术组相比,HIBD 后0 hClock mRNA 表达水平升高,48h降低,72h明显升高(P<0.05);而24 h Clock mRNA 表达水平与对应时间点假手术组相比,差异无统计学意义(P>0.05)(图 3,表 5)。
|
图 1 miRNA-182在各组织中的表达差异 (n=3) a 示与松果体组织比较,P<0.05;b 示与肺组织比较,P<0.05。 |
|
图 2 两组HIBD 后各时间点miRNA-182的表达变化 (n=6)a 示与假手术组相比,P<0.05。 |
|
图 3 两组HIBD 后Clock mRNA 的表达变化 (n=6) a 示与假手术组相比,P<0.05。 |
|
|
表 4 两组新生大鼠各时间点松果体miRNA-182的表达 水平比较(x±s,×10-4) |
|
|
表 5 两组新生大鼠各时间点松果体Clock mRNA 的表达 水平比较(x±s,×10-4) |
Clock mRNA 的表达情况HIBD 后24 h、48 h miRNA-182的表达水平高于对应时间点的假手术组(P<0.05);而HIBD 后0 h、72 h miR-182的表达水平与对应时间点假手术组相比,差异无统计学意义(P>0.05)(图 2,表 4)。与对应时间点假手术组相比,HIBD 后0 hClock mRNA 表达水平升高,48h降低,72h明显升高(P<0.05);而24 h Clock mRNA 表达水平与对应时间点假手术组相比,差异无统计学意义(P>0.05)(图 3,表 5)。
3 讨论miRNA 是一类高度保守的非编码小分子单链RNA。大量研究表明miRNA 在生命发育进程中扮演着关键角色,至少能直接调控30% 的人类基因表达[15]。miRNA 参与了许多疾病的生理和病理过程,例如组织发育、组织器官形成、细胞凋亡、细胞增殖、肿瘤发生等。可见,miRNA 在机体基因表达调控中发挥着重要作用。研究发现miRNA是昼夜节律重要的调节因子,miRNA-122可以通过调节Nocturnin 基因的表达来参与肝脏昼夜节律的调节[16],miRNA-483通过调节靶基因芳香烷基胺-N- 乙酰基转移酶来调控大鼠松果体MT 的合成[17]。因此,本研究拟探索HIBD 生理及病理过程中发挥作用的miRNA 及其作用,为进一步明确HIBD 中昼夜节律紊乱的内在分子机制提供理论依据。本研究中通过基因芯片技术检测出HIBD 后表达差异倍数明显(FC>2及<0.5)的miRNA 209个,我们从中挑选出差异表达最明显的11个miRNA进行RT-PCR 验证,两种方法结论一致的候选miRNA 确定为有意义的共同差异表达miRNA,其中miRNA-182是本研究鉴定得到的候选miRNA 之一。基因芯片筛选及RT-PCR 验证中均显示HIBD后新生大鼠松果体中miRNA-182表达上调,且与假手术组比较差异性表达有统计学意义;RT-PCR发现miRNA-182在HIBD 样本中稳定高表达,且生物信息学分析结果显示miRNA-182在进化上高度保守,提示其潜在功能的重要性。近期的研究发现,重度抑郁症患者存在miRNA-182前体形成异常,从而影响成熟miRNA-182的表达,导致患者出现失眠等节律紊乱现象[18]。以上结果提示miRNA-182可能参与了HIBD 后昼夜节律紊乱的病理生理过程。
miRNA 在组织中的表达量与其功能密切相关,明确miRNA 的组织表达量对于其功能研究很重要。肝脏组织特异性表达miRNA-122[19],脑组织特异性表达miRNA-9[20] 和miRNA-124a[21],横纹肌组织特异性表达miRNA-1/206和miRNA-133[22],这些miRNA 的特异性表达与相应组织器官特殊的生理结构和功能密切相关。本研究使用RT-PCR 的方法,检测miRNA-182在主要脏器中的表达,结果发现miRNA-182在正常7日龄新生SD 大鼠松果体组织中呈高表达,在肺组织中有表达,但含量较低,在其他脏器如胃肠、大脑皮层、肾脏中表达微量。根据表达水平和功能的相关性,本研究推测miRNA-182可能参与松果体的重要病理生理过程。
认识miRNA 的作用机制,关键是认识miRNA及其靶基因的相互作用。TargetScan、PicTar 和miRanda 是目前认为常用而准确的靶基因预测软件[23],本研究利用TargetScan、PicTar 和miRanda三种生物信息学分析软件预测miRNA-182下游可能的靶基因,取三者交集发现,钟基因家族中的Clock 可能是其潜在作用靶点,Clock 序列中的“UUGCCAAA”碱基序列和不同物种miRNA-182的保守序列“AACGGUUU”匹配。昼夜节律生物钟系统维系着机体的正常生物节律,Clock 是哺乳动物昼夜生物钟节律的一个重要正性调节因子,因此,本研究通过检测HIBD 后,不同时间点松果体中miRNA-182与Clock 的表达变化来初步明确两者的相关性。本研究通过RT-PCR 技术检测到在HIBD 后0、24、48h型组的miRNA-182表达量较假手术组升高,72h达较假手术组降低,其中24h48h差异表达有统计学意义;钟基因Clock mRNA 在HIBD 后0h达水平较假手术组升高,24 h、48 h Clock mRNA 表达降低,72 h后明显升高,其中0 h、48h72h差异表达有统计学意义。结果显示,新生大鼠HIBD 后松果体miRNA-182与Clock mRNA的表达有一定的相关性,呈负向调节,但不完全相关,考虑因机体是一个复杂的调控系统,存在众多的神经、内分泌等调控机制,所以实验数据有一定的局限性,还需体外实验等来进一步的验证。
综上所述,在HIBD 松果体损伤的病理生理过程中,miRNA 的表达有明显变化,特别是miRNA-182可能参与HIBD 后的昼夜节律紊乱,本研究为HIBD 的节律紊乱机制提供了新线索,为HIBD 的治疗提供了新的靶点。
| [1] | Takenouchi T, Rubens EO, Yap VL, et al. Delayed onset of sleep-wake cycling with favorable outcome in hypothermictreated neonates with encephalopathy[J]. J Pediatr, 2011, 159(2): 232-237. |
| [2] | Smith AL, Alexander M, Rosenkrantz TS, et al. Sex differences in behavioral outcome following neonatal hypoxia ischemia: insights from a clinical meta-analysis and a rodent model of induced hypoxic ischemic brain injury[J]. Exp Neurol, 2014, 254: 54-67. |
| [3] | 王莹, 杨祖铭, 朱海娟, 等. 缺氧缺血性脑损伤新生大鼠褪黑素受体的变化[J]. 临床儿科杂志, 2009, 27(4): 368-370, 374. |
| [4] | 王莹, 杨祖铭, 朱海娟, 等. 褪黑素对 HIBD 新生大鼠皮质酮及糖皮质激素受体 mRNA 的影响[J]. 临床儿科杂志, 2010, 28(3): 278-281. |
| [5] | Liu W, D'Ercole JA, Ye P. Blunting type 1 insulin-like growth factor receptor expression exacerbates neuronal apoptosis following hypoxic/ischemic injury[J]. BMC Neurosci, 2011, 12: 64. |
| [6] | Alba-Betancourt C, Luna-Acosta JL, Ramirez-Martinez CE, et al. Neuro-protective effects of growth hormone (GH) after hypoxia-ischemia injury in embryonic chicken cerebellum[J]. Gen Comp Endocrinol, 2013, 183: 17-31. |
| [7] | Lundkvist GB, Sellix MT, Nygård M, et al. Clock gene expression during chronic inflammation induced by infection with Trypanosoma brucei brucei in rats[J]. J Biol Rhythms, 2010, 25(2): 92-102. |
| [8] | Ishida N. Circadian clock, cancer and lipid metabolism[J]. Neurosci Res, 2007, 57(4): 483-490. |
| [9] | Clokie SJ, Lau P, Kim HH, et al. MicroRNAs in the pineal gland: miR-483 regulates melatonin synthesis by targeting arylalkylamine N-acetyltransferase[J]. J Biol Chem, 2012, 287(30): 25312-25324. |
| [10] | Filipowicz W, Bhattacharyya SN, Sonenberg N. Mechanisms of post-transcriptional regulation by microRNAs: are the answers in sight?[J]. Nat Rev Genet, 2008, 9(2): 102-114. |
| [11] | Zhou W, Li Y, Wang X, et al. MiR-206-mediated dynamic mechanism of the mammalian circadian clock[J]. BMC Syst Biol, 2011, 5: 141. |
| [12] | Rice JE 3rd, Vannucci RC, Brierley JB. The influence of immaturity on hypoxic-ischemic brain damage in the rat[J]. Ann Neurol, 1981, 9(2): 131-141. |
| [13] | Chen C, Ridzon DA, Broomer AJ, et al. Real-time quantification of microRNAs by stem-loop RT-PCR[J]. Nucleic Acids Res, 2005, 33(20): e179. |
| [14] | Ambros V. The functions of animal microRNAs[J]. Nature, 2004, 431(7006): 350-355. |
| [15] | Landgraf P, Rusu M, Sheridan R, et al. A mammalian microRNA expression atlas based on small RNA library sequencing[J]. Cell, 2007, 129(7): 1401-1414. |
| [16] | Kojima S, Gatfield D, Esau CC, et al. MicroRNA-122 modulates the rhythmic expression profile of the circadian deadenylase Nocturnin in mouse liver[J]. PLoS One, 2010, 5(6): e11264. |
| [17] | Clokie SJ, Lau P, Kim HH, et al. MicroRNAs in the pineal gland: miR-483 regulates melatonin synthesis by targeting arylalkylamine N-acetyltransferase[J]. J Biol Chem, 2012, 287(30): 25312-25324. |
| [18] | Saus E, Soria V, Escaramis G, et al. Genetic variants and abnormal processing of pre-miR-182, a circadian clock modulator, in major depression patients with late insomnia[J]. Hum Mol Genet, 2010, 19(20): 4017-4025. |
| [19] | Song K, Kwon H, Han C, et al. Active glycolytic metabolism in CD133(+) hepatocellular cancer stem cells: regulation by MIR-122[J]. Oncotarget, 2015, 6(38): 40822-40835. |
| [20] | Nowak JS, Choudhury NR, de Lima Alves F, et al. Lin28a regulates neuronal differentiation and controls miR-9 production[J]. Nat Commun, 2014, 5: 3687. |
| [21] | Pierson J, Hostager B, Fan R, et al. Regulation of cyclin dependent kinase 6 by microRNA 124 in medulloblastoma[J]. J Neurooncol, 2008, 90(1): 1-7. |
| [22] | Boutz PL, Chawla G, Stoilov P, et al. MicroRNAs regulate the expression of the alternative splicing factor nPTB during muscle development[J]. Genes Dev, 2007, 21(1): 71-84. |
| [23] | 茹松伟, 申卫红, 杨鹏程, 等. microRNA 靶基因预测算法研究概况及发展趋势[J]. 生命科学, 2007, 19(5): 562-567. |
 2016, Vol. 18
2016, Vol. 18