内脏痛高敏感性是儿童腹痛相关功能性胃肠病重要的病理生理学基础之一,是胃肠运动紊乱、腹痛及症状多样化原因,但其确切机制尚不明确;脊髓背角是内脏痛觉传导的第一级整合中枢,在内脏痛觉传导中发挥着不可替代的作用,而早期生活应激能够影响结肠动力和引起内脏痛觉过敏[1]。新生期母婴分离(neonatal maternal separation,NMS)作为一种早期生活应激,可造成幼鼠内脏痛高敏感的特征性改变,表现为痛阈下降,在相同结直肠扩张(colorectal distension,CRD)压力下腹壁撤退反射评分升高和腹外斜肌放电波幅值升高,是研究肠道功能紊乱的常用模型[2]。业已证实[3, 4],脑源性神经营养因子(brain derived neurotrophic factor,BDNF)普遍存在于神经系统中,是哺乳动物脑内分布最广、含量最高的神经生长因子之一;BDNF不仅在神经元发育过程中促进神经元分化、成熟,参与神经元突触形成和突触可塑性建立,而且,BDNF 在神经病理性疼痛和炎性疼痛的产生和维持中是极为重要的神经递质。有研究证实[3],BDNF在脊髓水平伤害感受的调制中发挥了重要作用,是脊髓背角的感觉调节因子。然而在生命早期应激事件所致的内脏痛觉敏化中,BDNF 作用尚不明确,而生命早期负性生活事件十分常见,其远期危害缺乏有效的防治手段,为此,本研究采用NMS 建立内脏痛觉敏化幼鼠的动物模型[2],观察幼鼠脊髓背角BDNF 表达,探讨BDNF 在幼鼠内脏痛高敏感性形成中的作用,为临床上防治儿童腹痛相关的功能性胃肠病提供理论依据。现将结果报道如下。
1 材料与方法1.1 主要材料和试剂
32只清洁级Sprague-Dawley(SD)新生大鼠,雌雄各半,购自福建医科大学动物实验中心[实验许可证号为:SCXK(闽)2012-0001];兔抗BDNF多克隆抗体(sc-546,美国Santa Cruz 公司);辣根过氧化物酶标记的山羊抗兔二抗(SP-9001,博海生物工程开发有限公司);二氨基联苯胺试剂盒(ZLI-9033,北京中杉金桥生物技术有限公司);动物麻醉机(美国Matrx 公司);RM6240多道电生理记录仪(成都仪器厂);多功能真彩色细胞图象分析管理系统(Image-Pro Plus,美国Media Cybernetics 公司)。
1.2 实验分组及内脏痛高敏感模型建立按2×2析因设计,采用随机数字表法将新生大鼠随机分成对照组、NMS 组、CRD 组和CRD+NMS 组,每组8只。模型制作参照文献[2],新生大鼠出生后第2~14天,每天与母鼠分离3 h(8 : 00~11 : 00 am),即: 将母鼠拎出放入一笼中,然后将新生大鼠放入另一笼中,移至另一邻近房间,温度保持在27~30℃,3h将新生大鼠返回最初笼中与母鼠团聚,连续13 d,CRD 组和对照组新生大鼠出生后不予任何处理。CRD 组和CRD+NMS 组大鼠在6周龄时接受CRD 刺激,对照组和NMS 组大鼠6周龄时不接受CRD 刺激。
各组幼鼠采用母鼠乳喂养至21 d,第22天断奶,断奶后幼鼠采用混合配方饲料喂养至6周,自由进食饮水,隔日更换垫料,提供12h/12 h暗昼夜光变化,室温控制在23±3 ℃,湿度50%~70%,保持大鼠生活环境通风及清洁卫生。
1.3 内脏痛高敏感模型评价参照文献报道[5, 6],浅麻醉状态下,采用CRD 刺激下的腹外斜肌放电反应测定对CRD 组和CRD+NMS 组两组幼鼠进行痛觉敏感性评价。对照组和NMS 组幼鼠以同样的方式插入球囊,但不进行扩张及电生理记录。
1.4 脊髓背角BDNF 的表达及分析接受CRD 刺激后次日,4组幼鼠一起处死,留取脊髓腰骶段(L6~S2),常规石蜡包埋后冠状切片。采用SABC 免疫组织化学法对切片进行BDNF 染色。具体操作步骤如下:(1)石蜡切片脱蜡、入水;(2)压力锅抗原修复,PBS 洗涤,2 min×3次;(3)3%H2O2室温孵育5~10 min 消除内源性过氧化物酶活性;(4)蒸馏水冲洗,PBS 浸泡5 min;(5) 切片上滴加一抗,4 ℃ 过夜,PBS 洗涤,5 min×3次;(6) 滴加生物素化二抗(IgG),37℃孵育30 min,PBS 洗涤,5 min×3次;(7)滴加辣根酶标记链霉卵白素工作液(S-A/HRP),37℃ 20 min,PBS 洗涤,5 min×3次;(8)显色、冲洗,复染,封片。用PBS 液代替一抗作为阴性对照。
显微镜下,在切片中选定脊髓背角区域(“H”形白质上方),其中胞浆中含有蓝黑色颗粒的为阳性细胞。随机选取每只大鼠脊髓组织3张切片,每张切片随机选取3个视野。采用多功能真彩色细胞图象分析管理系统进行图像采集。高倍镜下(×400)计算BDNF 阳性细胞所占比例和显色程度,根据阳性细胞百分比和阳性细胞显色程度进行评分。评分标准:(1)根据阳性细胞百分比评分:0~1%=0、1%~10%=1、10%~50%=2、50%~80%=3、80%~100%=4;(2)根据阳性细胞显色强度评分:阴性=0、弱阳性=1、阳性=2、强阳性=3。根据上述两项评分计算免疫化学分数(immunohistochemical score,IHS),其计算方法和评分标准如下:IHS=(1)×(2),IHS 分级:9~12为强表达、5~8为中等表达、1~4为弱表达、0为阴性[4]。
1.5 统计学分析采用SPSS 18.0统计软件对数据进行统计学分析。计量资料以均数± 标准差(x±s)表示,多组间比较采用析因设计的方差分析,若方差不齐,则采用Kruskal-Wallis H 检验,P<0.05为差异有统计学意义。
2 结果2.1 幼鼠腹外斜肌放电幅值
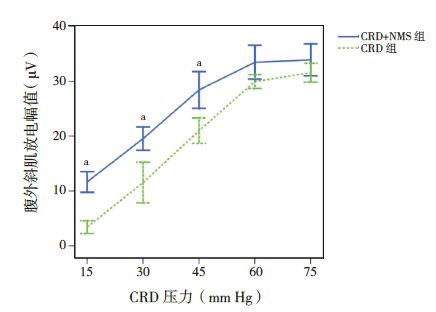
对CRD 组和CRD+NMS 组幼鼠在不同CRD刺激下的腹外斜肌放电幅值进行检测,结果显示:随CRD 压力增加,两组大鼠腹外斜肌放电波幅逐渐增加(P<0.05);在相同 CRD 压力下,CRD+NMS 组腹外斜肌放电波幅明显高于CRD 组(P<0.05)。证实本课题通过新生期反复母婴分离可以建立幼鼠内脏痛高敏动物模型。见图 1。
|
图 1 两组幼鼠腹外斜肌放电幅值比较(n=8) a 示与CRD 组比较,P<0.05。 |
|
|
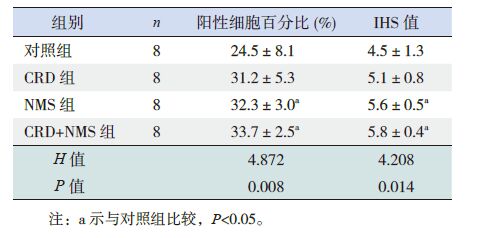
表 1 各组SD 幼鼠腰骶段脊髓背角BDNF 阳性细胞百分 比及IHS 值比较(x±s) |
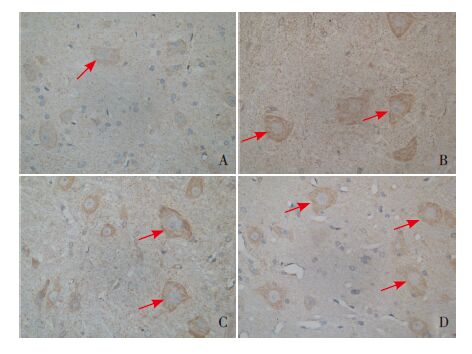
BDNF 免疫阳性产物为蓝黑色颗粒,在细胞质和细胞核中均可表达。4组幼鼠两侧脊髓背角均有不同程度的BDNF 阳性细胞表达(图 2)。4组幼鼠脊髓背角BDNF 阳性细胞百分比及IHS 值差异均有统计学意义(P<0.05)。其中NMS 组和CRD+NMS 组幼鼠BDNF 阳性细胞百分比和IHS 值均明显高于对照组(P<0.05);其余各组间BDNF阳性细胞百分比和IHS 值两两比较差异均无统计学意义(P>0.05)。见表 1。
|
图 2 各组幼鼠腰骶段脊髓背角BDNF 表达(免疫组织 化学染色,×400) A 为对照组,BDNF 表达较少且染色较浅, B、C 分别为CRD 组、NMS 组, 可见明显的BDNF 表达,D 为 CRD+NMS 组,在细胞质和细胞核中均可见较多BDNF 表达且染色 较深。图中蓝黑色颗粒为BDNF 阳性表达(箭头所示)。 |
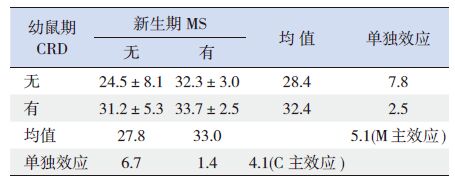
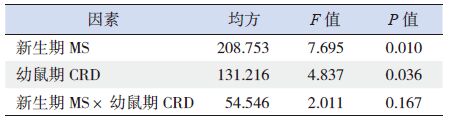
析因设计分析结果对影响幼鼠脊髓背角BDNF 阳性细胞百分比的因素进行析因设计方差分析,结果显示,幼鼠腰骶段脊髓背角BDNF 阳性细胞百分比受到NMS和CRD 刺激两因素影响(P<0.05)。当没有NMS 时,CRD 刺激引起BDNF 阳性细胞百分比增加的单独效应为6.7%,而有NMS 时,CRD 刺激引起BDNF阳性细胞百分比增加的单独效应为1.4%,CRD 主效应为4.1%,即CRD 刺激使幼鼠腰骶段脊髓背角BDNF 阳性细胞平均增加4.1%;当没有CRD 刺激时,NMS 引起BDNF 阳性细胞百分比增加的单独效应为7.8%,而有CRD 刺激时,NMS 引起BDNF阳性细胞百分比增加的单独效应为2.5%,NMS主效应为5.1%,即NMS 使幼鼠腰骶段脊髓背角BDNF 阳性细胞百分比平均增加5.1%。NMS 和CRD 两因素间无交互作用(P>0.05)。见表 2~3。
|
|
表 2 各组幼鼠脊髓背角BDNF 阳性细胞百分比2×2析 因设计结果(x±s,%,n=8) |
|
|
表 3 脊髓背角BDNF 阳性细胞百分比析因方差分析结果 |
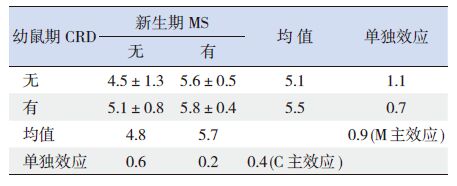
IHS 值2×2析因设计分析结果对影响幼鼠脊髓背角BDNF 阳性细胞IHS 值的因素进行析因设计的方差分析,结果显示,幼鼠腰骶段脊髓背角BDNF 阳性细胞IHS 值仅受NMS 影响(P<0.05)。当没有NMS 时,CRD 刺激引起BDNF 阳性细胞IHS 值增加的单独效应为0.6,当有NMS 时,CRD 刺激引起BDNF 阳性细胞IHS值增加的单独效应为0.2,CRD 主效应仅为0.4,即CRD 刺激使幼鼠腰骶段脊髓背角BDNF 阳性细胞IHS 值平均仅增加0.4;当没有CRD 刺激时,NMS 引起BDNF 阳性细胞IHS 值增加的单独效应为1.1,当有CRD 刺激时,NMS 引起BDNF 阳性细胞IHS 值增加的单独效应为0.7,NMS 主效应为0.9,即NMS 使幼鼠腰骶段脊髓背角BDNF 阳性细胞IHS 值平均增加0.9。NMS 和CRD 两因素间无交互作用(P>0.05)。见表 4~5。
|
|
表 4 各组幼鼠脊髓背角BDNF 阳性细胞IHS 值2×2析 因设计结果(x±s,n=8) |
|
|
表 5 脊髓背角BDNF 阳性细胞IHS 值析因涉及方差分 析结果 |
神经营养因子主要包括神经生长因子、BDNF等,因其结构中50%~60% 的氨基酸序列具有同源性,因此统称为神经营养因子家族[5]。BDNF 是继神经生长因子之后第2个被定义的神经营养因子,和其他家族成员相比,其结构和功能具有特殊性。业已证实[3, 4],BDNF 在神经系统的不同发育时期和不同部位有着不同的表达,受发育调控;BDNF在大脑高级活动如学习、记忆和认知行为中,起着极为重要的作用;同时,BDNF 表达异常和多种疾病有关,BDNF 及其受体功能失调是许多神经精神性疾病的发病基础[7, 8]。
近年来,BDNF 在痛觉的生理性和病理性传导过程中的作用引起国内外学者重视[9],有研究证实[4],神经损伤后在脊髓背角的BDNF 发挥有害作用。Winston 等[10] 报道:采用三硝基苯磺酸给新生鼠灌肠诱导肠道炎症,大鼠成年期(6~8周)出现胃高敏感性,同时,大鼠胃底部平滑肌神经生长因子表达、背根神经节和胸段脊髓中BDNF 表达均明显增加,作者认为:新生鼠肠道炎症可通过影响神经营养因子的基因表达,改变交感神经系统活动,使大鼠在成年期出现胃高敏感性表现,类似于人类的功能性消化不良。Delafoy 等[11] 以成年Wistar 大鼠为实验对象,以给予大鼠腹腔注射三硝基苯磺酸方式建立慢性内脏痛模型,以CRD刺激下的痛阈测定作为评价内脏痛敏感性的方法,探讨不同的神经营养因子在内脏痛形成中的作用;结果证实:BDNF 参与慢性内脏痛的形成,同时外源性使用BDNF 抗体可以逆转内脏痛觉敏化。尽管上述研究均证实BDNF 参与慢性内脏痛觉形成和脊髓中枢敏化的维持,但这些研究均以成年大鼠为实验对象;目前国内外关于BDNF 与神经系统发育、神经元突触可塑性变化的其他研究[10],也大多数集中于成年动物,以幼年动物为实验对象的报导甚少,而生命早期则是神经系统发育成熟、神经元突触建立和维持的关键时期。婴幼儿神经系统处在不断地分化发育中,具有其特殊性;虽然婴幼儿神经元数目在新生儿期已达到成人水平,但其轴突和树突短而少,且神经髓鞘也尚未完全形成,因此,具有更强可塑性。本研究采用2×2析因设计法分成4组,以母婴分离和单次CRD 刺激作为影响因素,在幼年期采用电生理学方法对幼鼠的内脏痛敏感性进行评价,同时采用免疫组化法检测幼鼠脊髓背角BDNF 的表达。其中母婴分离是指在新生SD 大鼠生后2~21 d 每天固定进行母婴分离180 min,以此建立内脏痛高敏感模型,这和国内外研究者以及本课题组前期的建模方法一致[2]。而CRD 作为一种单次的机械性刺激,可以再次诱发大鼠内脏痛,以此来证实BDNF 是否直接参与内脏痛形成。本组资料显示:在低扩张压刺激下,CRD+NMS 组腹外斜肌放电幅值显著高于CRD 组。这进一步验证了该模型建立的正确性和可复制性。对幼鼠脊髓背角BDNF 的表达进行分析结果显示,在幼鼠新生期给予母婴分离可使幼鼠腰骶段脊髓背角BDNF 阳性细胞百分比和IHS 值明显增高。Winston 等[6] 为探讨NMS(SD 大鼠生后2~14 d,每天固定进行母婴分离3 h)、产前慢性应激刺激(在孕鼠孕11 d 至分娩,每天2次于固定时间随机采用冷束缚应激实验45 min 或避水实验1h强迫游泳实验20 min 对孕鼠进行压力刺激)对大鼠内脏痛高敏感性的影响,在大鼠6~8周时用CRD 刺激下的腹壁撤退反射评分检测大鼠内脏痛觉敏感性,并用RT-PCR、Westen-blot、染色体免疫沉淀反应等方法检测子代鼠腰膨大脊髓背角BDNF 基因启动序列及BDNF 的表达情况;结果显示:NMS、产前慢性应激刺激均可导致雌性大鼠CRD 扩张下的腹外斜肌放电幅值和腰骶段脊髓背角BDNF 基因启动序列转录及表达增加,且二者呈正相关。由此作者认为:生命早期应激事件显著上调腰骶段脊髓背角BDNF 表达,导致内脏痛觉敏化,同时BDNF 是评价慢性内脏痛觉敏化的关键物质。本研究结果与Delafoy 等[11]、Winston 等[6, 10] 学者的研究结果一致,提示NMS 所建立的内脏痛觉高敏感模型幼鼠脊髓背角BDNF 出现高表达,促进脊髓初级中枢及其感觉传导通路上的神经元兴奋性增高,导致幼鼠脊髓初级中枢出现敏化,表现为幼鼠内脏痛高敏感性。
| [1] | Vermeulen W, De Man JG, Pwickmans PA, et al. Neuroanatomy of lower gastrointestinal pain disorders[J]. World J Gastroenterol, 2014, 20(4): 1005-1020. |
| [2] | 卓玲, 吴斌, 张睿, 等. 幼鼠内脏痛觉高敏感性模型的建立 及电生理学评价[J]. 实用儿科临床杂志, 2009, 24(19): 1487-1489. |
| [3] | Cowansage KK, LeDoux JE, Monfils MH, et al. Brain-derived neurotrophic factor: a dynamic gatekeeper of neural plasticity[J]. Curr Mol Pharmacol, 2010, 3(1): 12-29. |
| [4] | Taves S, Berta T, Chen G, et al. Microglia and spinal cord synaptic plasticity in persistent pain[J]. Neural Plast, 2013, 2013: 753656. |
| [5] | 杨燕珍, 吴斌, 张睿, 等. 腹外斜肌放电测量在幼鼠内脏痛觉高敏感模型评价中的应用[J]. 中国当代儿科杂志, 2008, 10(5): 637-641. |
| [6] | Winston JH, Li Q, Sarna SK. Chronic prenatal stress epigenetically modifies spinal cord BDNF expression to induce sex-specific visceral hypersensitivity in offspring[J]. Neurogastroenterol Motil, 2014, 26(5): 715-730. |
| [7] | 陈金兰, 陈燕惠. 脑源性神经营养因子及其受体在儿童发育行为疾病中的作用[J]. 国际儿科学杂志, 2012, 39(2): 158-161. |
| [8] | Biggio F, Pisu MG, Garau A, et al. Maternal separation attenuates the effect of adolescent social isolation on HPA axis responsiveness in adult rats[J]. Eur Neuropsychopharmacol, 2014, 24(7): 1152-1161. |
| [9] | Constandil L, Aguilera R, Goich M, et al. Involvement of spinal cord BDNF in the generation and maintenance of chronic neuropathic pain in rats[J]. Brain Res Bull, 2011, 86(5-6): 454-459. |
| [10] | Winston JH, Sarna SK. Developmental origins of functional dyspepsia-like gastric hypersensitivity in rats[J]. Gastroenterology, 2013, 144(3): 570-579. |
| [11] | Delafoy L, Gelot A, Ardid D, et al. Interactive involvement of brain derived neurotrophic factor, nerve growth factor, and calcitonin gene related peptide in colonic hypersensitivity in the rat[J]. Gut, 2006, 55(7): 940-945. |
 2016, Vol. 18
2016, Vol. 18