2. 四川大学华西第二医院儿童血液科, 四川 成都 610041
原血细胞(hematogones,HGs)为骨髓正常B系前体淋巴细胞(B-lymphocyte precursors,BCP)的良性扩增,根据其成熟程度及免疫表型特征,分为pro-B,pre-B和immature B亚群,患者年龄不同、疾病所处阶段不同,各亚群比例会发生相应的改变[1, 2]。急性B淋巴细胞白血病(acuteB-lymphoblastic leukemia,B-ALL)患者化疗后造血功能恢复时,HGs可达5~50%[3, 4, 5, 6]。但根据骨髓形态学很难鉴别HGs与白血病细胞,给临床造成困扰,故两者的鉴别具有极其重要的临床意义。
目前有报道提出,HGs与急性髓细胞白血病(acute myeloid leukemia,AML)的预后相关,为AML良好预后的因素之一[5, 6]。同时有报道指出,B-ALL患者在造血干细胞移植后,HGs>1%提示预后良好[7]。但目前国内尚无HGs与儿童B-ALL预后关系的研究。本研究采用回顾性队列研究,运用欧洲BIOMED-1标准化流式微小残留病(minimalresidual disease,MRD)检测技术[8],通过对B-ALL患儿巩固化疗期HGs与白血病细胞的比较和鉴别,初步探讨HGs作为监测B-ALL微小残留病补充指标的临床可行性。
1 资料与方法 1.1 研究对象收集2008年4月至2012年9月在四川大学华西第二医院确诊的B-ALL患儿196例。均采用中国儿童白血病协作组(Chinese ChildhoodLeukemia Group,CCLG)ALL-2008诊疗方案进行诊断、危险分型和治疗。患儿年龄1~16岁,男性128例、女性68例。根据危险分型分为高危(n=55)、中危(n=69)和低危(n=72)3组。按临床结局分为持续完全缓解(n=165)和复发组(n=31)。复发组中,髓外复发(中枢神经系统、睾丸)3例;其中巩固化疗期MRD>0.1%者3例、MRD>0.1%同时伴骨髓复发者25例。
纳入人群需进行:(1)完成5周诱导化疗,初诊时以及诱导化疗期每周检测1~2次外周血象,并行泼尼松敏感试验、第33天骨髓形态学和MRD检测等;(2)完成>3个月的巩固化疗。低中危和高危患儿分别在巩固化疗期第1次HD-MTX或HR-1方案的第1天行骨穿检测HGs和MRD。由于儿童B-ALL诱导化疗强,诱导结束时骨髓抑制严重,无法统计诱导化疗末HGs值。本研究获得医院伦理委员会批准及监护人书面知情同意。
复发标准[9]:完全缓解后出现以下之一判断为B-ALL复发:(1)骨髓幼稚淋巴细胞(原始淋巴细胞+幼稚淋巴细胞)>5%但≤ 20%,予以积极治疗,骨髓幼稚淋巴细胞仍未能 < 5%,则判断为复发;(2)骨髓幼稚淋巴细胞(原始淋巴细胞+幼稚淋巴细胞)>20%;(3)髓外白血病细胞浸润(称髓外复发);(4)美国COG(Children'sOncology Group)大样本研究报道,巩固化疗期间MRD>0.1%的B-ALL患者5年后复发率为100%。故将巩固化疗期MRD>0.1%也作为B-ALL复发标准之一[10]。
1.2 资料收集分析收集患儿完整临床资料和随访资料,统计分析无事件生存率(event-free survival,EFS)。病例随访至复发、死亡、第二肿瘤或随访截止日(2015年9月)。持续完全缓解组随访时间>3年。
1.3 标本采集采集患儿巩固化疗期间骨髓(EDTA或肝素抗凝),24 h内完成流式细胞术检测。同时制备至少3张骨髓涂片进行骨髓形态学检测。
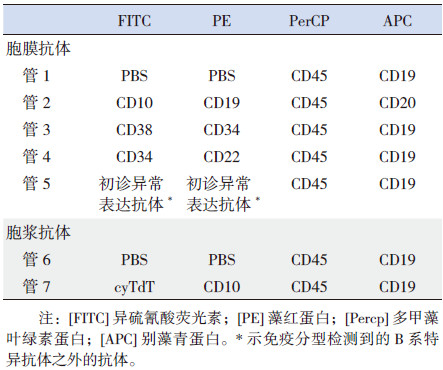
1.4 试剂固定破膜剂(美国Invitrogen公司)。单克隆抗体:胞膜CD45、CD19、CD10、CD20、CD34、CD38、CD22、cyTdT,以上抗体均购至美国BDPharmingen或Coulter公司。
1.5 流式细胞术检测HGs每例标本标记6管或7管,取血球稀释液稀释至浓度10~20×109/L的骨髓100 μL与4或5管膜表面抗体组合充分混匀,避光、室温孵育15 min,若初诊有跨系表达,加管标记分析;加入2 mL×FACS溶血素(蒸馏水1 : 10稀释)充分混匀,静置10 min,1 300转/min离心5 min,弃上清液;磷酸盐缓冲液(PBS)充分混匀,1 300转/min离心5 min,弃上清液;加入500 μL PBS混悬,待上机;两管胞浆抗体需加入500 μL破膜剂静置10 min,洗涤后加入破膜抗体室温、避光孵育30 min,PBS洗涤后即可流式细胞仪(BD FACSCalibur)检测,记录500 000个细胞。利用BD Cell QuestTM Pro软件分析数据。主要抗体组合见表 1。
| 表 1 四色流式染色方案 |
通过SSC/FSC设门,将高SSC低FSC信号的细胞碎片排除。以CD19设门,观察CD19阳性B细胞的免疫表型,判断是否存在异常的抗体表达。HGs数量用正常BCP占骨髓总有核细胞的百分比(%)表示,包括pro-B cells(stage Ⅰ):CD10+CD20-CD34+CD38+CD22+TdT+CD19+;pre-Bcells(stage Ⅱ):CD10+CD20+CD34-/loCD38+CD22+TdT+CD19+;immature B cells(stage Ⅲ):CD10+CD20+CD34-CD38+CD22+TdT+CD19+[1, 2, 4, 11, 12, 13]。因本研究的pre-B cells和immature B cells采集位点有重叠(图 1 E1、E2),故将这两阶段细胞合并分析。在正常细胞表达模式之外出现的异常细胞群视为MRD细胞(图 1 R1~R22),超过15 events成簇分布视为异常,总计超过50 events判断为有临床意义。
 |
图 1 四色流式HGs与B-ALL MRD的鉴别 以CD19设门,各管抗体组合方式:(A)CD10/CD20/CD19/CD45;(B)CD34/CD38/CD19/CD45;(C)CD34/CD22/CD19/CD45;(D)CD19/CD34/CD45;(E)TdT/CD10/CD19/CD45。E1:stage Ⅰ HGs;E2:stage Ⅱ+Ⅲ HGs(E2-1:Pre-B,E2-2:immature B)。E3:mature B;R1~R22:MRD细胞。(F)HGs细胞形态学(HE染色,×1 000):HGs染色质致密均一、胞浆量少、核仁不明显(箭头所示)。 |
统计学处理采用SPSS 17.0软件完成。非正态分布计量资料用中位数(范围)表示,计数资料用百分率(%)表示。多组比较采用校正检验或Fisher确切概率法。对于连续变量,利用Mann-Whitney U检验进行两组间比较、Kruskal-Wallistest进行多组间比较。相关分析采用Pearman等级相关分析法。生存曲线采用Kaplan-Meier分析。P < 0.05为差异有统计学意义。
2 结果骨髓形态学与流式细胞术检测结果不一致是指骨髓形态学显示5% < 幼稚淋巴细胞 < 20%,而MRD < 0.1%。196例巩固化疗期的患儿有29例(14.8%)出现不一致结果。总HGs、stage Ⅱ+Ⅲ HGs与骨髓幼稚淋巴细胞比例均呈正相关(r=0.44、0.45,P < 0.05),stage Ⅰ HGs与骨髓幼稚淋巴细胞比例无显著相关性(P>0.05)。
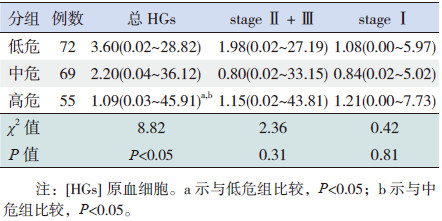
2.1 各组间HGs差异比较低、中、高危3组的总HGs逐步降低,差异有统计学意义(P < 0.05);但stage Ⅱ+Ⅲ HGs及stage Ⅰ HGs在高、中、低危3组的差异均无统计学意义(P>0.05)。见表 2。
| 表 2 不同危险组患儿HGs比较[中位数(范围),%] |
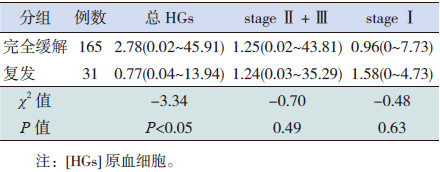
196例患儿共有31例(15.8%)复发。完全缓解组的总HGs表达明显高于复发组,差异有统计学意义(P < 0.05);stage Ⅱ+Ⅲ及stage Ⅰ HGs的表达在两组间差异无统计学意义(P>0.05)。见表 3。
| 表 3 不同临床结局患儿HGs比较[中位数(范围),%] |
为寻找HGs的最佳临界值,将患儿分为HGs ≤ 1%(n=69),1% < HGs ≤ 2%(n=30),2% < HGs ≤ 3%(n=9),3% < HGs ≤ 4%(n=13),4% < HGs ≤ 5%(n=5),HGs>5%(n=70)6个组进行EFS分析。HGs ≤ 1%的EFS最低(72.3%),差异有统计学意义(χ2=11.272,P=0.046)。故以1%为界,比较巩固化疗期HGs ≤ 1%(n=69)与HGs>1%(n=127)患儿的EFS差异,显示HGs ≤ 1%组EFS(72.3%)明显低于HGs>1%组(90.1%),差异有统计学意义(χ2=7.597,P=0.006)。见图 2。
 |
图 2 各组B-ALL患儿EFS分析 A:将患儿分为 HGs ≤ 1%(n=69),1% < HGs ≤ 2%(n=30),2% < HGs ≤ 3% (n=9),3% < HGs ≤ 4%(n=13),4% < HGs ≤ 5%(n=5), HGs>5%(n=70)6组,以HGs ≤ 1%组EFS最低;B:以HGs 1% 为界,HGs ≤ 1%的EFS低于HGs>1%者。 |
B-ALL是最为常见的儿童血液肿瘤,近年依据早期治疗反应来指导临床危险度分型和个体化治疗的观念受到广泛关注。HGs为骨髓中正常B系前体淋巴细胞,体积差异较大,染色质致密均一、胞浆量少、核仁不明显,很难仅根据形态学与B-ALL幼稚细胞鉴别。由于白细胞抗体重叠、漂移等现象可影响流式细胞术MRD准确度,导致形态学显示完全缓解而MRD>0.1%的不一致性[14, 15]。本研究通过相关性分析发现,HGs与骨髓幼稚淋巴细胞呈正相关,提示HGs是导致形态学与MRD不一致的可能原因。不一致的29例中仅4例复发。提示临床不能单纯依据骨髓形态学判断复发,需结合流式细胞术HGs分析以鉴别幼稚细胞与正常B系前体细胞。
大量HGs多出现于化疗后再生的骨髓[3, 4, 5, 6]。国外已有报道指出,HGs与AML的预后相关[5, 6]。但由于HGs与B-ALL幼稚细胞在形态学上很难鉴别[6],仅有个别报道HGs在成人B-ALL的预后意义[16]。但有研究报道,欧洲BIOMED-1标准化流式MRD检测技术可准确鉴别HGs与B-ALL残留白血病细胞(准确率达98%)[8]。本研究采用欧洲BIOMED-1标准化流式MRD检测技术,以B-ALL为研究对象,检测巩固化疗期的HGs并分析与EFS的关系。结果显示,高危患儿的HGs明显低于中、低危患儿,提示骨髓HGs与B-ALL的危险度存在一定相关性;完全缓解组的HGs明显高于复发组,提示HGs增生反映化疗效果良好,可用于B-ALL患儿疗效判断及预后监测。有研究显示,AML诱导化疗后HGs>0.01%的患儿总体生存率和无病生存率明显高于HGs<0.01%患儿[5, 6]。另有研究指出,HGs>0.1%的AML预后良好[17]。Chantepie等[16]报道,MRD阴性且HGs阳性的成人B-ALL总体生存率和无病生存率高于HGs阴性者。本研究发现,HGs>1%的B-ALL患儿EFS明显高于HGs ≤ 1%者,本研究HGs临界值高于文献报道[5, 6, 17, 18],可能与儿童骨髓HGs较成年人高[2, 4]、并且巩固化疗期的骨髓较诱导化疗末增生更活跃有关。
综上,HGs可反映B-ALL疗效,可作为B-ALL疗效及预后监测指标。流式细胞术检测HGs需要多抗体联合标记,且抗体组合多样,但各实验室常常根据自身需要采用不同的抗体组合模板,容易造成结果差异。因此需要标准化流式检测方案,欧洲BIOMED-1流式MRD检测方案易于形成标准化,使HGs用于B-ALL疗效监测更具有实际临床意义。
| [1] | Hurford MT, Altman AJ, DiGiuseppe JA, et al. Unique pattern of nuclear TdT immunofluorescence distinguishes normal precursor B cells (Hematogones) from lymphoblastsof precursor B-lymphoblastic leukemia[J]. Am J Clin Pathol, 2008, 129(5): 700-705. |
| [2] | Sevilla DW, Colovai AI, Emmons FN, et al. Hematogones: a review and update[J]. Leuk Lymphoma, 2010, 51(1): 10-19. |
| [3] | M c K e n n a RW, Wa s h i n g t o n LT, A q u i n o D B, e t a l . Immunophenotypic analysis of hematogones (B-lymphocyte precursors) in 662 consecutive bone marrow specimens by 4-color flow cytometry[J]. Blood, 2001, 98(8): 2498-2507. |
| [4] | Chantepie SP, Cornet E, Salaün V, et al. Hematogones: an overview[J]. Leuk Res, 2013, 37(11): 1404-1411. |
| [5] | Chantepie SP, Salaün V, Parienti JJ, et al. Hematogones: a new prognostic factor for acute myeloblastic leukemia[J]. Blood, 2011, 117(4): 1315-1318. |
| [6] | Honebrink T, Dayton V, Burke MJ, et al. Impact of bone marrow hematogones on umbilical cord blood transplantation outcomes in patients with acute myeloid leukemia[J]. Biol Blood Marrow Transplant, 2012, 18(6): 930-936. |
| [7] | Shima T, Miyamoto T, Kikushige Y, et al. Quantitation of hematogones at the time of engraftment is a useful prognostic indicator in allogeneic hematopoietic stem cell transplantation[J]. Blood, 2013, 121(5): 840-848. |
| [8] | Lucio P, Gaipa G, van Lochem EG, et al. BIOMED-I concerted action report: flow cytometric immunophenotyping of precursor B-ALL with standardized triple-stainings[J]. Leukemia, 2001, 15(8): 1185-1192. |
| [9] | 陈珊珊. 急性白血病[M]//张之南, 沈悌. 血液病诊断及疗效标准. 第3 版. 北京: 科学出版社, 2007: 132. |
| [10] | Borowitz MJ, Devidas M, Hunger SP, et al. Clinical significance of minimal residual disease in childhood acute lymphoblastic leukemia and its relationship to other prognostic factors: a Children's Oncology Group study[J]. Blood, 2008, 111(12): 5477-5485. |
| [11] | Tsao L, Colovai AI, Jiang JG, et al. Characterizing CD43 expression in haematogones using multicolor flow cytometric analysis[J]. Br J Haematol, 2005, 128(6): 820-823. |
| [12] | LeBien TW. Fates of human B-cell precursors[J]. Blood, 2000, 96(1): 9-23. |
| [13] | LeBien TW, Tedder TF. B lymphocytes: how they develop and function[J]. Blood, 2008, 112(5): 1570-1580. |
| [14] | van der Sluijs-Gelling AJ, van der Velden VH, Roeffen ET, et al. Immunophenotypic modulation in childhood precursor B-ALL can be mimicked in vitro and is related to the induction of cell death[J]. Leukemia, 2005, 19(10): 1845-1847. |
| [15] | Dworzak MN, Gaipa G, Schumich A, et al. Modulation of antigen expression in B-cell precursor acute lymphoblastic leukemia during induction therapy is partly transient: evidence for a druginduced regulatory phenomenon. Results of the AIEOP-BFM-ALL-FLOW-MRD-Study Group[J]. Cytometry B Clin Cytom, 2010, 78(3): 147-153. |
| [16] | Chantepie SP, Dugue AE, Chevallier P, et al. Prognostic impact of bone marrow B lymphocyte precursors (hematogones) detection in 95 acute lymphoblastic leukemia cases[C]. ASH Annu Meeting Abstr, 2012, 120: 4791. |
| [17] | Zheng J, Du W, Yao J, et al. Analysis of hematogones in bone marrow from acute myeloid leukaemia cases post therapy[J]. Eur J Clin Invest, 2013, 43(1): 1140-1146. |
| [18] | Rossi DJ, Bryder D, Zahn JM, et al. Cell intrinsic alterations underlie hematopoietic stem cell aging[J]. Proc Natl Acad Sci USA, 2005, 102(26): 9194-9199. |
 2016, Vol. 18
2016, Vol. 18