2. 上海交通大学附属新华医院儿科, 上海 200092
抽动障碍(Tic disorders,TD)是一种起病于儿童和青少年,具有明显遗传倾向的神经精神障碍性疾病[1, 2],发病机制与多巴胺D2受体(Dopaminereceptor D2,DRD2)密切相关[3, 4, 5, 6],TD患者体内存在着DA摄取和释放的异常[7, 8]。以往有关TD患者多巴胺系统的研究大部分是通过动物实验和尸检进行的,存在很大局限性。近年来研究发现[9],抑郁症和强迫症患者外周血淋巴细胞DRD1~DRD5都有表达,其表达水平与中枢神经组织的基因表达呈正相关[10, 11, 12, 13]。而TD患儿外周血淋巴细胞的DA受体表达情况如何,目前国内外未见有关报道。本研究通过荧光定量PCR检测TD患儿外周血淋巴细胞DRD2和多巴胺转运体(Dopaminetransporter,DAT)mRNA的表达水平,并分析它们与反映TD临床症状严重程度的耶鲁综合抽动严重程度评分(Yale Global Tic Severity Scale,YGTSS)[14]之间的关系,旨为TD的诊断、疾病严重程度评估和临床疗效评价提供依据。
1 资料与方法 1.1 研究对象选择2013年1月至2014年3月,上海交通大学医学院附属新华医院专科门诊就诊的TD患儿60例,其中男性30例、女性30例,年龄4~16岁、平均7.5±2.1岁,病程2~24个月。该研究获得医院医学伦理委员会批准以及患儿家长或监护人书面知情同意。
纳入标准:①符合美国精神障碍诊断与统计手册第4版(DSM- Ⅳ)中关于TD的诊断标准[15];②年龄4~16岁,男女不限;③就诊前2周内未服用任何药物。
排除标准:①年龄 < 4岁或>16岁;②有习惯性抽搐、肌阵挛性癫痫、风湿性舞蹈病、肝豆状核变性、脑外伤、脑炎后遗症和其他锥体外系疾病者;③合并心血管、肝、肾、血液等系统的严重疾病者;④伴有其他精神行为疾病者。
根据YGTSS将TD分为轻、中、重度[16]。评分≤ 25分者为轻度,评分25~45分者为中度,评分≥ 45分者为重度。
另选取60例健康儿童为对照组,男性30例、女性30例,年龄3~16岁、平均7.0±2.0岁。纳入标准:①无神经系统或精神障碍疾病病史或家族史;②无物质、药物依赖及滥用史;③无内分泌疾病,自身免疫性疾病,重大躯体疾病;④未受过严重头部外伤,无出生产伤史;⑤童年或婴幼儿期未出现过高热惊厥。
TD患儿确诊后即采用阿立哌唑单药治疗,≤ 8岁患儿起始剂量为2.5 mg/d,逐渐每周加量2.5 mg,目标剂量5~15 mg/d;>8岁者起始剂量为5 mg/d,逐渐每周加量5 mg,目标剂量5~25 mg/d。3个月后复查。
1.2 总RNA抽提TD患儿在治疗前及治疗3个月时采集空腹静脉血5 mL,采集后3 h内抽提总RNA。总RNA经紫外分光光度仪检测(OD260/OD280),OD260/OD280值均保持在1.8~2.2之间。总RNA -80℃保存。
1.3 逆转录反应每样本抽取1 μg的总RNA,用Sigma公司的PrimeScript RT reagent Kit试剂盒进行逆转录反应,合成的cDNA于-80℃冰箱保存。
引物序列如下:DRD2上游引物5'-AGACCATGAGCCGTAGGAAG-3',下游引物5'-GCAGCCAGCAGATGATGA-3'。DAT上游引物5'-CGGCCAGACCAAGAGGGAAGAAGCA-3',下游引物5'-TGGGCACACTGGGAGTTGAGGAA-3'。GAPDH上游引物5'-ACGGATTTGGTCGTATTGGG-3',下游引物5'-CGCTCCTGGAAGATGGTGAT-3'。所有引物设计与合成均由上海生工生物工程有限公司完成。
1.4 PCR反应使用Sigma公司的SYBR Premix Ex TaqTM II(2×)试剂盒,应用ABI 7500型实时检测扩增仪,通过两步法PCR反应程序实现对mRNA的定量表达。反应条件为:95℃预变性10 min,60℃复性和延伸45 s,95℃变性15 s,共45个循环。确认溶解曲线和扩增曲线,记录每个基因的Ct值。运用2-△△ CT方法进行相对定量分析,△△ Ct=(Ct目的基因- Ct管家基因)实验组-(Ct目的基因-Ct管家基因)对照组。实验至少重复3次。
1.5 统计学分析采用SPSS 18.0软件进行统计学处理,数据用均数±标准差(x±s)表示,组间比较采用t检验,P < 0.05为差异有统计学意义。
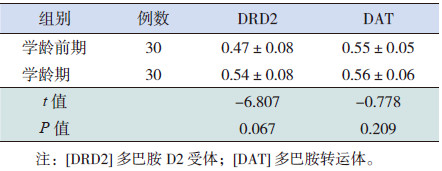
2 结果 2.1 不同年龄TD患儿治疗前DRD2、DATmRNA表达水平的比较学龄期和学龄前期TD患儿治疗前外周血淋巴细胞的DRD2 mRNA、DAT mRNA表达水平差异无统计学意义(P>0.05),见表 1。
| 表 1 不同年龄TD患儿DRD2和DAT mRNA比较(x±s) |
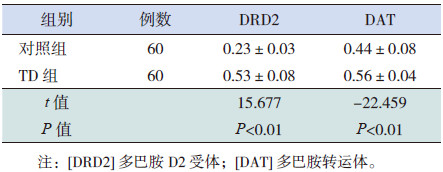
TD患儿治疗前DRD2mRNA和DATmRNA表达水平明显高于正常儿童(P < 0.01),见表 2。
| 表 2 治疗前TD患儿与正常对照组DRD2和DATmRNA比较(x±s) |
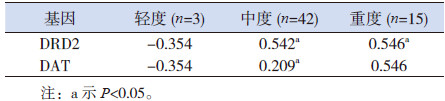
中度和重度TD患儿外周血DRD2 mRNA表达水平与YGTSS呈正相关(r=0.542,0.546;P < 0.05)。中度TD患儿外周血DAT mRNA表达水平与YGTSS呈正相关(r=0.209,P < 0.05)。见表 3。
| 表 3 TD患儿DRD2和DAT基因表达水平与YGTSS相关性分析(r值) |
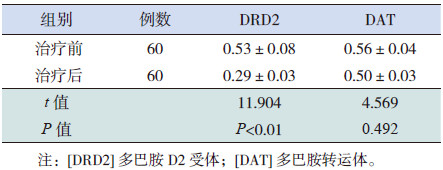
TD患儿治疗3个月后,外周血DRD2mRNA表达水平明显降低,差异有统计学意义(P < 0.01);DATmRNA表达水平在治疗前后差异无统计学意义(P>0.05)。见表 4。
| 表 4 TD患儿治疗前后DRD2和DAT mRNA比较(x±s) |
迄今为止,TD的病因和发病机制尚未完全明了,可能与遗传、感染、免疫、心理以及环境因素等诸多方面有关。其中,比较公认的发病机制是DA活性过度或受体功能代谢异常[17]。阿立哌唑是第三代非典型抗精神病药物,既是多巴胺突触后受体的拮抗剂也是多巴胺突触前自身受体的激动剂,在中脑边缘系统通路上具有典型的拮抗D2受体的作用,在中脑皮质却有D2受体部分激动作用,在被盖区可同时对D2神经元起激动和拮抗作用,抑制黑质-纹状体通路多巴胺能传递,被称为多巴胺系统稳定剂。阿立哌唑对常规药物不敏感的难治性抽动症效果较好[18]。近年研究证实[19, 20],TD患儿中枢神经系统DRD2和DAT的表达明显高于正常儿童。Yoon等[20]发现,与正常对照患儿相比,TD患儿额部大脑皮层DRD2和DAT高密度分布。Minzer等[21]发现,TD患者的前额皮质DRD2的分布密度相比正常对照组高140%。但TD患儿外周血淋巴细胞DA受体表达情况如何,目前国内外未见有关报道。本研究表明,治疗前TD患儿外周血淋巴细胞DRD2 mRNA的表达水平显著高于正常对照组;阿立哌唑治疗3个月后,TD患儿DRD2mRNA的表达水平明显降低,提示阿立哌唑的治疗机制与降低DA受体表达有关。
TD患儿DA功能亢进,可引起突触前膜多巴胺转运体代偿性升高。DAT位于DA能神经元突触前膜,可以摄取突触间隙的多巴胺,终止神经细胞间的信息传导[21]。本研究发现,TD患儿治疗前外周血淋巴细胞上DAT基因表达水平较正常组有显著的升高,验证了TD的“多巴胺功能亢进假说”。
YGTSS是美国耶鲁大学研制的评估抽动症状严重程度的量表,其反映抽动症状(抽动的数量、频度、强度、复杂性、干扰性)的5个维度量表包括了抽动症状的各个方面,量化准确、将症状严重度分级,被广泛应用于临床[14]。本研究发现,在YGTSS评分为中、重度的TD患儿中,其DRD2mRNA表达水平与YGTSS总分呈正相关,提示DRD2基因mRNA可作为反映中、重度TD患儿病情严重程度的一个客观指标。
综上,外周血淋巴细胞DRD2 mRNA、DATmRNA的表达可作为TD诊断、疾病严重程度评估和临床疗效评价的指标之一。
| [1] | Cath DC, Hedderly T, Ludolph AG, et al. European clinical guidelines for Tourette syndrome and other tic disorders. Part I: assessment[J]. Eur Child Adolesc Psychiatry, 2011, 20(4): 155-171. |
| [2] | Leckman JF. Tic disorders[J]. BMJ, 2012, 344: 7659. |
| [3] | Herzberg I, Valencia-Duarte AV, Kay VA, et al. Association of DRD2 variants and Gilles de la Tourette syndrome in a familybased sample from a South American population isolate[J]. Psychiatr Genet, 2010, 20(4): 179-183. |
| [4] | Taylor JL, Rajbhandari AK, Berridge KC, et al. Dopamine receptor mo-dulation of repetitive grooming actions in the rat. Potential relevance for Tourette syndrome[J]. Brain Res, 2010, 31(1322): 92-101. |
| [5] | Nikolaus S, Antke C, Muller HW. In vivo imaging of synaptic funtion in the central nervous system: II. Mental and afective disorders[J]. Behav Brain Res, 2009, 204(1): 32-66. |
| [6] | Steeves TDL, Ji HK, Kideckel DM, et al. Extrastriatal dopaminergic dys-function in Tourette syndrome[J]. Ann Neurol, 2010, 67(2): 170-181. |
| [7] | Liu H, Dang F, Meng Z, et al. Evaluation of Tourette's syndrome by (99m) Tc-TRODAT-ISPECT/CT imaging[J]. Ann Nucl Med, 2010, 24(7): 515-521. |
| [8] | Li JJ, Li ZW, Li AY, et al. Abnormal expression of dopamine and sero-tonin transporters associated with the pathophysiologic mechanism of Tourette syndrome[J]. Neurol India, 2010, 58(4): 523-529. |
| [9] | Osladali MR, Ahangari G, Eslami MB, et al. The detection of dopamine gene receptors(DRD1-DRD5)expression on human peripheral blood lymphocytes by real time PCR[J]. Iran J Allergy Asthma Immunol, 2004, 3(4): 169-174. |
| [10] | Rocc P, De Leo C, Eva C, et al. Decrease of the D4 dopamine receptor messenger RNA expression in lymphocytes from patients with major depression[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2002, 26(6): 1155-1160. |
| [11] | Rollins B, Martin MV, Morgan L, et al. Analysis of whole genomebiomarker expression in blood and brain[J]. Am J Med Genet B Neuropsychiatr Genet, 2010, 153B(4): 919-936. |
| [12] | 王振, 肖泽萍, 张海音, 等. 强迫症患者儿茶酚胺氧位甲基转移酶基因表达的研究[J]. 中华精神科杂志, 2009, 42(4): 220-223. |
| [13] | 李则挚, 禹顺英, 洪武, 等. 外周血白细胞脑源性神经营养因子基因表达与亚综合征抑郁的关系[J]. 中华精神科杂志, 2011, 44(1): 3-6. |
| [14] | 钟佑泉, 陶宣华, 吴惧, 等. 耶鲁抽动症整体严重度量表在儿科临床的初步应用[J]. 四川医学, 2000, 21(2): 110-111. |
| [15] | VE Caballo. Diagnostic and statistical manual of mental disorders[M]. 4th ed. Washington, D.C. American Psychiatric Association, 1994: 1-50. |
| [16] | Leckman JF, Riddle MA, Hardin MT, et al. The Yale Global Tic Severity Scale: initial testing of a clinician-rated scale of tic severity[J]. J Am Acad Child Adolesc Psychiatry, 1989, 28(4): 566-573. |
| [17] | 林节. 抽动障碍[M]//陶国泰. 儿童少年精神医学. 南京: 江苏科学技术出版社, 1999: 237. |
| [18] | Davies L, Stern JS, Agrawal N. A case series of patients with Tourette syndrome in the United Kingdom treated with aripiprazole[J]. Hum Psychopharmacol, 2006, 21(7): 447-453. |
| [19] | Miranda CM, Castiglioni TC. Aripiprazole for the treatment of Tourette syndrome. Experience in 10 patients[J]. Rev Med Chil, 2007, 135(6): 773-776. |
| [20] | Yoon DY, Gause CD, Leckman JF, et al. Frontal dopaminergic abnormality in Tourette syndrome: A postmortem analysis[J]. J Neurol Sci, 2007, 255(1-2): 50-56. |
| [21] | Minzer K, Lee O, Hong JJ, et al. Increased prefrontal D2 protein in Tourette syndrome: a postmortem analysis of frontal cortex and striatum[J]. J Neurol Sci, 2004, 219(1-2): 55-61. |
 2016, Vol. 18
2016, Vol. 18