新生儿败血症是指新生儿期细菌或真菌侵入血液循环并在其中生长繁殖,产生毒素造成的全身感染[1]。其发病率约占活产婴儿的0.1%~1%,是导致新生儿期病死率高的主要原因之一,每年全世界有超过140万例新生儿死于侵袭性感染[2]。新生儿败血症早期诊断、合理治疗至关重要,但大多起病隐匿,临床缺乏特异性,早期诊断存在一定困难,且早期经验性治疗缺乏针对性和依据,易延误治疗时机。同时,患有败血症的新生儿平均住院日长,住院费用高,消耗大量的医疗卫生资源,给家庭和社会造成沉重的疾病负担。本研究探讨革兰阳性(G+)菌、革兰阴性(G-)菌和真菌败血症的临床特征、住院时间及住院费用,旨在提高对不同病原菌所致新生儿败血症的认识和诊断水平,以早期干预和有效防治新生儿败血症,减轻家庭及社会负担。
1 资料与方法 1.1 研究对象2010年1月至2014年12月我院NICU收治的确诊为新生儿败血症[3]的236例新生儿为研究对象,其中男146例,女90例;日龄0.5 h至28 d。早发型败血症58例,晚发型败血症178例。G+菌败血症110例,G-菌败血症68例,真菌败血症58例。
1.2 方法选取疑诊新生儿败血症的患儿行血培养及药敏检查,根据血培养结果及临床表现将确诊败血症的患儿纳入本研究。纳入标准:临床怀疑败血症,且同一时间不同部位2份静脉血培养结果一致。剔除标准:2份静脉血培养结果不一致,或临床表现与血培养结果不符。根据血培养结果将其分为G+菌组、G-菌组和真菌组,比较3组败血症的临床特征及住院时间和住院费用。
指标判定:WBC异常指WBC减少(< 5×109/L)或WBC增多(出生≤ 3 d者,WBC>25×109/L;出生>3 d者,WBC>20×109/L)[3];血小板降低指血小板计数 < 100×109/L[3];C-反应蛋白界值指10 mg/L[4]。
1.3 统计学分析采用SPSS 16.0统计软件进行统计分析,P < 0.05为差异有统计学意义。正态分布的计量资料以均值±标准差(x±s)表示,非正态分布的计量资料采用中位数和四分位间距[P50(P25,P75)]表示,计数资料采用百分比描述。计量资料3组间比较,如数据满足正态分布和方差齐性条件则采用单因素方差分析,组间两两比较采用SNK-q检验;如数据不满足正态分布则采用秩和检验,组间两两比较采用秩和检验中扩展的t检验法。3组间计数资料的比较采用χ2检验;组间两两比较采用卡方分割法,调整检验水准为0.0125。
2 结果 2.1 病原菌构成236例新生儿败血症中,G+菌败血症110例,占47.6%,其中以表皮葡萄球菌、肠球菌为主;G-菌败血症68例,占28.8%,其中以肺炎克雷伯菌、大肠埃希菌为主;真菌败血症58例,占24.6%,其中以白色念珠菌、光滑念珠菌为主(图 1)。
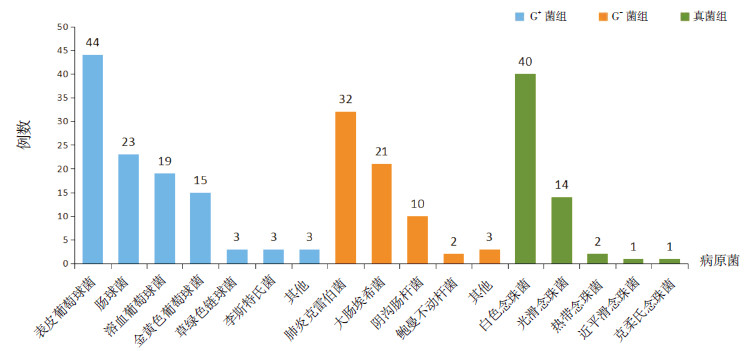 |
图 1 3组患儿病原菌构成 |
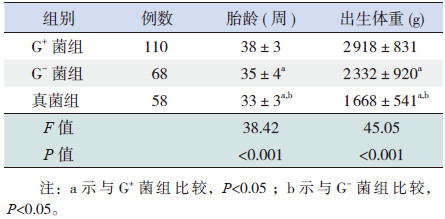
G+菌组以足月儿为主,占62%;G-菌组中足月儿占38%;真菌组中以早产儿为主,占86%。3组新生儿的胎龄、出生体重差异有统计学意义,其中G+菌组、G-菌组新生儿的胎龄和出生体重均大于真菌组,差异有统计学意义(P < 0.05);G+菌组新生儿的胎龄和出生体重大于G-菌组,差异有统计学意义(P < 0.05)(表 1)。
| 表 1 3组患儿胎龄和出生体重的比较(x±s) |
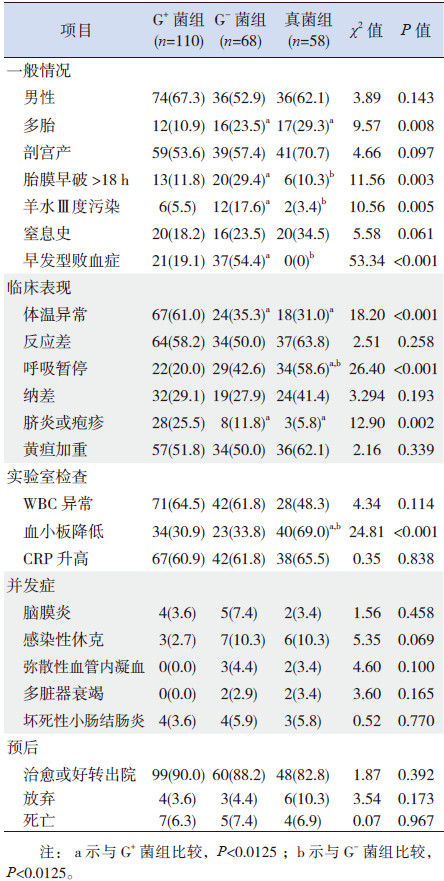
3组新生儿的性别构成、是否剖宫产及是否有窒息史的比较差异无统计学意义(P > 0.05)。G-菌组、真菌组中多胎所占比例高于G+菌组,差异有统计学意义(P < 0.0125);G-菌组与真菌组间差异无统计学意义(P > 0.0125)。G-菌组新生儿胎膜早破>18 h、羊水Ⅲ度污染、早发型败血症的发生率均高于G+菌组和真菌组,差异有统计学意义(P < 0.0125)。见表 2。
| 表 2 3组患儿临床特征的比较[n(%)] |
G+菌组起病症状为体温异常、脐炎或疱疹的发生率高于G-菌组和真菌组,差异有统计学意义(P < 0.0125);G-菌组与真菌组间差异无统计学意义(P > 0.0125)。真菌组呼吸暂停的发生率高于G+菌组和G-菌组,差异有统计学意义(P < 0.0125)。3组新生儿均表现有反应差、黄疸加重、纳差等,其发生率3组间比较差异无统计学意义(P > 0.05)。见表 2。
起病时真菌组血小板计数降低的发生率高于G+菌组和G-菌组,差异有统计学意义(P < 0.0125);G+菌组与G-菌组间差异无统计学意义(P > 0.0125)。3组新生儿起病时WBC异常、CRP升高的发生率差异无统计学意义(P > 0.05)。3组新生儿败血症的并发症、预后差异均无统计学意义(P > 0.05)。见表 2。
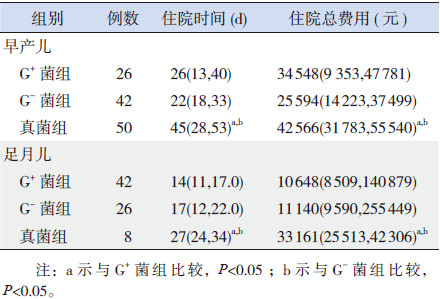
2.3 3组住院时间和住院费用的比较G+菌组、G-菌组、真菌组3组中早产儿住院时间比较差异有统计学意义(H=9.082,P=0.011),其中真菌组显著长于G+菌组和G-菌组(P < 0.05);G+菌组、G-菌组、真菌组3组中足月儿住院时间比较差异亦有统计学意义(H=21.51,P < 0.001),其中真菌组住院时间显著长于G+菌组和G-菌组(P < 0.05)(表 3)。
| 表 3 3组患儿住院时间及住院费用的比较[P50(P25,P75)] |
G+菌组、G-菌组、真菌组3组中早产儿的住院总费用比较差异有统计学意义(H=7.497,P=0.024),其中真菌组显著高于G+菌组和G-菌组(P < 0.05);G+菌组、G-菌组、真菌组3组中足月儿住院总费用比较差异有统计学意义(H=15.69,P < 0.001),其中真菌组住院总费用显著高于G+菌组和G-菌组(P < 0.05)(表 3)。
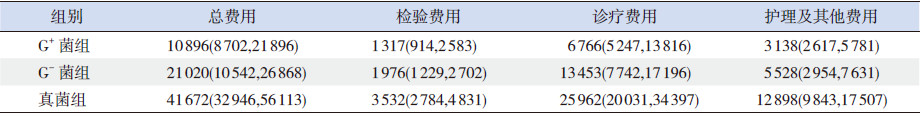
3组新生儿住院费用中,诊疗费用、检验费用、护理及其他费用的分布相似,其中均以诊疗费最高,其次为护理及其他费用,检验费用相对较低,见表 4。
| 表 4 3组患儿住院费用分布[P50(P25,P75),元] |
新生儿败血症是全球关注的公共健康问题之一,是NICU面临的主要问题和挑战之一[5],同时也是新生儿期病死率高及住院时间延长的重要原因之一[6]。由于新生儿败血症早期缺乏特异性临床表现,故不易与其他感染性疾病相鉴别[7]。本研究236例新生儿败血症中,G+菌感染占47.6%,是新生儿败血症的主要致病菌,其中以表皮葡萄球菌为主的凝固酶阴性葡萄球菌位居第一;G-菌感染占28.8%,以肺炎克雷伯菌、大肠埃希菌为主;真菌感染占24.6%,其中检出白色念珠菌40株。条件致病菌比例的明显上升,与新生儿免疫系统发育不成熟免疫功能不全、侵入性操作频繁、过度使用抗生素有关[8],提示新生儿败血症需合理应用敏感抗生素,尽量减少侵入性操作,在检查和诊疗过程中严格遵守各种消毒隔离制度,以减少条件致病菌在院内传播的机会。
本研究显示G-菌组新生儿胎膜早破>18 h、羊水Ⅲ度污染、早发型败血症的发生率均高于G+菌组和真菌组;G+菌组起病症状为体温异常、脐炎或疱疹的发生率高于G-菌组和真菌组。这些结果提示新生儿早发型败血症以G-菌感染为主,发生G-菌败血症的原因可能与产科因素如胎膜早破时间长、母亲围生期感染等因素有关,病原菌多来自母亲产道、胃肠道等[9];而新生儿晚发型败血症则以G+菌及真菌感染为主,G+菌多经皮肤、脐部致病,真菌败血症可能多因长期使用抗生素、侵袭性操作等所致。3组新生儿表现为反应差、黄疸加重、纳差等临床表现的比例差异无统计学意义,提示新生儿细菌、真菌所致败血症的临床表现无明显不同,缺乏特异性。
大量文献表明,新生儿真菌感染率正在逐年上升,低出生体重儿及极低出生体重儿真菌性败血症的发生率明显高于足月儿,病死率高,且发生率和胎龄、出生体重成反比[10, 11]。本组病例中共检出58例真菌,占28.8%,分别为白色念珠菌40例、光滑念珠菌14例、热带念珠菌2例、近平滑念珠菌1例、克柔氏念珠菌1例。真菌组早产儿、低出生体重儿的比例较G+菌组和G-菌组高,真菌组住院时间长于G+菌组和G-菌组,住院总费用高于G+菌组和G-菌组,提示患有真菌败血症的新生儿绝大多数为早产儿、低出生体重儿,其免疫力低下、原发病较多,各种侵袭性操作如静脉穿刺、吸痰、机械通气多,故住院时间长、住院费用高。另外,真菌组新生儿出现呼吸暂停的比例高于G+菌组和G-菌组,与早产儿呼吸系统发育不成熟,严重感染时内环境紊乱,导致呼吸调节障碍有关,且胎龄越小、体重越小者发生呼吸暂停的几率越高[12]。随着真菌感染的增加,三唑类抗真菌药物的耐药性日益明显。尽管本研究及其他研究均表明两性霉素B对真菌存在较高的敏感性,但其可引起肾毒性、胃肠道反应、血栓性静脉炎、寒战、高热及头痛等一系列不良反应,限制了其在新生儿中的应用[13, 14]。近年发展起来的脂质体型两性霉素B,成为抗真菌感染的新型药物,选择合适的抗真菌药物对新生儿真菌感染的预防和治疗有重要作用[15]。
疾病负担指疾病、伤残、死亡等对整个社会经济及健康的压力。患有败血症的新生儿往往住院时间长,住院费用高,重症者预后差,因此,放弃治疗率或病死率较高,给家庭和社会造成严重的疾病负担。本研究显示G+菌组、G-菌组、真菌组中早产儿、足月儿住院天数和住院总费用分别比较,真菌组均显著高于G+菌组和G-菌组,提示无论早产儿、足月儿真菌败血症的疾病负担均高于细菌败血症。3组住院费用分布相似,其中诊疗费最高,其次为护理及其他费用,检验费用相对较低,考虑与新生儿败血症患儿大多需要特级护理、入住NICU等,而新生儿,特别是早产儿接受辅助检查较少有关。
综上所述,新生儿G+菌、G-菌和真菌败血症临床特征有差异:G+菌组以足月儿为主,多有体温异常、脐炎或疱疹等临床表现;G-菌组多见于早发型败血症,胎膜早破>18 h、羊水Ⅲ度污染等围生期因素是其感染的高危因素;真菌败血症多见于早产、低出生体重儿,易发生呼吸暂停、血小板减少,其住院时间长于细菌败血症患儿,住院费用高于细菌败血症患儿。3种病原菌所致新生儿败血症的临床表现未见明显不同,无特异性,医护人员应密切观察患儿病情变化,结合实验室检查结果,尽早确诊,合理选择敏感抗生素,同时对NICU环境实施标准化管理,严格规范无菌操作,有效防治院内感染,以减轻家庭及社会负担。
| [1] | 余加林, 吴仕孝. 败血症[M]//邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学. 第4 版. 北京: 人民卫生出版社, 2011: 340-347. |
| [2] | Shane AL, Stoll BJ. Neonatal sepsis: progress towards improved outcomes[J]. J Infect, 2014, 68(Suppl 1): S24-S32. |
| [3] | 中华医学会儿科学分会新生儿学组; 中华医学会中华儿科杂志编辑委员会. 新生儿败血症诊疗方案[J]. 中华儿科杂志, 2003, 41(12): 897-899. |
| [4] | Kocabas E, Sarikcioglu A, Aksaray N, et al. Role of procalcitonin, C-reactive protein, interleukin-6, interleukin-8 and tumor necrosis factor-alpha in the diagnosis of neonatal sepsis[J]. Turk J Pediatr, 2007, 49(1): 7-20. |
| [5] | Kangozhinova K, Abentayeva B, Repa A, et al. Culture proven newborn sepsis with a special emphasis on late onset sepsis caused by Enterobacteriaceae in a level III neonatal care unit in Astana, Kazakhstan[J]. Wien Klin Wochenschr, 2013, 125(19-20): 611-615. |
| [6] | de Assis Meireles L, Vieira AA, Costa CR. Evaluation of the neonatal sepsis diagnosis: use of clinical and laboratory parameters as diagnosis factors[J]. Rev Esc Enferm USP, 2011, 45(1): 33-39. |
| [7] | 杨静, 华子瑜. NICU 医院感染及其防治[J]. 临床儿科杂志, 2014, 32(9): 808-811. |
| [8] | 彭敬红, 吕军, 吴均竹, 等. 凝固酶阴性葡萄球菌致新生儿败血症的耐药性分析[J]. 中华医院感染学杂志, 2011, 21(5): 1034-1036. |
| [9] | Kime T, Mohsini K, Nwankwo MU, et al. Central line ""attention"" is their best prevention[J]. Adv Neonatal Care, 2011, 11(4): 242-248. |
| [10] | 刘前芳, 陈新红, 张先红, 等. 220 例极低出生体质量儿医院感染的临床分析[J]. 第三军医大学学报, 2013, 25(5): 451-455. |
| [11] | Long SS, Stevenson DK. Reducing Candida infections during neonatal intensive care: management choices, infection control, and fluconazole prophylaxis[J]. J Pediatr, 2005, 147(2): 135-141. |
| [12] | 马莉, 袁卉屏. 132 例早产儿呼吸暂停临床分析[J]. 中国妇幼保健, 2008, 23(31): 4426-4427. |
| [13] | Warris A, Semmekrot BA, Voss A. Candidal and bacterial bloodstream infections in premature neonates: a case-control study[J]. Med Mycol, 2001, 39(1): 75-79. |
| [14] | 花少栋, 吴志新, 黄捷婷, 等. 早产儿白假丝酵母菌败血症 13 例临床分析[J]. 中国当代儿科杂志, 2012, 14(10): 728-732. |
| [15] | 徐豆豆, 王杨, 藏建业, 等. 新生儿重症监护病房内早产儿真菌脓毒症危险因素临床分析: 2010 年至2012 年单中心报告[J]. 中华实用儿科临床杂志, 2013, 28(18): 1393-1397. |
 2016, Vol. 18
2016, Vol. 18