2. 湖南省儿童医院呼吸科, 湖南 长沙 410007
基因多态性与儿童哮喘易感性相关,携带该基因遗传变异的儿童哮喘风险增加60%~70%。刘丽红等[3]发现,ORMDL3基因rs7216389多态性与中国成人和儿童哮喘易感均有相关性。近年来研究提示,哮喘发展过程并非完全可逆,长期反复发作可导致气道重塑并难以逆转[4]。目前研究较多的与气道重塑密切相关的细胞因子是骨桥蛋白(osteopontin,OPN)和转化生长因子β1(transforming growth factor-β1,TGF-β1)。本研究从基因水平对ORMDL3基因rs7216389位点进行单核苷酸多态性分析,以探讨湖南地区汉族儿童哮喘的ORMDL3基因多态性及与特应质间的关系,并分析其与OPN、TGF-β1的相关性,以期从遗传学及免疫学角度探讨哮喘的发病机制,为哮喘的筛查提供早期诊断方法。
1 资料与方法 1.1 研究对象收集2010年12月至2011年10月来自湖南省不同地区在湖南省儿童医院诊断为哮喘的住院儿童98例(哮喘组),均符合《儿童支气管哮喘诊断和防治指南》[5]的诊断标准。年龄0~5岁(2.2±1.6岁)。根据哮喘儿童及其3代直系亲属有无过敏性疾病(包括湿疹、过敏性鼻炎、过敏性皮炎、荨麻疹、食物药物过敏及其他过敏性疾病),分为伴特应质和无特应质哮喘亚组:伴特应质组62例,无特应质组36例。随机选取同期湖南省儿童医院小儿外科住院的0~5岁儿童30例为对照组,年龄0~5岁(1.9±1.4岁),均无哮喘及上述过敏性疾病史,且均无过敏性疾病家族史。本研究获得医院医学伦理委员会批准及家长知情同意。
1.2 标本采集采集两组儿童外周静脉血2 mL,其中1 mL全血置于乙二胺四乙酸二钾(EDTA-K2)抗凝试管充分摇匀,于-70℃冰箱冻存备用,用于提取基因组DNA;1 mL用于分离血清,将所得血清置于-70℃冰箱冻存,用于检测OPN和TGF-β1含量。哮喘组均在急性发作期采集血标本,且近2周内均未使用过全身激素。
1.3 模板DNA的提取采用北京鼎国有限公司生产的全血微量DNA提取试剂盒,按照说明书进行白细胞基因组DNA提取。-20℃保存备用。
1.4 基因组DNA的PCR扩增引物由上海英竣生物技术公司合成,上游引物:GGTGGCAACTGACTCAGAAC,下游引物:CAACCTGGCCAACATGGTGA。PCR扩增体系:Forwardprimer(5 μM)及Reverseprimer(5 μM)各1.0 μL,dNTPMixture 12.5 μL,提取所得DNA模板2.0 μL,最后加ddH2O至总体积25.0 μL。PCR扩增条件:94℃预变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸30 s,循环35次,之后72℃延伸5 min,再4℃恒温。
1.5 PCR扩增产物的纯化、回收及测序采用AXYGEN公司生产的试剂盒,按照说明书进行PCR产物纯化、回收,并将纯化所得的DNA进行测序分析。
1.6 细胞因子OPN、TGF-β1含量的检测采用酶联免疫吸附法(ELISA)测定血清细胞因子OPN、TGF-β1,实验步骤按试剂盒说明进行,根据光密度值来计算细胞因子的含量。
1.7 统计学分析应用SPSS 17.0进行统计分析,计量资料以均数±标准差(x±s)表示,多组比较采用单因素方差分析,组间两两比较采用Tukey法;计数资料以率(%)表示,组间比较采用卡方检验;相关性分析采用Pearson相关分析法;基因频率分布采用Hardy-Weinberg平衡检验。P<0.05为差异有统计学意义。
2 结果 2.1 一般资料哮喘组98例中,男性72例、女性26例,对照组30例中男性25例、女性5例。两组的性别(χ2=1.218,P=0.270)、年龄(F=0.874,P=0.384)构成比差异无统计学意义。哮喘两个亚组与对照组的性别(χ2=1.290,P=0.525)和年龄(F=2.095,P=0.127)构成比差异无统计学意义。
2.2 Hardy-Weinberg平衡检验哮喘组和对照组在扩增的335 bp长度的序列中,发现ORMDL3基因rs7216389位点可见AA、AG和GG 3种基因型,以AA纯合子基因型比例较高。采用拟和优度卡方检验分析基因型分布,符合Hardy-Weinberg平衡吻合度(P>0.05),表明所调查的群体达到了遗传平衡,具有群体代表性。
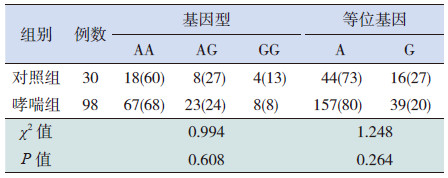
2.3 ORMDL3基因多态性在各组中的分布哮喘组与对照组基因型及等位基因构成比差异无统计学意义(P>0.05),见表 1。
| 表 1 对照组和哮喘组的基因位点多态性分布比较 [n(%)] |
哮喘伴特应质组与哮喘无特应质组的基因型及等位基因构成比差异无统计学意义(P>0.05),见表 2。
| 表 2 伴特应质组和无特应质组的基因位点多态性分布比较 [n(%)] |
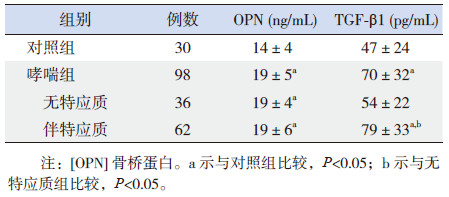
哮喘组OPN血清含量明显高于对照组(P<0.05),其中伴特应质组及无特应质组的OPN含量也明显高于对照组(P<0.05);而哮喘无特应质组与伴特应质组比较,差异无统计学意义(P>0.05)。见表 3。
| 表 3 各组血清OPN及TGF-β1含量比较 (x±s) |
哮喘组血清TGF-β1含量明显高于对照组(P<0.05),其中伴特应质组TGF-β1含量明显高于无特应质组和对照组(P<0.05),无特应质组和对照组比较差异无统计学意义(P>0.05),见表 3。
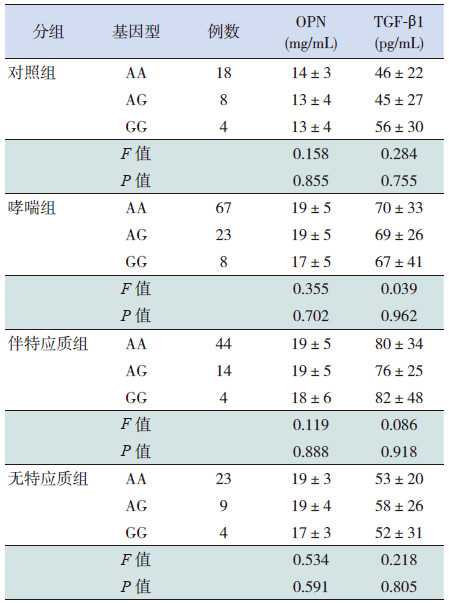
对不同基因型哮喘儿童的血清OPN及TGF-β1的含量进行比较,不同组别、基因型之间的OPN、TGF-β1细胞因子水平差异均无统计学意义(P>0.05),见表 4。
| 表 4 各组不同基因型的OPN、TGF-β1水平比较 (x±s) |
哮喘组血清中OPN含量与TGF-β1含量呈正相关(r=0.620,P<0.01),其中哮喘无特应质组与伴特应质组的血清OPN含量与TGF-β1含量亦呈正相关(r分别为0.734和0.649,均P<0.01)。见图 1~3。对照组的血清OPN含量与TGF-β1含量无相关性(r=-0.226,P=0.231)。
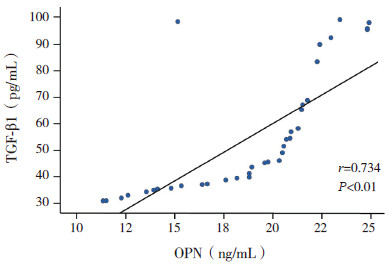 |
图 1 哮喘无特应质组血清OPN与TGF-β1的相关性 |
 |
图 2 哮喘伴特应质组血清OPN与TGF-β1的相关性 |
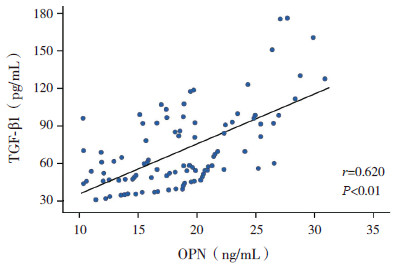 |
图 3 哮喘组血清OPN与TGF-β1的相关性 |
流行病学调查显示,哮喘病例中50% 以上有过敏史,变应性疾病使哮喘风险增加30%[6]。研究显示,哮喘儿童伴家族特应质病史者占32.6%[7],提示变应性疾病为哮喘的危险因素。Moffatt等[2]发现,ORMDL3基因是一个哮喘相关基因。ORM基因家族编码的蛋白为鞘脂类合成的负调控,基因表达的变化或者突变均可能导致鞘脂代谢紊乱,与儿童哮喘的发生有关[8]。ORMDL3通过参与细胞内钙离子信号调控、非折叠蛋白质反应等,参与哮喘的炎症反应调控[9]。
国内外对ORMDL3基因单核苷酸多态性与哮喘的关系已经进行了多项研究,但由于单个研究的样本量有限、人群不同,导致各研究结果存在一定的差异。Tavendale等[10]发现苏格兰青少年ORMDL3基因中的SNP rs7216389与哮喘易感性及病情进展相关。崔云霞等[11]也发现ORMDD基因SNP位点rs7216389多态性与儿童哮喘易感性的相关性。同时研究发现,欧洲人群ORMDL3基因(rs7216389)多态性与儿童哮喘的易感相关性高于亚洲人群[12]。金哲等[13]发现ORMDL3基因SNPs的两个位点(rs7216389,rs7216558)与北京地区儿童哮喘无相关性。而Halapi等[14]则认为,rs7216389位点与哮喘的相关性仅限于发病年龄较早的儿童哮喘,在6~13岁发病者中只观察到微弱相关性,与成人哮喘发作无相关性。本研究发现,湖南省汉族0~5岁儿童ORMDL3基因rs7216389存在单核苷酸多态性,哮喘组与对照组的基因型及等位基因构成比差异无统计学意义,提示该位点单核苷酸多态性可能与湖南省汉族儿童的哮喘易感性无关。本研究与其他类似研究结果不完全相同,不同种族间遗传背景的差异可能是主要原因,也可能与本研究样本量偏小有一定的关系。哮喘是一种多基因遗传病,众多基因相互作用、共同决定其发生发展,因此不同人群中存在的哮喘易感基因也可能不同[15]。并且,多种环境因素可以影响婴幼儿哮喘的发生,哮喘的发生与不同的环境因素也有关[16]。
近年来气道重塑被认为是不可逆性气道阻塞和气道高反应性的病理生理基础。本研究针对rs7216389基因位点与血清OPN和TGF-β1水平的关联性进行分析,发现该基因位点不影响OPN、TGF-β1的表达,可能与气道重塑无明显相关性。Kohan等[17]在小鼠哮喘模型中发现,OPN可诱导巨噬细胞活化以及成纤维细胞分化。另有研究发现哮喘患者的支气管肺泡灌洗液中OPN的含量明显增多,而且与肺泡上皮细胞中OPN的表达呈正相关[18]。OPN可通过诱导血管内皮生长因子的表达从而促进新血管生成[19]。TGF-β1可诱导上皮细胞层破坏、杯状细胞增生以及促进血管重构等,促进气道平滑肌的增生、肥大和迁移,引起气道重塑[20]。OPN能促进TGF-β1表达,进而加快组织修复[21]。
本研究发现哮喘患儿OPN及TGF-β1的含量均较对照组显著增高;其中哮喘伴特应质组血清TGF-β1含量明显高于哮喘无特应质组及对照组,哮喘儿童外周血清OPN与TGF-β1的含量呈直线正相关,提示OPN及TGF-β1均参与了哮喘的发生及发展过程,且特应质患儿TGF-β1改变更为显著。同时本研究也发现哮喘组及对照组的三个不同基因型与血清OPN和TGF-β1含量变化均无相关性,提示ORMDL3基因中rs7216389位点的不同基因型并不影响OPN、TGF-β1的表达,该基因位点可能与气道重塑无明显相关性。
| [1] | BaiJ, ZhaoJ, ShenKL, et al . Current trends of the prevalenceofchildhood asthma in three Chinese cities: a multicenter epidemiological survey[J]. Biomed Environ Sci, 2010, 23(6): 453-457. |
| [2] | Moffatt MF, KabeschM, LiangL, et a1. Genetic variants regulating ORMDL3 expression contribute to the risk of childhood asthma[J]. Nature, 2007, 448(7152): 470-473. |
| [3] | 刘丽红, 郭文才, 周江, 等. ORMDL3 基因rs7216389 多态性与中国人哮喘易感性的Meta 分析[J]. 中国循证医学杂志 2015, 15(2): 170-175. |
| [4] | Fedorov IA, Wilson SJ, Davies DE, et a1. Epitbelial stress and structural remodeling in childhood asthma[J]. Thorax, 2005, 60(5): 389-394. |
| [5] | 中华医学会儿科学分会呼吸学组, 中华儿科杂志编辑委员会. 儿童支气管哮喘诊断和防治指南[J]. 中华儿科杂志, 2008, 46(10): 745-753. |
| [6] | Tischer C, Chen CM, Heinrich J. Association between domestic mouldand mouhl components, and asthma anti allergy in chihlren: a systematicreviewl[J]. EurRespir J, 2011, 38(4): 812-824. |
| [7] | Dong GH, Ma YN, Ding Hl, et al. Pets keeping in home, parental atopy, asthmaand asthma-related symptoms in l2,910 elementary school children from Northeast China[J]. Indoor Air, 2009, 19(2): 166-173. |
| [8] | BreslowDK, Collins SR, Bodenmiller B, et al. Orm family proteins mediate sphingolipid homeostasis[J]. Nature, 2010, 463(7284): 1048-1053. |
| [9] | Cantero-Recasens G, Fandos C, Rubio-Moscardo F, et a1. The asthma-associated ORMDL3 gene product regulates endoplasmic reticulum-mediated calcium signaling and cellular stress[J]. Hum Mol Genet, 2010, 19 (1): 111-121. |
| [10] | Tavendale R, Macgregor DF, Mukhopadhyay S, et al. A polymorphism controllingORMDL3 expression is associated with asthma that is poorly controlled by current medications[J]. J Allergy Clin Immunol, 2008, 121(4): 860-863. |
| [11] | 崔云霞, 张慧妹, 师岩, 等. 0RMDL3 基因SNP 位点 rs7216389 多态性与儿童哮喘易感性关系的荟萃分析[J]. 哈尔滨医科大学学报, 2012, 46(4): 530-533. |
| [12] | 李波, 曲书强. ORMDL3/GSDMB 基因多态性与儿童支气管哮喘遗传易感性的Meta 分析[J]. 中华实用儿科临床杂志, 2013, 28(22): 1726-1728. |
| [13] | 金哲, 王金凤, 李红,等. 北京地区儿童生活方式、免疫状态及ORMDL3 基因SNPs 与哮喘发生的相关性研究[J]. 医学研究杂志, 2010, 39(11): 21-24. |
| [14] | Halapi E, Gudbjartsson DF, Jonsdpttir GM, et al. Asequence variant on 17q21 is associated with age at onset and severity of asthma[J]. Eur J Hum Genet, 2010, 18(8): 902-908. |
| [15] | Pinto LA, Stein RT, Kabesch M. Impact of genetics in childhood asthma[J]. J Pediatr(Rio J), 2008, 84(4): s68-s75. |
| [16] | 蔡迎庆, 徐孝华, 杭杲, 等. 婴幼儿哮喘与环境因素的关系分析[J]. 交通医学, 2012, 26(6): 584-589. |
| [17] | Kohan M, Breuer R, BerkmanN, et al. Osteopontin induces airway remodeling and lung fibroblast activation in a murine model of asthma[J]. Am J Respir Cell Mol Biol, 2009, 41(3): 290-296. |
| [18] | Boulassel MR, Mercier F, Gilmore N, et al. Immunophenotypic patterns of CD8+ T cell subsets expressing CD8alphaalpha and IL7Ralpha in viremic, aviremic and slow progress or HIV-1-infectedsubjects[J]. Clin Immunol, 2007, 124(2): 149-157. |
| [19] | Puxeddu I, Berkman N, Ribatti D, et al. Osteopontin is expressed and functional in human eosinophils[J]. Allergy, 2010, 65(2): 168-174. |
| [20] | Makinde T, Murphy RF, Agrawal DK. The regulatory role of TGF-beta in airway remodeling in asthma[J]. Immunol Cell Biol, 2007, 85(5): 348-356. |
| [21] | Singh M, Foster CR, Dalal S, et al. Osteopontin:role in extracellular matrix deposition and myocardial remodelingpost-MI[J]. J Mol Cell Cardiol, 2010, 48(3): 538-543. |
 2016, Vol. 18
2016, Vol. 18