支气管哮喘是一种气道变态反应性炎症性疾病,在全球范围内常见,其中过敏性哮喘与患者个人对尘螨、花粉、动物皮毛等环境物质的过敏因素相关更密切,尤其是尘螨类过敏原,易反复发作,近些年,过敏性疾病特别是过敏性哮喘发病率正在逐年升高[1]。超重或肥胖与哮喘的关联也日益受到重视,很多研究表明超重或肥胖与哮喘密切相关[2, 3, 4],但是超重或肥胖与过敏性哮喘之间的关联尚具有争议性,有些研究表明超重或肥胖与非过敏性哮喘的关联密切[5, 6],而有些研究表明超重或肥胖与过敏性哮喘关联密切[7]。皮肤点刺试验(skin prick test,SPT)是目前应用最广泛、方便、安全的检测过敏强度的方法,其可以简单准确地表示出患儿的过敏原强度及体内的组胺水平[8, 9]。本研究探讨超重与正常体重过敏性哮喘患儿特异性免疫治疗前后SPT尘螨类过敏原强度情况。
1 资料与方法 1.1 研究对象研究对象为2008年10月至2011年12月于我院呼吸科门诊就诊的215例屋尘螨变应原制剂特异性免疫治疗的过敏性哮喘患儿,其SPT均为阳性。入选标准包括:(1)符合儿童哮喘的诊断标准[10];(2)年龄3~16岁;(3)SPT屋尘螨、粉尘螨均阳性,皮肤指数(SI)均大于1/2;(4)按照2008年儿童支气管哮喘诊断与防治指南[10],均坚持使用丙酸氟替卡松吸入激素规范化治疗;(5)均予屋尘螨变应原制剂皮下特异性免疫治疗,定期随访。排除标准:依从性差,未能坚持治疗。
按照我国各年龄段的身高体重标准[11]将215例患儿分为超重组和非超重组,其中超重组有63人,平均年龄为7.8±2.8岁,男性48例,女性15例;非超重组152例,平均年龄为8.0±2.8岁,男性104例,女性48例。经6个月治疗后,再次行SPT。共收集到172例再次行SPT的患儿资料,其中超重组54例,正常体重组118例。经1年治疗后,第3次行SPT,共收集到88例第3次行SPT的患儿资料,其中超重组19例,正常体重组69例。缺失数据原因为:患儿经治疗后未再行或按时行SPT,以及部分患儿依从性差,未能坚持治疗,均予以排除。
1.2 SPT方法所有患儿均在我院行SPT,试验所用的变应原均为德国Allergopharma公司提供的标准化反应原试剂,包括屋尘螨、粉尘螨、狗毛、猫毛、鸭毛、香烟、蟑螂、霉菌、青霉菌、棉絮、花粉等。测试前5~7 d停止应用抗组胺类药和含有抗组胺作用的药物。所有操作严格按照试剂盒使用说明书进行,将试剂滴于前臂掌侧皮肤上,15~20 min后开始观察及记录皮试试验结果。皮试操作均由我院经过专业技术培训的医务人员进行,相关操作方法及判断标准均符合我院相关规范要求。
1.3 SPT结果判定采用SI,即过敏原风团或红晕直径与组胺风团直径的比值来判断SPT阳性程度及过敏程度。SI=0为“-”;0<SI<1/2为“+”;1/2≤SI<1为“2+”;1≤SI<2为“3+”;SI≥2为“4+”。具有一种或以上过敏原阳性即为SPT阳性。
1.4 特异性免疫治疗应用标准化屋尘螨变应原制剂(Mites AllergenALK 503 D.P安脱达,ALK-Abello A/S丹麦)进行特异性免疫治疗。于上臂远端三分之一的外侧进行皮下注射,治疗进程中左右上臂轮流注射。起始治疗阶段每周注射1次,连续15周,剂量分别为20、40、80、200、400、800、2 000、4 000、8 000、10 000、20 000、40 000、60 000、80 000、100 000 SQ-U。第1~3周使用1号瓶(灰盖),第4~6周使用2号瓶(绿盖),第7~9周使用3号瓶(黄盖),第10~15周使用4号瓶(红盖)。达到最高维持注射剂量即100 000 SQ-U,随后使用4号瓶维持剂量阶段进行治疗注射,隔2周注射第1次,再隔4周注射100 000 SQ-U 1次,此后3~5年内维持每6周注射1次100 000 SQ-U维持剂量,具体时间根据患儿临床表现及临床医生评估所决定。注射后留观30 min,观察注射后的不良反应。
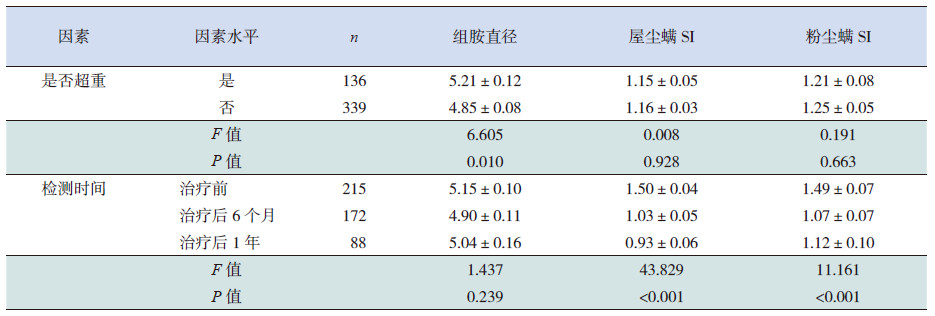
1.5 观察指标比较超重组和正常体重组两组患儿SPT结果中的屋尘螨、粉尘螨的SI、皮丘直径大小的差异,以及阳性对照组胺的皮丘直径(简称组胺直径)大小的差异;比较经过6个月及1年屋尘螨变应原制剂皮下特异性免疫治疗后SI等变化情况。
1.6 统计学分析使用SPSS 19.0软件对数据进行统计学分析。计量资料采用均数±标准差(x±s)表示,对患儿同一评价指标不同时间点的重复测量数据采用混合线性模型及方差分析的LSD法进行统计学分析。P<0.05为差异有统计学意义。
2 结果 2.1 超重及特异性免疫治疗对尘螨SI及组胺直径的影响混合线性模型统计分析显示,在控制了检测时间点变异的情况下,超重组组胺直径大于正常体重组,两组组胺直径差异有统计学意义(P<0.05);而两组患儿屋尘螨SI和粉尘螨SI比较差异无统计学意义(P>0.05)。在控制体重变异的情况下,对不同检测时间点进行分析,在接受免疫治疗前后的不同时间点,患儿组胺直径随时间变化差异无统计学意义,而屋尘螨SI和粉尘螨SI随时间变化差异有统计学意义(P<0.01)。见表 1。
| 表 1 超重及特异性免疫治疗对尘螨SI 及组胺直径的影响(x±s) |
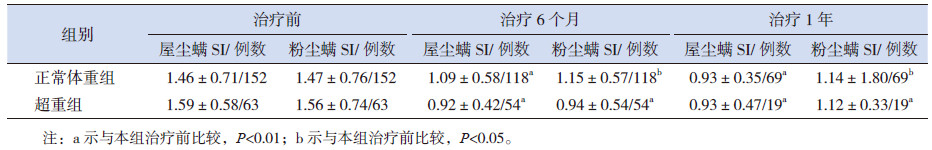
用方差分析的LSD法进行两两比较,显示两组屋尘螨SI、粉尘螨SI在治疗6个月及1年后与治疗前比较,均有明显下降(P< 0.05);治疗1年后与治疗6个月后比较,两组屋尘螨SI、粉尘螨SI差异均未见统计学意义(表 2和图 1A、B);两组组胺直径治疗前后差异均未见统计学意义(图 1C)。从图 1可看出两组治疗后前6个月屋尘螨、粉尘螨SI均值下降较快,而后6个月至1年期间屋尘螨、粉尘螨SI均值下降明显减慢,而超重组尘螨SI甚至有所回升。
| 表 2 两组特异性免疫治疗前后尘螨SI 的变化(x±s) |
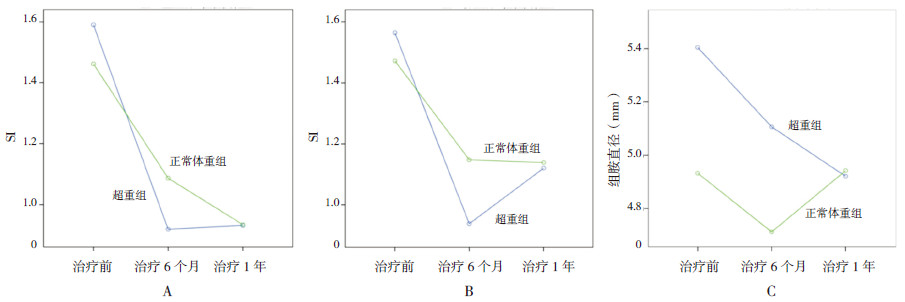 |
图 1 两组治疗后尘螨皮肤指数(SI)及组胺直径的变化
图A为治疗后屋尘螨SI的变化:与治疗前比较,两组治疗后6个月和1年屋尘螨SI明显降低;治疗后1年与治疗后6个月比较,两组屋尘螨SI均无明显差异。图B为治疗后粉尘螨SI的变化:与治疗前比较,两组治疗后6个月和1年 粉尘螨SI明显降低;治疗后1年与治疗后6个月比较,两组粉尘螨SI均未见明显变化。图C为治疗后组胺直径的变化:与治疗前比较,两组治疗后6个月和1年组胺直径变化差异无统计学意义,但可见超重组组胺直径均值逐渐下降。 |
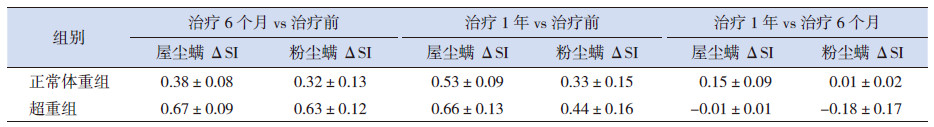
以治疗前后尘螨SI差值来表示尘螨SI的下降程度(记为ΔSI)。方差分析两两比较的LSD法分析显示,与治疗前比较,治疗后6个月及治疗后1年,两组尘螨SI均降低,且超重组屋尘螨ΔSI、粉尘螨ΔSI均值较正常体重组更大,可认为超重组尘螨SI下降程度更大;治疗后1年与治疗后6个月比较,两组尘螨SI下降未见统计学意义,无法比较哪组下降程度更大,但从ΔSI均值可见超重组在这段时期内过敏强度较前稍有所升高(表 3)。
| 表 3 两组特异性免疫治疗后尘螨SI 下降程度(ΔSI)的比较(x±s) |
哮喘是儿童最常见的疾病之一,其发病率高,且易反复发作,治疗较为困难。目前哮喘发病率逐年递升,严重影响人们的身心健康。全国儿科哮喘协作组分别在1990年、2000年、2010年对中国城市儿童哮喘患病率进行调查,依次为0.91%、1.5%、3.02%,呈逐年增高趋势[12]。尘螨是世界范围内最常见的室内过敏原和诱发哮喘的主要原因,1988年由国际免疫学会联盟举办的“尘螨变态反应工作会议”指出,尘螨变态反应是世界性卫生保健问题[13]。哮喘发病与过敏原密切相关,通过SPT,可以有效诊断过敏原,针对性地进行特异性免疫治疗和环境干预。
本研究显示,在控制了检测时间点变异的情况下,超重组组胺直径大于正常体重组,两组组胺直径差异有统计学意义,提示超重组较正常体重组过敏性哮喘患儿对组胺的反应更强烈。目前,Kang等[14]对韩国451个儿童研究显示组胺点刺试验在高体重指数儿童中反应更加强烈。Park等[15]同样研究表明组胺反应强度随体重指数升高而升高。但组胺反应强度与体重指数的相关性的机制仍不明确,研究表明肥大细胞是过敏性炎症及组胺来源的主要细胞之一,而肥大细胞的活性数量与肥胖有正相关性[14, 16, 17],同时还有研究显示血清类胰蛋白酶作为肥大细胞数量和活性的标志物,与体重指数增高呈正相关[18],这些研究可表明超重和组胺阳性反应强度的关系可能与肥大细胞的数量和活性有关[14]。也有研究表明超重或肥胖与组胺反应强度的关系是由肥胖个体的皮肤脆性[19]、肥胖个体皮肤血流量的增加引起[20]。目前组胺反应强度与体重指数或肥胖相关性的机制有待进一步研究。本研究发现,在控制了检测时间点变异的情况下,两组SPT尘螨过敏原SI差异不显著,但超重组的组胺反应更强烈,因此,可以猜想,可能是超重或肥胖个体的高组胺反应掩盖了超重与非超重过敏性哮喘患儿尘螨过敏原强度之间的差异性,有待进一步探究超重与非超重过敏性哮喘患儿尘螨sIgE之间的差异性及其机制。
本研究显示,在控制体重变异的情况下,对不同检测时间点进行分析,在接受屋尘螨变应原皮下注射特异性免疫治疗前后的不同时间点,患儿屋尘螨SI和粉尘螨SI随时间变化差异有统计学意义,提示屋尘螨变应原皮下注射特异性免疫治疗能降低过敏性哮喘患儿尘螨过敏强度。屋尘螨变应原皮下注射特异性免疫治疗为一种特异性免疫治疗,是唯一一种针对过敏性哮喘病因的治疗,其特异性免疫治疗机制目前仍尚不完全明确。本研究还发现,在治疗后第1年中,超重组较正常组屋尘螨、粉尘螨SI下降更明显。对于屋尘螨、粉尘螨特异性免疫治疗前后SI的变化与超重相关性的发生机制目前仍不明确。同时,本研究还发现,超重哮喘患儿在6个月至1年特异性免疫治疗期间,SI均值并未降低,反而有所升高,而正常体重组SI均值仍继续降低,提示观察时间还应更长。目前很多研究表明,肥胖会增加哮喘的严重程度、急性发作的危险率、住院率、激素用量,同时会增加哮喘控制的难度[21, 22],且有研究报道尘螨过敏原SPT的结果等级与哮喘急性发作严重程度之间呈正相关[23]。本研究发现特异性免疫治疗1年内,超重组尘螨过敏强度下降更显著,是否特异性免疫治疗对超重患儿效果更好,需进一步探究其临床控制、肺功能情况。本研究从两组尘螨SI变化趋势上看,可猜想,后期治疗中超重组尘螨SI可能下降更小,甚至升高,而正常体重组尘螨SI可能会继续下降,有待继续观察。
SPT结果与临床症状相关,与sIgE的符合率达80%~90%,可称为过敏反应的基础。它既代表了sIgE的水平,又反映了肥大细胞的功能和血管神经的反应性[8, 23]。有研究表明,SPT与sIgE检测对尘螨过敏原检出率的比较差异无统计学意义[23]。而有研究表明,SPT反映皮肤肥大细胞中的sIgE的水平,而sIgE检查反映血清中sIgE的水平,sIgE比SPT能更好地预测儿童过敏性疾病[24]。SPT的干扰因素较多,如操作的不规范、检查前服用抗组胺药物等,而本研究仅探究了超重、正常体重过敏性哮喘患儿特异性免疫治疗1年前后与SPT之间的关系,并未探究与sIgE之间的关系,且特异性免疫治疗一般需坚持3~5年,因此本课题组下一步将纳入sIgE进行研究,并进行更长时间的观察。
本研究并未探究1年内特异性免疫治疗的临床控制和肺功能变化情况,这也是本课题组下一步拟研究的内容。同时,本研究结果的具体相关机制有待进一步研究。屋尘螨皮下特异性免疫治疗存在一定的不良反应,本研究并未对治疗过程中出现的不良反应进行安全性评估,同样有待进一步探究。
综上所述,本研究显示,超重过敏性哮喘患儿对组胺的反应较正常体重患儿更加强烈;特异性免疫治疗能降低过敏性哮喘患儿尘螨过敏强度,在治疗后的第1年,特异性免疫治疗对减低超重过敏性哮喘患儿的尘螨过敏强度更显著,提示可将超重组特异性免疫治疗疗程改为1年。另外,特异性免疫治疗对减弱超重患儿尘螨过敏原强度的作用更显著,而尘螨过敏原SPT的结果等级与哮喘急性发作严重程度正相关[23],提示特异性免疫治疗对降低超重过敏性哮喘患儿急性发作严重程度的效果可能优于正常体重患儿。
| [1] | Jackson KD, Howie LD, Akinbami LJ. Trends in allergic conditions among children: United States, 1997-2011[J]. NCHS Data Brief, 2013(121): 1-8. |
| [2] | Kajbaf TZ, Asar S, Alipoor MR. Relationship between obesity and asthma symptoms among children in Ahvaz, Iran: a cross sectional study[J]. Ital J Pediatr, 2011, 37(1): 41-44. |
| [3] | Cibella F, Cuttitta G, La Grutta S, et al. A cross-sectional study assessing the relationship between BMI, asthma, atopy, and eNO among schoolchildren[J]. Ann Allergy Asthma Immunol, 2011, 107(4): 330-336. |
| [4] | Lang JE, Hossain J, Dixon AE, et al. Does age impact the obese asthma phenotype? Longitudinal asthma control, airway function, and airflow perception among mild persistent asthmatics[J]. Chest, 2011, 140(6): 1524-1533. |
| [5] | Visness CM, London SJ, Daniels JL, et al. Association of childhood obesitywith atopic and nonatopic asthma: results from the National Health and NutritionExamination Survey 1999-2006[J]. J Asthma, 2010, 47(7): 822-829. |
| [6] | Musaad SM, Patterson T, Ericksen M, et al. Comparison of anthropometric measuresof obesity in childhood allergic asthma: central obesity is most relevant[J]. J Allergy Clin Immunol, 2009, 123(6): 1321-1327. |
| [7] | Silverberg JI, Kleiman E, Lev-Tov H, et al. Association between obesity andatopic dermatitis in childhood: a case-control study[J]. J Allergy Clin Immunol, 2011, 127(5): 1180-1186. |
| [8] | Saglani S, McKenzie SA. Environmental factors relevant to difficult asthma[J]. Paediatr Respir Rev, 2002, 3(3): 248-254. |
| [9] | Heinzerling L, Mari A, Bergmann KC, et al. The skin prick test-European standards[J]. Clin Transl Allergy, 2013, 3(1): 3. |
| [10] | 中华医学会儿科学会呼吸学组; 中华医学会中华儿科杂志编辑委员会. 儿童支气管哮喘诊断与防治指南[J]. 中华儿科杂志, 2008, 46(10): 745-753. |
| [11] | 李辉, 季成叶, 宗心南, 等. 中国0-18 岁儿童、青少年体块指数的生长曲线[J]. 中华儿科杂志, 2009, 47(7): 493-498. |
| [12] | 全国儿科哮喘协作组. 第三次中国城市儿童哮喘流行病学调查[J] .中华儿科杂志, 2013, 51(10): 729-735. |
| [13] | 陈慧中, 沈叙庄, 陈育智. 第四届全国儿科呼吸学术会议纪要[J]. 中华儿科杂志, 1995, 33(5): 168-169. |
| [14] | Kang JW, Lee KH, Hong SC, et al. Histamine skin reactivity increases with body mass index in Korean children[J]. Int J Pediatr Otorhinolaryngol, 2015, 79(2): 111-114. |
| [15] | Park do Y, Kim YS, Kim JH, et al. Association of body mass index and other factors with histamine skin reactivity in adults with allergic nasal symptoms[J]. Am J Rhinol Allergy, 2015, 29(6): 160-163. |
| [16] | Wang J, Shi GP. Mast cell stabilization: novel medication for obesity and diabetes.[J]. Diabetes Metab Res Rev, 2011, 27(8): 919-924. |
| [17] | Liu J, Divoux A, Sun J, et al. Genetic deficiency and pharmacological stabilization of mast cells reduce diet-induced obesity and diabetes in mice[J]. Nat Med, 2009, 15(8): 940-945. |
| [18] | Fenger RV, Linneberg A, Vidal C, et al. Determinants of serum tryptase in a general population: the relationship of serum tryptase to obesity and asthma[J]. Int Arch Allergy Immunol, 2012, 157(2): 151-158. |
| [19] | Ibuki A, Akase T, Nagase T, et al. Skin fragility in obese diabetic mice: possible involvement of elevated oxidative stress and upregulation of matrix metalloproteinases[J]. Exp Dermatol, 2012, 21(3): 178-183. |
| [20] | Löffler H, Aramaki JU, Effendy I. The influence of body mass index on skin susceptibility to sodium lauryl sulphate[J]. Skin Res Technol, 2002, 8(1): 19-22. |
| [21] | Taylor B, Mannino D, Brown C, et al. Body mass index and asthma severity in the National Asthma Survey[J]. Thorax, 2008, 63(1): 14-20. |
| [22] | Lang JE, Hossain J, Smith K, et al. Asthma severity, exacerbation risk, and controller treatment burden in underweight and obese children[J]. J Asthma, 2012, 49(5): 456-463. |
| [23] | 茹凉, 张卫平, 吐尔逊娜依·玉山. 儿童哮喘过敏原检测及临床意义[J]. 临床儿科杂志, 2007, 25(1): 26-29. |
| [24] | Rø AD, Simpson MR, Storrø O, et al. The predictive value of allergen skin prick tests and IgE tests at pre-school age: the PACT study[J]. Pediatr Allergy Immunol, 2014, 25(7): 691-698. |
 2016, Vol. 18
2016, Vol. 18