2. 中南大学湘雅医院儿科, 湖南 长沙 410008
慢性肾脏病(chronic kidney disease,CKD)已成为危害全球公众健康的严重问题。肾间质纤维化是不同病因所致CKD 进展中的病理过程,也是发生终末期肾病(end-stage renal disease,ESRD)的共同通路。临床上相当一部分成人CKD 由儿童期CKD 进展而来,早期CKD 患儿几乎无症状,至20岁时约70% 的儿童CKD 患者进展为ESRD,如何延缓CKD 的进程备受关注[1]。抑制或减缓肾间质纤维化的发展有利于延缓CKD 的进程,对于延长患者的生命具有重要意义。多种细胞、细胞因子及炎症介质在肾间质纤维化过程中发挥作用,其中转化生长因子-β1(transforming growth factorbeta1,TGF-β1)是关键因子,TGF-β1过度表达可导致肾小球系膜增生、基底膜增厚,使肾小球硬化[2]。Notch1/Jagged1信号转导通路是TGF-β1延迟激活的非Smads 信号途径,调节细胞的增生、分化、生长和凋亡等,在CKD 发展过程中TGF-β1是一个促纤维化细胞因子[3]。目前肾纤维化仍然缺乏有效的治疗,抑制TGF-β1的表达可抑制肾纤维化进程,因此,有效抑制TGF-β1表达的药物有望成为治疗肾纤维化的选择。
黄芩苷是中药黄芩中提取的一种黄酮类化合物,具有抗炎、拮抗钙离子、清除自由基、抗脂质过氧化、调节免疫、促进肿瘤细胞凋亡等多种药理作用[4]。近年来研究证实黄芩苷具有抗纤维化及器官保护作用,能够通过减少TGF-β1的表达抑制肾间质纤维化的形成和发展[5];有研究发现黄芩提取物通过抗肾组织氧化损伤对肾间质纤维化大鼠模型具有抗肾间质纤维化作用[6];最新研究显示黄芩素可通过抑制磷酸肌醇3-激酶(PI3K)/Akt 信号途径诱导肌成纤维细胞的凋亡改善肾小管间质纤维化[7]。但暂无黄芩苷可能通过Notch1/Jagged1信号传导通路起到拮抗肾间质纤维化作用的相关报道。本研究通过观察黄芩苷在单侧输尿管梗阻(unliateral ureteral obstruction,UUO) 肾间质纤维化大鼠模型中的治疗作用,探讨黄芩苷调控TGF-β1/Notch1/Jagged1信号通路与肾脏保护作用的相关性,为黄芩苷治疗肾间质纤维化提供新的实验依据。
1 材料与方法 1.1 主要仪器与试剂黄芩苷(分析纯:含量≥ 98.0%)购自上海酶联生物科技有限公司,使用时以生理盐水溶解,调节pH 值至7.0,浓度为2.0%;大鼠TGF-β1ELISA 试剂盒、兔抗大鼠TGF-β1抗体及SABCPOD(羊抗兔IgG)试剂盒购自武汉博士德生物工程有限公司;大鼠Notch1 ELISA 试剂盒和大鼠Jagged1 ELISA 试剂盒购自上海(里苏)生物技术有限公司;兔抗大鼠Notch1抗体购自上海酶联生物科技有限公司。多功能酶标仪M200 PRO(瑞士TECAN 公司);Leica 光学显微镜( 德国LEICA公司)。全自动生化分析仪(美国BECKMAN 公司)。
1.2 实验动物及分组健康雄性6~8周龄Sprague Dawley 大鼠共64只,平均体重172±14 g,由中南大学实验动物学部提供,符合二级动物标准,饲养于中南大学实验动物学部。按照完全随机方法将大鼠分为假手术组、模型组、黄芩苷小剂量治疗组(简称小剂量组)和黄芩苷大剂量治疗组(简称大剂量组),每组再随机分为7 d 组和14 d 组,每组8只。
1.3 大鼠UUO 肾间质纤维化模型制作大鼠UUO 肾间质纤维化模型制作采用左侧输尿管结扎术[8]。大鼠称重后予10% 水合氯醛0.3 mL/100 g 腹腔内注射麻醉,在大鼠背部脊柱左侧作一纵向切口,逐层分离充分暴露肾脏,分离出输尿管,用“1”号丝线分别在紧靠肾盂及远离肾孟约1 cm 处结扎输尿管,在两结点中间离断输尿管,用庆大霉素生理盐水冲洗腹腔后逐层缝合,常规消毒。假手术组不结扎和剪断输尿管,其余步骤与模型组相同。大鼠麻醉苏醒后正常饲养。手术当日开始,小剂量组给予2% 黄芩苷溶液20 mg/kg,大剂量组给予2% 黄芩苷溶液40 mg/kg,腹腔注射,连续7 d 或14 d;模型组和假手术组每日给予小剂量组同等剂量的生理盐水腹腔注射。
1.4 大鼠肾组织病理标本制备于手术后7 d、14 d 用10% 水合氯醛腹腔注射麻醉大鼠,取出左侧肾脏,用生理盐水冲洗后测量其大小,放入10% 甲醛溶液中固定>1周,梯度酒精脱水、透明、浸蜡、石蜡包埋。将包埋后的大鼠肾组织切片,厚度约3.5 μm,常规苏木精-伊红染色,光镜下观察病理改变,拍照。
1.5 大鼠血清TGF-β1、Notch1和Jagged1检测观察至手术后7 d、14 d 的大鼠麻醉后,用心脏采血的方式取血。随即以3 000 r/min 离心10 min,取上清液,用eppendorf 管储存于-80℃冰箱。用双抗夹心酶联免疫吸附法(ELISA)检测TGF-β1、Notch1和Jagged1的含量,试剂采用大鼠ELISA 检测试剂盒,实验步骤按照试剂盒说明书进行。用酶标仪在450 nm 测定OD 值。以标准物的浓度为横坐标,OD 值为纵坐标,在Excel 2007软件中对数据进行直线回归分析,得出多项式方程,将样品的OD 值代入多项式方程,计算出相应的浓度。实际浓度乘以稀释倍数。
1.6 免疫组化法检测大鼠肾组织中TGF-β1和Notch1将已固定的肾组织常规脱水、浸蜡、包埋后切片,厚度约3~5 μm;载玻片采用多聚赖氨酸防脱片处理;捞片后置烤箱中,60℃约1 h,使切片紧密黏附于玻片上;切片常规脱蜡;3% 过氧化氢去离子水孵育10 min,以消除内源性过氧化物酶活性;蒸馏水洗,PBS 浸泡5 min;微波抗原修复;4% 山羊血清封闭,37℃温箱孵育30 min;甩掉多余液体,不洗;滴加兔抗大鼠TGF-β1或Notch1一抗,37℃孵育2 h,4℃过夜;PBS 洗4遍;滴加生物素标记的羊抗兔IgG 二抗,37℃孵育1 h,PBS洗3遍;滴加链霉素抗生物素蛋白-过氧化物酶溶液,37℃温箱孵育30 min,PBS 洗涤;DAB 显色,苏木素复染;封片,普通光镜下观察。阳性反应呈棕色。每只大鼠随机取3张切片,每张切片随机取5个高倍镜视野,计数每个视野阳性细胞数,算出平均数为每张切片阳性细胞的百分比。
1.7 统计学分析采用SPSS 19.0统计软件包对数据进行统计学分析,计量资料以均数± 标准差(x±s)表示,两组均数比较采用t 检验,多样本均数比较采用方差分析,组间两两比较采用SNK-q检验。相关分析采用Pearson 相关分析法。P<0.05为差异有统计学意义。
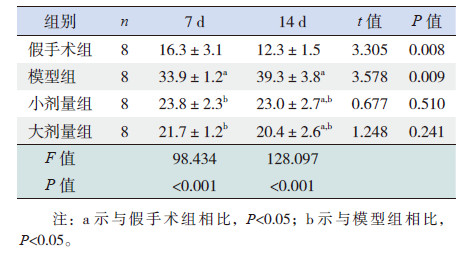
2 结 果 2.1 各组大鼠肾脏病理结果苏木精-伊红染色结果显示:7 d 和14 d 假手术组大鼠肾脏结构正常,无炎性细胞浸润,肾小球及肾小管细胞胞体清晰,轮廓正常,胞质内染色均匀,胞核及核仁清晰可见,肾小管无扩张。7 d 和14 d 模型组可见肾间质水肿,肾小管明显扩张,肾小管结构明显紊乱,间质区明显增宽,较多炎性细胞浸润,大部分肾小管上皮细胞空泡变性,部分肾小管上皮细胞坏死脱落;肾小球结构基本正常,内皮细胞清晰。小剂量组及大剂量组与模型组比较,可见炎性细胞浸润减少,肾小管扩张减轻,肾小管细胞空泡变性减少,肾小球未见明显病变;14 d 小剂量组及大剂量组分别与7 d小剂量组及大剂量组比较病变有所减轻。见图 1。
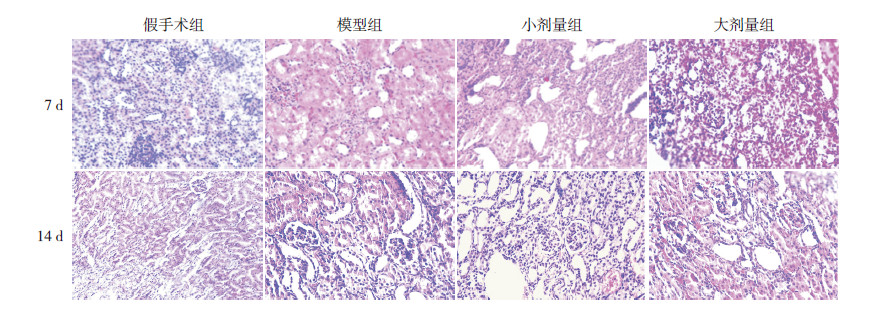 |
图 1 各组大鼠肾组织病理改变(苏木精-伊红染色,×400) 7 d 和14 d 假手术组大鼠肾脏染色均匀,无炎性细胞浸润,肾小球及肾小管细胞胞体清晰,轮廓正常,胞质内染色均匀,胞核及核仁清晰可见。7 d 和14 d 模型组大鼠可见肾间质水肿,淋巴细胞、单核细胞及少量浆细胞浸润;肾小管灶性萎缩及空泡变性;肾小球结构基本正常,基膜厚度均匀,内皮细胞清晰。小剂量组及大剂量组病变程度轻于模型组。 |
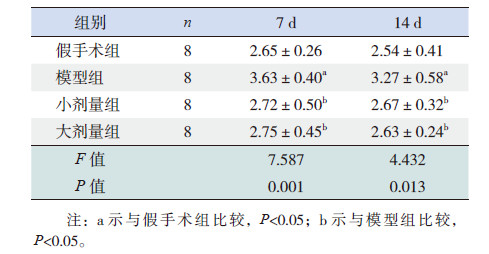
在7 d 和14 d 时模型组大鼠血清TGF-β1含量均较假手术组明显增高(P<0.05);黄芩苷治疗后,7 d 和14 d 小剂量组及大剂量组血清TGF-β1含量均较同时间点的模型组有显著下降(P<0.05);但在7 d 和14 d 时小剂量组与大剂量组比较差异无统计学意义(P>0.05)。提示血清TGF-β1在大鼠UUO 后7 d 即有明显增加,可持续至14 d;黄芩苷可抑制血清TGF-β1的增加。见表 1。
| 表 1 各组大鼠血清TGF-β1水平比较 (x±s,ng/mL) |
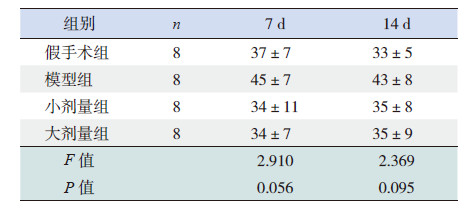
7 d 和14 d 时模型组血清Notch1含量较假手术组均有所增加,但差异无统计学意义(P>0.05);黄芩苷治疗后,7 d 和14 d 小剂量组和大剂量组血清Notch1含量均较模型组有所下降,接近假手术组水平,但差异无统计学意义(P>0.05)。见表 2。
| 表 2 各组大鼠血清Notch1水平比较 (x±s,ng/mL) |
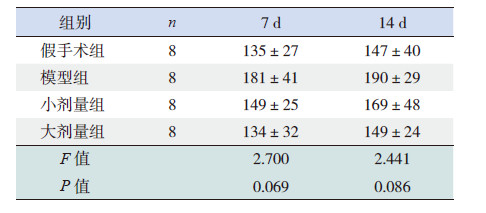
7 d 和14 d 时模型组与同时间假手术组比较血清Jagged1含量明显增加,但差异无统计学意义(P>0.05);小剂量组和大剂量组在7 d 和14 d 时血清Jagged1含量较同时间点模型组有所下降,但差异无统计学意义(P>0.05)。见表 3。
| 表 3 各组大鼠血清Jagged1水平比较 (x±s,pg/mL) |
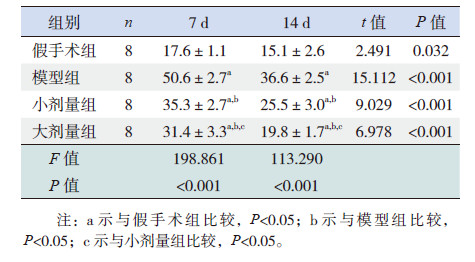
免疫组化结果显示大鼠肾组织TGF-β1的阳性细胞数在7 d 和14 d 时模型组均较同时间点假手术组明显增高(P<0.05);黄芩苷治疗后,小剂量组和大剂量组TGF-β1的阳性细胞数均较同时间点模型组减少(P<0.05),且大剂量组较小剂量组有所减少(P<0.05);14 d 时小剂量组及大剂量组与7 d 同组别比较TGF-β1的阳性细胞数减少(P<0.05)。提示黄芩苷可降低大鼠UUO 后肾组织TGF-β1的表达,且与使用时间和剂量有关。见表 4及图 2。
| 表 4 各组大鼠肾组织TGF-β1阳性细胞数比较(x±s,%) |
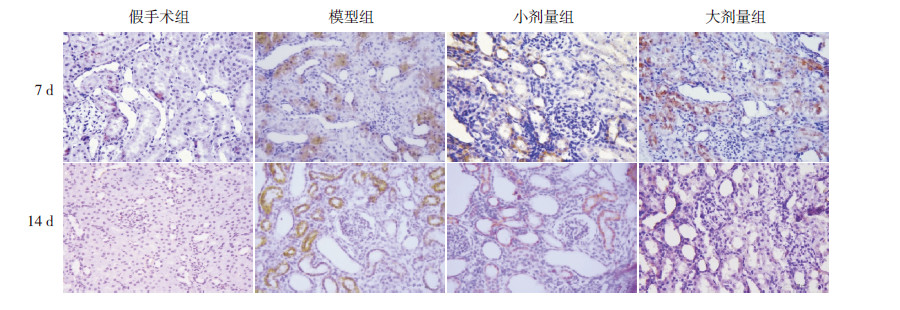 |
图 2 各组大鼠肾组织TGF-β1免疫组化结果(DAB 显色,×400) 7 d 和14 d 时模型组大鼠肾组织中TGF-β1阳性细胞均较假手术组明显增多;小剂量组及大剂量组大鼠肾组织中TGF-β1阳性细胞较模型组减少,以大剂量组更明显,但仍较假手术组增多。阳性细胞呈棕色。 |
免疫组化结果显示大鼠肾组织Notch1的阳性细胞数在7 d 和14 d 时模型组均较同时间点假手术组明显增高(P<0.05);黄芩苷治疗后,小剂量组和大剂量组Notch1的阳性细胞数均较同时间点模型组减少(P<0.05);而同时间点小剂量组与大剂量组比较及14 d 时黄芩苷治疗组与7 d 同组别比较差异均无统计学意义(P>0.05)。提示黄芩苷可抑制大鼠UUO 后肾组织Notch1的表达,但加大剂量和延长使用时间效果不明显。见表 5及图 3。
| 表 5 各组大鼠肾组织Notch1阳性细胞数比较(x±s,%) |
 |
图 3 各组大鼠肾组织Notch1免疫组化结果(DAB 显色,×400) 7 d 和14 d 时模型组大鼠肾组织中Notch1阳性细胞均较假手术组明显增多;小剂量组及大剂量组大鼠肾组织中Notch1阳性细胞较模型组减少,大剂量组较小剂量组减少不明显。阳性细胞呈棕色。 |
大鼠血清TGF-β1含量变化与血清Notch1含量变化呈正相关(r=0.650,P<0.01); 血清Notch1含量变化与血清Jagged1含量变化呈正相关(r=0.727,P<0.01)。大鼠肾组织TGF-β1与Notch1的阳性细胞数亦呈正相关(r=0.743,P<0.01)。见图 4~6。
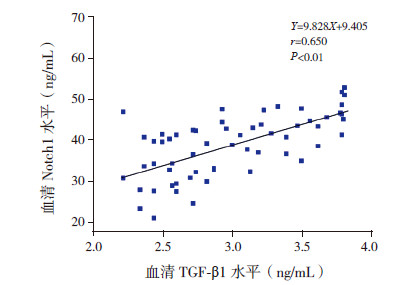 |
图 4 大鼠血清TGF-β1与Notch1水平的相关分析图 |
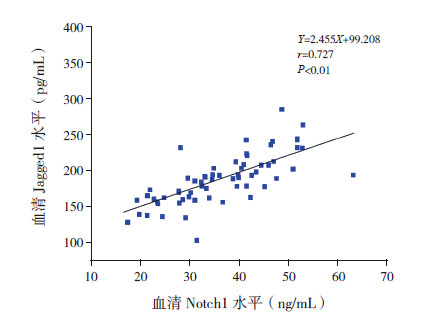 |
图 5 大鼠血清Notch1与Jagged1水平的相关分析图 |
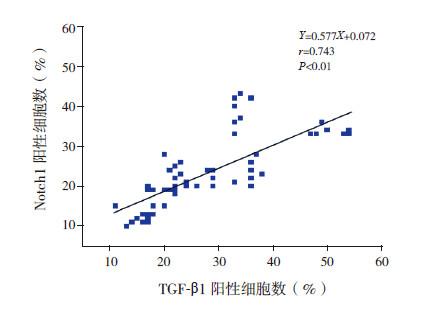 |
图 6 大鼠肾组织TGF-β1与Notch1阳性细胞数的相关分析图 |
肾间质纤维化是多种病因导致CKD 进展中的基本病理改变,也是发生ESRD 的共同通路。抑制肾间质纤维化的进程,是延长CKD 患者生命的关键,因此也成为目前CKD 的研究热点。
由于大鼠UUO 模型的病理发生过程与人类肾间质纤维化过程相似,因此是研究肾间质纤维化常用的动物模型。UUO 模型有较好的重复性,肾间质纤维化发生迅速,在输尿管结扎1周内该侧肾脏即开始出现肾间质纤维化的病理特点[8]。本研究采用结扎大鼠左侧输尿管制备UUO 模型,大鼠肾脏病理观察结果显示肾间质水肿,肾小管明显扩张,肾小管结构明显紊乱,间质区明显增宽,较多炎性细胞浸润,肾小管上皮细胞空泡变性,部分肾小管上皮细胞坏死脱落,肾小球结构基本正常,提示大鼠UUO 模型制备成功。
黄芩苷具有抗炎、抗肿瘤、调节免疫、抗变态反应、抗菌抗病毒、清除氧自由基和抗脂质过氧化等作用。谢红东等[6] 的研究结果显示黄芩提取物灌胃对肾纤维化大鼠模型有治疗作用,其机制与抗肾组织氧化损伤有关。另一项研究结果显示:黄芩素可能通过抑制TGF-β1/Smad 信号转导通路来拮抗肾间质纤维化[9]。有最新研究用黄芩素治疗UUO 小鼠模型和处理被TGF-β1激活的正常大鼠肾NRK-49F 细胞模型,结果显示黄芩素在体内及体外均能改善肾小管间质纤维化,其机制可能是通过抑制线粒体PI3k/Akt 通路诱导成肌纤维细胞的细胞凋亡[8]。本研究发现UUO 大鼠给予黄芩苷治疗后,病理观察显示小剂量组及大剂量组炎性细胞浸润减少,肾小管扩张减轻,肾小管上皮细胞空泡变性减少,提示黄芩苷治疗对改善UUO 大鼠肾脏病理有一定的作用。
细胞外基质(extracellular matrix,ECM)过度沉积是肾纤维化的特点,是公认的CKD 的一个共同病理特征。研究表明,TGF-β1为CKD 进行性肾纤维化相关的关键介质,其具有多个生物学特性,包括细胞增殖、分化、细胞凋亡、自噬和生成ECM 等[10]。在大鼠UUO 模型的研究中发现梗阻侧肾脏TGF-β1上调并诱导肾细胞产生ECM,导致肾小球硬化以及间质纤维化[11]。相当多的证据表明,TGF-β1在CKD 病人和动物模型的损伤侧肾脏表达上调[12]。本研究结果显示模型组大鼠血清TGF-β1含量及肾组织TGF-β1阳性细胞数在7 d 和14 d 时均较假手术组明显增高,提示TGF-β1参与了大鼠UUO 的病理变化,并持续至14 d,与文献报道基本一致。黄芩苷治疗后,小剂量组及大剂量组7 d和14 d 时血清TGF-β1含量及肾组织TGF-β1阳性细胞数均较同时间点模型组有显著下降;大剂量组肾组织TGF-β1阳性细胞数较小剂量组有所降低,14 d 小剂量组及大剂量组与7 d 同组别比较肾组织TGF-β1阳性细胞数下降。提示黄芩苷治疗可减少大鼠UUO 后血清TGF-β1的含量及肾组织TGF-β1的表达,且与使用时间和剂量有关。
Notch 对肾脏的发育至关重要,肾脏组织一旦发育成熟,Notch 受体和配体表达水平则很低或是无表达。当肾组织受到损伤后,Notch 信号通路的各种分子可重新表达,一方面促使组织修复和再生,另一方面加重组织的损伤[13]。研究表明活化的Notch 可能有助于急性肾损伤后的再生,但持续的Notch 表达与肾间质性纤维化和肾小球硬化有关[14]。在UUO 大鼠模型中随着肾间质纤维化程度的加重,纤维连接蛋白增加的同时 Notch1/Jagged1的表达增强,提示 Notch1/jagged1信号通路在肾间质纤维化发病机制中起重要作用[15]。本研究结果显示7 d 和14 d 模型组大鼠肾组织Notch1阳性细胞数较假手术组增加,提示Notch1参与了UUO大鼠肾组织的损伤过程,且以局部介导为主。黄芩苷治疗后,大、小剂量组7 d 和14 d 时肾组织Notch1阳性细胞数均较同时间点模型组下降;7 d和14 d 模型组血清Jagged1含量较假手术组有所增加,黄芩苷治疗后血清Jagged1含量较同时间点模型组有所下降,但差异无统计学意义。
Morrissey 等[16] 应用基因芯片筛选研究发现,UUO 大鼠模型的远端肾小管Notch1和Jagged1的基因表达上调,体外研究显示,TGF-β1可诱导人类肾小管上皮细胞的Jagged1表达,提示UUO 大鼠模型存在TGF-β1依赖的Notch 信号通路激活。有研究结果表明,Notch1信号传导途径可通过TGF-β1的活化引发糖尿病肾病[17]。本研究相关分析显示大鼠血清TGF-β1与Notch1含量变化呈正相关,肾组织TGF-β1与Notch1的表达量呈正相关,大鼠血清Notch1与Jagged1含量变化呈正相关;提示Notch1/Jagged1信号途径可能参与了大鼠UUO 的病理过程,且与TGF-β1的活化相关。黄芩苷治疗可抑制TGF-β1/Notch1/Jagged1信号途径的活化。
本研究结果显示黄芩苷治疗可减轻UUO 大鼠肾间质病变,减轻肾间质纤维化,其机制可能与抑制TGF-β1及Notch1/Jagged1表达有关。加大剂量及延长治疗时间可能增加疗效。
| [1] | 毛华雄,易著文.儿童慢性肾脏病现状与防治[J].中国实用儿科杂志, 2011, 26(6): 401-403. |
| [2] | Samarakoon R, Overstreet JM, Higgins SP, et al. TGF- β1→SMAD/p53/USF2→PAI-1 transcriptional axis in ureteral obstruction-induced renal fibrosis[J]. Cell Tissue Res, 2012, 347(1): 117-128. |
| [3] | Sirin Y, Susztak K. Notch in the kidney: development and disease[J]. J Pathol, 2012, 226(2): 394-403. |
| [4] | 黄志军.黄芩苷药理作用研究进展[J].天津药学, 2012, 24(3): 61-64. |
| [5] | 张灵灵,郭明好.黄芩苷在抗器官纤维化中的作用[J].中国临床新医学, 2010, 3(3): 289-291. |
| [6] | 谢红东,杨珂,穆焕德,等.黄芩提取物对大鼠肾间质纤维化的作用及其抗氧化机制[J].中国中西医结合肾病杂志, 2009, 10(3): 240-242. |
| [7] | Wang W, Zhou PH, Xu CG, et al. Baicalein ameliorates renal interstitial fibrosis by inducing myofibroblast apoptosis in vivo and in vitro[J]. BJU Int, 2015.[Epub ahead of print] |
| [8] | Buyukserbetci M, Dadali M, Aydogmus Y, et al. Oral misoprostol does not protect the kidneys from diclofenac induced toxicity: data from an unilateral ureteral obstructive rat model[J]. Eur Rev Med Pharmacol Sci, 2015, 19(18): 3528- 3535. |
| [9] | 王文玉,郭孜,孙淑军,等.黄芩素对大鼠肾间质纤维化的干预作用及对肾组织中TGF-β1和Smad-2表达的影响[J].长春中医药大学学报, 2012, 28(3): 383-385. |
| [10] | Meng XM, Chung AC, Lan HY. Role of the TGF-β/BMP-7/ Smad pathways in renal diseases[J]. Clin Sci (Lond), 2013, 124(4): 243-254. |
| [11] | Loeffler I, Wolf G. Transforming growth factor-β and the progression of renal disease[J]. Nephrol Dial Transplant, 2014, 29 Suppl 1: i37-i45. |
| [12] | Meng XM, Tang PM, Li J, et al. TGF-β/Smad signaling in renal fibrosis[J]. Front Physiol, 2015, 6: 82. |
| [13] | 黄仁发,周金玉,周巧玲. Notch信号通路与肾脏疾病[J].医学综述, 2013, 19(22): 4038-4041. |
| [14] | Sweetwyne MT, Tao J, Susztak K. Kick it up a notch: Notch signaling and kidney fibrosis[J]. Kidney Int Suppl (2011), 2014, 4(1): 91-96. |
| [15] | 孙彬,王笑云,王宁宁,等.大鼠单侧输尿管梗阻后肾脏 Notch1/Jagged1的表达及其意义[J].南京医科大学学报(自然科学版), 2006, 26(11): 1009-1014. |
| [16] | Morrissey J, Guo G, Moridaira K, et al. Transforming growth factor-beta induces renal epithelial Jagged-1 expression in fibrotic disease[J]. J Am Soc Nephrol, 2002, 13(6): 1499-1508. |
| [17] | Liu L, Gao C, Chen G, et al. Notch signaling molecules activate TGF-β in rat mesangial cells under high glucose conditions[J]. J Diabetes Res, 2013, 2013: 979702. |
 2016, Vol. 18
2016, Vol. 18