阵发性交感神经兴奋性增强(paroxysmalsympathetic hyperactivity,PSH)是一种通常发生在严重颅脑损伤幸存者中的临床综合征,通常表现为阵发性短暂的交感神经兴奋性增强,包括心率增快、血压升高、呼吸频率加速、发热、出汗,并伴有姿势或运动异常[1]。抗N- 甲基-D- 天门冬氨酸(N-methyl-D-aspartate,NMDA)受体脑炎经常合并自主神经功能紊乱[2],但合并PSH 却少有报道[3, 4]。现将我科收治的3例抗NMDA 受体脑炎合并阵发性交感神经兴奋性增强的临床特征总结如下。
1 资料与方法 1.1 研究对象研究对象为2014年12月至2015年6月我科收治的抗NMDA 受体脑炎合并PSH 患儿3例,年龄10~14岁,均为女性。3例患儿均行头颅MRI、脑脊液常规、生化及病原学检查、血和脑脊液NMDA 受体抗体检查、血常规及肌酶谱等相关检查。脑脊液常规、生化及病原学检查,血和脑脊液NMDA 受体抗体检查均于郑州大学第一附属医院神经内科实验室完成,NMDA 受体抗体试剂盒来自德国欧蒙医学实验诊断股份有限公司。
1.2 诊断标准抗NMDA 受体脑炎尚无统一的诊断标准,目前认为临床出现不明原因的精神障碍、记忆力下降、意识水平降低、运动障碍甚至中枢性的通气不足等,特别是伴有畸胎瘤等肿瘤情况,脑脊液或血抗NMDA 受体阳性即可诊断,而脑脊液常规生化检查多为正常或白细胞、蛋白轻度升高[2, 5]。PSH 主要根据Baguley 提出的PSH 诊断共识[1] 进行诊断。
1.3 治疗方案合并畸胎瘤的1例患儿首先予以盆腔肿瘤切除术。所有患儿均每天予以丙种球蛋白0.4 g/kg,连续5 d,并联合激素冲击治疗:甲基强的松龙每天20 mg/kg 静滴,每3d 减半量,减至每天2.5 mg/kg,3 d 后改为口服强的松每天1~1.5 mg/kg,逐渐减停。对于合并PSH 的患儿予以口服普萘洛尔(每次10 mg)和/ 或溴隐亭(每次2.5 mg),每天3次。对于合并精神障碍的2例患儿曾予以奥氮平、舒必利等抗精神病药物治疗。所有患儿在治疗过程中均予以营养神经、改善循环等对症支持治疗。
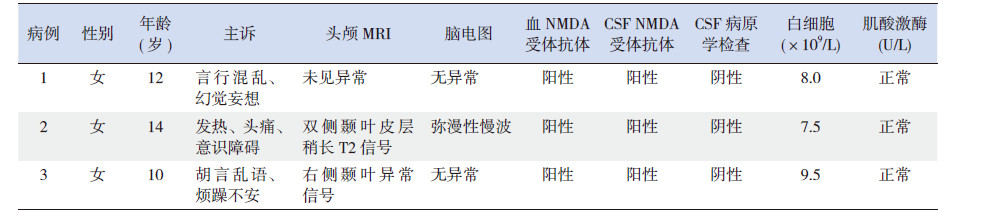
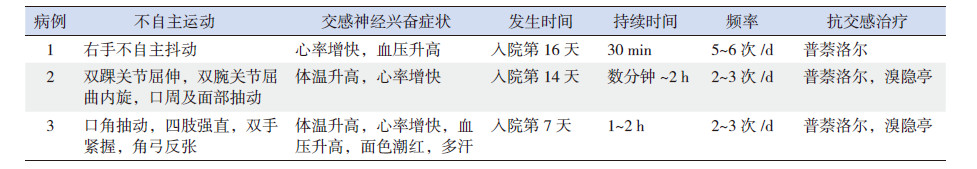
2 结 果 2.1 临床表现3例患儿均为10~14岁女性,GCS(GlasgowComa Scale)评分均低于10分。入院时生命体征基本平稳,入院后1~2周出现阵发性体温升高、心率增快、血压升高、唾液分泌增加、面色潮红、多汗、瞳孔扩大、不自主运动及肌张力异常等,发作频率为2~6次/d,持续时间从数分钟到数小时不等。肌张力障碍主要表现为口周和面部运动、四肢远端腕部及踝部不自主屈伸动作、四肢僵直、角弓反张等。其中出现阵发性血压升高2例,唾液分泌增加1例,面色潮红、多汗1例,瞳孔扩大1例。1列伴发盆腔畸胎瘤,2例出现低通气需呼吸机辅助呼吸。见表 1~2。
| 表 1 临床特征 |
| 表 2 交感神经兴奋特征 |
2例患儿头颅MRI 出现颞叶异常信号。3例患儿的血及脑脊液病原学检查均阴性,血和脑脊液NMDA 受体抗体均阳性。3例患儿脑脊液细胞数轻度升高,1例患儿脑脊液蛋白升高。3例患儿外周血白细胞数和肌酶均无明显异常。床旁脑电图显示:1例出现弥漫性持续中低波幅慢波,另2例无异常;3例患儿不自主运动时出现伪差,未发现痫性放电。见表 1。
2.3 治疗及结局病例1合并盆腔畸胎瘤,行肿瘤切除术。2例患儿曾予以抗精神病治疗。3例患儿均予以丙种球蛋白冲击及激素冲击治疗,其中1例予以口服普萘洛尔,2例予以普萘洛尔联合溴隐亭治疗。静推苯二氮卓类药物可以终止发作,其中体温升高、脉搏加快、面色潮红、多汗等症状可以在数分钟内缓解,呼吸增快、血压升高及不自主运动的缓解大约需要10 min。2例意识障碍较轻者发病后2月左右可以交流;1例意识障碍逐渐加重、最终呼吸循环衰竭死亡。
3 讨 论PSH 也称之为阵发性自主神经功能紊乱伴肌张力障碍综合征(paroxysmal autonomic instabilitywith dystonia,PAID),表现为严重的脑损伤后出现阵发性短暂的交感兴奋,即血压升高,心率、呼吸增快,意识障碍加深,肌张力障碍,多汗,瞳孔散大,每天发作3~8次,每次持续15~50 min。PSH 可以被外界刺激诱发,也可自发产生[1, 6, 7]。抗NMDA 抗体脑炎常表现出高热、心动过速、唾液分泌增加、低血压或高血压、尿失禁、勃起功能障碍等自主神经功能紊乱[2],而且以口面部异常运动为主要表现的肌张力障碍大约发生于80% 的NMDA 受体脑炎患者,12岁以下尤其多见[9]。本组3例抗NMDA 受体脑炎患儿都有典型的PSH 发作,普萘洛尔及溴隐亭治疗有效,有理由怀疑抗NMDA 受体脑炎可能是交感神经兴奋性增强伴肌张力障碍的原因之一。
PSH 确切的发病机制尚不清楚,Baguley 提出兴奋- 抑制模型学说[9],认为间脑和脑干抑制中枢可以抑制从脊髓上传的兴奋性刺激。而大脑深部组织的损伤导致抑制功能的缺失从而造成自主神经功能紊乱、功能性多巴胺活动相对减低,导致不受控制的肾上腺能物质流出,造成游离儿茶酚胺增加,从而肌体对非伤害性刺激产生过度的兴奋性反应[9]。而NMDA 受体的异位表达可能成为抗原物质,诱导机体发生免疫应答,产生抗体循环于血清及脑脊液中。NMDA 受体抗体可以攻击大脑NMDA 受体,海马和前额叶神经细胞膜表面的NMDA受体受到攻击时容易产生精神行为异常、痫性发作、意识障碍、记忆丧失[2, 9, 10, 11, 12, 13]。而NMDA受体抗体攻击大脑还可能造成类似于创伤后颅脑损伤的结构损伤,干扰交感神经环路,导致自主神经功能障碍,从而导致PSH 发作[3, 9, 12, 14]。
PSH 发作尚需与恶性综合征鉴别。恶性综合征是应用抗精神病药物,如普鲁氯嗪、氟哌啶醇等,引起的一组表现为高热、意识障碍、木僵、缄默、肌肉僵直、自主神经失调、肌酸激酶升高的严重综合征。其发病机制不清,可能由于多巴胺类药物调节肌肉张力及自主神经功能阻断后缺乏补偿引起[15]。本组病例中,病例2未使用过抗精神病药物,病例1、3使用过抗精神病药物,但恶性综合征的高热、意识障碍、肌肉僵直、自主神经失调并非阵发性发作,通常持续时间较长、可达数天,而且本组病例未发现肌酸激酶及白细胞升高现象。
通过3例抗NMDA 受体脑炎合并交感神经兴奋性增强的病例,本研究提出抗NMDA 受体脑炎可能是PSH 发作的病因之一。下一步可以仔细观察抗NMDA受体脑炎自主神经功能紊乱发病特点,从而使更多抗NMDA 受体脑炎合并自主神经功能紊乱病例得以诊断。还可以通过制造氯胺酮诱导抗NMDA 受体脑炎实验动物模型,检测发作期与非发作期儿茶酚胺神经递质的表达,进一步验证抗NMDA 受体脑炎是否可以诱导出PSH 发作[3, 4],从而将颅脑创伤后PSH 治疗经验应用到抗NMDA受体脑炎合并PSH 发作的治疗。
| [1] | Baguley IJ, Perkes IE, Fernandez-Ortega JF, et al. Paroxysmal sympathetic hyperactivity after acquired brain injury: consensus on conceptual definition, nomenclature, and diagnostic criteria[J]. J Neurotrauma, 2014, 31(17): 1515-1520. |
| [2] | Dalmau J, Lancaster E, Martinez-Hernandez E, et al. Clinical experience and laboratory investigations in patients with anti- NMDAR encephalitis[J]. Lancet Neurol, 2011, 10(1): 63-74. |
| [3] | Pryzbylkowski PG, Dunkman WJ, Liu R, et al. Case report: Anti-N-Methyl-D-Aspartate receptor encephalitis and its anesthetic implications[J]. Anesth Analg, 2011, 113(5): 1188- 1191. |
| [4] | Hinson HE, Takahashi C, Altowaijri G, et al. Anti- NMDA receptor encephalitis with paroxysmal sympathetic hyperactivity: an under-recognized association[J]. Clin Auton Res, 2013, 23(2): 109-111. |
| [5] | Mann AP, Grebenciucova E, Lukas RV. Anti-N-methyl-Daspartate- receptor encephalitis: diagnosis, optimal management, and challenges[J]. Ther Clin Risk Manag, 2014, 10: 517-525. |
| [6] | Fernandez-Ortega JF, Prieto-Palomino MA, Garcia-Caballero M, et al. Paroxysmal sympathetic hyperactivity after traumatic brain injury: clinical and prognostic implications[J]. J Neurotrauma, 2012, 29(7): 1364-1370. |
| [7] | Schroeppel TJ, Croce MA, Fabian TC. Re: Paroxysmal sympathetic hyperactivity, traumatic brain injury, and betablockers: Not all drugs are created equal[J]. J Trauma Acute Care Surg, 2014, 77(2): 387-388. |
| [8] | van de Riet EH, van Bronswijk SC, Schieveld JN. Movement disorders in anti-N-NMDA receptor encephalitis[J]. Tijdschr Psychiatr, 2015, 57(2): 109-113. |
| [9] | Baguley IJ. The excitatory:inhibitory ratio model (EIR model): An integrative explanation of acute autonomic overactivity syndromes[J]. Med Hypotheses, 2008, 70(1): 26-35. |
| [10] | Dalmau J, Gleichman AJ, Hughes EG, et al. Anti-NMDAreceptor encephalitis: case series and analysis of the effects of antibodies[J]. Lancet Neurol, 2008, 7(12): 1091-1098. |
| [11] | Hughes EG, Peng X, Gleichman AJ, et al. Cellular and synaptic mechanisms of anti-NMDA receptor encephalitis[J]. J Neurosci, 2010, 30(17): 5866-5875. |
| [12] | Moscato EH, Jain A, Peng X, et al. Mechanisms underlying autoimmune synaptic encephalitis leading to disorders of memory, behavior and cognition: insights from molecular, cellular and synaptic studies[J]. Eur J Neurosci, 2010, 32(2): 298-309. |
| [13] | 邹丽萍,刘梦佳.抗N-甲基-D-天门冬氨酸受体脑炎发病机制的研究进展[J].中国当代儿科杂志, 2014, 16(6): 571- 574. |
| [14] | Fernández-Ortega JF, Prieto-Palomino MA, Quesada-García G, et al. Findings in the magnetic resonance of paroxysmal sympathetic hyperactivity[J]. J Neurotrauma, 2011, 28(7): 1327- 1328. |
| [15] | Wei L, Chen Y. Neuroleptic malignant-like syndrome with a slight elevation of creatine-kinase levels and respiratory failure in a patient with Parkinson's disease[J]. Patient Prefer Adherence, 2014, 8: 271-273. |
 2016, Vol. 18
2016, Vol. 18