2. 重庆医科大学附属儿童医院呼吸中心, 重庆 401122
肺炎是儿童最常见的呼吸道疾病,其发病率、病死率居住院疾病首位,以咳嗽、发热、气促、呼吸困难及肺部固定湿罗音为主要表现。儿童肺炎的发病一方面与儿童特有的生理解剖特点有关,另一方面也与细菌、病毒等多种病原体感染后引发的过度免疫防御反应有关[1, 2]。肺表面活性蛋白A、D(SP-A、SP-D)是肺表面活性物质的成分之一,在肺的局部防御和免疫调节等过程中起重要作用。SP-A、SP-D不仅可增强固有免疫细胞对病原体的清除,调节细胞因子和炎症反应[1, 3],还可以调节适应性免疫应答[4],与多种肺部疾病密切相关。目前对于SP-A、SP-D在成人慢性阻塞性肺病、哮喘、肺囊性纤维化等疾病中的作用研究较多,而对于其在儿童肺炎中的作用及其与肺炎临床特征的关系研究较少。有研究表明,SP-A、SP-D可作为肺泡完整性的标志,其水平的变化可反映感染后的肺损伤程度[5, 6],探索肺炎患儿SP-A、SP-D表达及其与临床特征的关系对指导临床治疗和评估预后有重要意义。
为此,本研究对2014年10月至2015年5月在重庆医科大学附属儿童医院呼吸科住院并行支气管镜下支气管肺泡灌洗的肺炎患儿35例进行了支气管肺泡灌洗液(BALF)SP-A、SP-D的检测,并对其与临床特征的相关性进行分析。
1 资料与方法 1.1 研究对象纳入标准:符合2013年修订的《儿童社区获得性肺炎管理指南》[7, 8]的肺炎诊断标准,确诊为肺炎,因肺不张需行支气管镜下支气管肺泡灌洗治疗,或因长期反复咳嗽喘息、CT提示肺部大片病变、疑诊支气管异物等需行支气管镜明确病原或病因的患儿。
排除标准:有免疫缺陷或自身免疫性疾病、原发性纤毛运动障碍、胃食管反流、呼吸道结构异常、先天性心脏病、肺纤维化、哮喘、脓毒血症等疾病的患儿。
本研究获得患儿家长的知情同意及医院伦理委员会同意。
1.2 标本采集及处理于病变肺段快速注入生理盐水,体重小于20 kg者,每次灌洗量0.5~1 mL/kg,共3次;体重大于20 kg者,每次灌洗量20 mL,使灌洗总量达3 mL/kg,共3次。通过25~100 mm Hg(1 mm Hg=1.33 kPa)负压吸引,将第2次灌洗液吸引至一次性无菌可控式吸痰管中。标本采集均由行支气管镜术的医师执行。标本置于冰盒中,在1 h内送往儿科研究所呼吸实验室检查。将上述回收灌洗液装入15 mL塑料离心管内混匀,在4℃以下以1 200 r/min离心10 min,上清(原液)-70℃储存,用做可溶性成分的检测。经离心沉淀的细胞成分用5 mL Hank's液(不含Ca2+、Mg2+)在同样条件离心冲洗2次,每次5 min。弃去上清后加Hank's液 1 mL制成细胞悬液[9, 10]。
1.3 细胞总数和分类计数检测取制成的细胞悬液180 μL于1.5 mL EP管中,加入20 μL台盼蓝染色3 min。在Countstar计数板上计细胞总数,以1×105/L表示,用台盼蓝检测细胞活性。行细胞涂片,经瑞氏染色后涂片置于100倍光学显微镜下计数300个细胞,分别求出巨噬细胞、淋巴细胞、嗜中性粒细胞的百分比[10]。
1.4 SP-A和SP-D的检测用人SP-A、SP-D的ELISA试剂盒(SP-A:TSZ公司,美国;SP-D:R&D公司,美国)检测BALF中SP-A、SP-D水平。
1.5 临床资料的收集根据病史资料,记录以下指标:性别、年龄、病程、住院天数,发热、咳嗽、喘息、呼吸困难等症状及实验室常规检测结果等。
1.6 统计学分析应用GraphPad Prism 5统计学软件进行统计学分析,非正态分布资料以中位数(范围)表示,组间比较采用Mann-Whitney U检验。计数资料以百分比(%)表示。相关性评估采用Spearman秩相关分析。P<0.05认为差异有统计学意义。
2 结果 2.1 人口学特征共纳入35例肺炎患儿,其中男18例,女17例。中位年龄为4.08岁(0.25~12.67岁),其中<1岁5例,1岁~ 5例,3岁~ 11例,6岁~ 8例,10~12.67岁6例。住院<7 d者18例,7 d ~ 16例,14~17 d 1例。
2.2 BALF中 SP-A和SP-D水平患儿BALF中的SP-D水平为49 744(4 430~13 254)ng/L,高于SP-A水平[181(141~239)ng/L],差异有统计学意义(U=0,P<0.001)。
2.3 BALF中SP-A和SP-D与细胞学结果的相关性BALF中SP-A与中性粒细胞百分比(rs=0.06,P=0.74)、细胞总数(rs=0.10,P=0.57)、巨噬细胞百分比(rs=0.07,P=0.71)、淋巴细胞百分比(rs=0.30,P=0.39)均无相关性。而BALF中SP-D与中性粒细胞百分比呈负相关(rs=-0.5255,P=0.0029)(图 1),与细胞总数(rs=-0.32,P=0.06)、巨噬细胞百分比(rs=0.26,P=0.11)、淋巴细胞百分比(rs=0.19,P=0.30)无相关性。

|
图 1 BALF 中SP-D 水平与中性粒细胞百分比的相关性 |
35例患儿均有咳嗽,17例伴发热,体温在37.6℃ ~ 40℃之间,15例伴气促,9例伴喘息,1例伴呼吸困难。
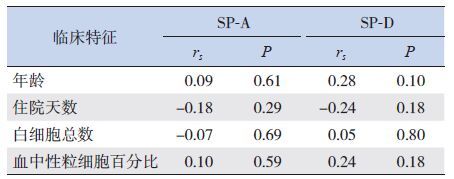
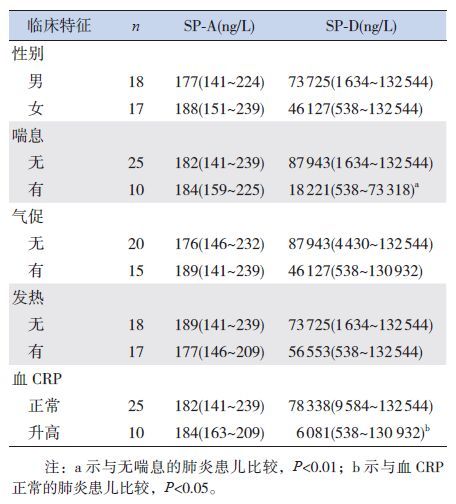
肺炎患儿BALF中SP-A、SP-D水平与患儿年龄、住院天数、血白细胞总数、血中性粒细胞百分比等临床特征无明显相关性(P>0.05)(表 1)。血C反应蛋白(CRP)水平升高(>8 mg/L)的患儿BALF中SP-D明显低于CRP水平正常的患儿(P<0.05),有喘息症状的患儿BALF中SP-D水平明显低于无喘息症状者(P<0.01)。而SP-A水平与喘息症状及CRP水平无明显关系(P>0.05)。BALF中SP-A、SP-D水平与患儿性别、发热、气促的发生也无明显关系。见表 2。
|
|
表 1 年龄等临床特征与BALF中SP-D和SP-A水平的相关性 |
|
|
表 2 性别等临床特征与BALF中SP-D和SP-A水平的关系[中位数(范围)] |
35 例肺炎患儿中,痰培养或BALF细菌培养阳性者13例,包括流感嗜血杆菌2例、副流感嗜血杆菌8例、肺炎链球菌2例、卡他莫拉菌1例(其中单独细菌阳性9例);检出支原体阳性7例(其中单独阳性6例);检出衣原体阳性1例;检出病毒阳性3例,均为呼吸道合胞病毒。细菌与支原体所致肺炎患儿BALF中SP-A(U=14.00,P=0.37)和SP-D(U=14.00,P=0.35)水平差异无统计学意义。由于病毒检出阳性的患儿均伴细菌培养阳性,故无法比较细菌培养阳性的肺炎患儿与病毒检出阳性的肺炎患儿BALF中SP-A和SP-D水平的差异。
3 讨论肺表面活性蛋白是肺表面活性物质的成分之一,包括SP-A、SP-B、SP-C、SP-D,主要由肺泡Ⅱ上皮细胞分泌。其中SP-B、SP-C的作用主要在于减少肺泡表面张力,而SP-A和SP-D具有调节肺部免疫反应的作用[3]。SP-A、SP-D属于C型血凝素亚家族的胶原凝集素亚组,是肺部免疫及抗炎反应的重要组分,通过与病原体相关的模式识别分子(PAMPs)结合,增强巨噬细胞对呼吸道病原体的调理吞噬作用[11],调节感染后的炎症反应[12],发挥着联接固有免疫和适应性免疫应答的作用。SP-A、SP-D的单倍体型及错义单核苷酸多态性与社区获得性肺炎的易感性密切相关,其中的一些单倍体也影响着肺炎的严重程度及预后[13]。目前多项研究表明,SP-A、SP-D与B组链球菌、铜绿假单胞菌、流感嗜血杆菌、支原体、呼吸道合胞病毒、A型流感病毒等肺炎常见病原体的感染密切相关[14, 15, 16, 17, 18]。有研究发现去SP-A的裸鼠更易感染流感嗜血杆菌、B组链球菌、铜绿假单胞菌,去SP-D裸鼠易感染呼吸道合胞病毒、流感病毒。此类小鼠在感染以上病原体后BALF中炎症介质水平比野生型小鼠高,同时巨噬细胞的吞噬能力下降,中性粒细胞浸润增强。而在给予外生性SP-A、SP-D处理后介质水平恢复至与野生型小鼠相当的水平[14]。BALF中SP-D缺乏的支气管炎患儿发生肺炎的概率更高,且肺炎的症状也更重[19]。
本研究发现,肺炎患儿BALF中SP-D与中性粒细胞百分比成负相关(rs=-0.5255),说明SP-D可抑制感染后的肺部炎症。该现象可能是因为SP-D可抑制细胞分泌IL-8、TNF-α、IL-6等促炎因子[1, 20, 21, 22, 23, 24],减轻炎症反应。作为中性粒细胞的趋化因子,IL-8水平的下降可能导致了炎症时中性粒细胞的募集减少。而TNF-α不仅自身可促进中性粒细胞的趋化,同时也可单独或与其他细胞因子协调诱导多种细胞产生IL-8,并扩大其致炎作用[25]。因此,TNF-α水平的下降也可能是BALF中SP-D水平较高的肺炎患儿中性粒细胞比例较低的原因之一。
SP-D对炎症的调节作用不仅表现在其与BALF中中性粒细胞比例的关系上,还表现在SP-D与血CRP的关系上。本研究发现,血CRP升高的患儿BALF中的SP-D水平显著低于CRP正常的患儿。
虽然不少研究均表示SP-A也有调节免疫及炎症反应的作用[12, 13, 17],但本研究中并未发现SP-A与BALF中细胞比例、血CRP的相关性。
对于SP-A、SP-D与临床特征的关系,本研究发现有喘息症状的肺炎患儿BALF中SP-D的水平显著低于无喘息症状的患儿。有研究发现婴幼儿喘息性肺炎存在IFN-γ/IL-4比值失衡及气道嗜酸性粒细胞炎症,与哮喘有着相似的免疫机制[2]。而动物实验表明,在给予哮喘模型小鼠SP-D处理后,小鼠BALF中IL-4、TNF-α水平显著下降,而IFN-γ水平显著上升[26]。因此,我们推论,SP-D有利于维持肺炎患儿体内IFN-γ/IL-4比值的平衡,对肺炎引起的喘息症状有保护作用。炎症因子方面,TNF-α、IL-8也参与喘息型支气管肺炎的发病过程[1]。SP-D可抑制IL-8、TNF-α等促炎因子的分泌[1, 20, 21, 22, 23, 24],减轻中性粒细胞等炎症细胞的浸润,减少呼吸道分泌物及黏液栓的形成,减轻气道壁的肿胀及支气管的痉挛,从而使喘息症状得以缓解。另一方面,SP-D可加速病原体的清除[11]。有研究发现仓鼠BALF中细菌数量与SP-D水平呈负相关[4]。因此,本研究中BALF中较高的SP-D水平相关于肺炎患儿无喘息症状可能是由于SP-D加速了肺炎患儿体内病原体的清除,减轻了病原体感染后引发的炎症反应。除此之外,也可能与SP-D可加强凋亡细胞及坏死组织的清除[3],有利于减轻坏死细胞及组织引起的小气道阻塞有关。
对于SP-A、SP-D在肺炎患儿BALF中的表达,本研究发现肺炎患儿BALF中的SP-D水平显著高于SP-A。但由于目前并未见有关正常儿童BALF中SP-A、SP-D水平的共识报道,因此无法将肺炎患儿BALF中的SP-A、SP-D水平与正常水平相比较。
综上所述,SP-D作为一种保护因素,在调节机体免疫及炎症反应中发挥重要作用,肺炎患儿BALF中SP-D水平与BALF中中性粒细胞百分比呈负相关,血CRP水平升高或有喘息症状的患儿BALF中SP-D水平更低。BALF中的SP-D水平与肺炎的临床特征密切相关,对评估肺炎的病情及指导肺炎的治疗有重要意义。
| [1] | 刘继贤, 盛锦云, 阐玉英, 等. 喘息型支气管肺炎儿血清肿瘤坏死因子、白细胞介素8 与病因、病程的关系[J]. 实用儿科临床杂志, 2000, 15(2): 83-84. |
| [2] | 郁志伟, 钱俊, 顾晓虹, 等. 婴幼儿喘息性社区获得性肺炎患儿血清炎症因子的变化[J]. 中国当代儿科杂志, 2015, 17(8): 815-818. |
| [3] | Nayak A, Dodagatta-Marri E, Tsolaki AG, et al. An insight into the diverse roles of surfactant proteins, SP-A and SP-D in innate and adaptive immunity[J]. Front Immunol, 2012, 3(5): 1-21. |
| [4] | Hagio T, Kishikawa K, Kawabata K, et al. Inhibition of neutrophil elastase reduces lung injury and bacterial count in hamsters[J]. Pulm Pharmacol Ther, 2008, 21(6): 884-891. |
| [5] | Tyrrell C, McKechnie SR, Beers MF, et al. Differential alveolar epithelial injury and protein expression in pneumococcal pneumonia[J]. Exp Lung Res, 2012, 38(5): 266-276. |
| [6] | Güzel A, Karadağ A, Okuyucu A, et al. The evaluation of serum surfactant protein D (SP-D) levels as a biomarker of lung injury in tuberculosis and different lung diseases[J]. Clin Lab, 2014, 60(7):1091-1098. |
| [7] | 中华医学会儿科学分会呼吸学组; 《中华儿科杂志》编辑委员会. 儿童社区获得性肺炎管理指南(2013 修订)( 上) [J]. 中华儿科杂志, 2013, 51(10): 745-752. |
| [8] | 中华医学会儿科学分会呼吸学组; 《中华儿科杂志》编辑委员会. 儿童社区获得性肺炎管理指南(2013 修订)( 下) [J]. 中华儿科杂志, 2013, 51 (11): 856-862. |
| [9] | de Blic J, Midulla F, Barbato A, et al. Bronchoalveolar lavage in children. ERS Task Force on bronchoalveolar lavage in children[J]. Eur Respir J, 2000, 15(1): 217-231. |
| [10] | 中华医学会呼吸病学分会. 支气管肺泡灌洗液细胞学检测技术规范( 草案) [J]. 中华结核和呼吸杂志, 2002, 25(7): 390-391. |
| [11] | Han S, Mallampalli RK. The role of surfactant in lung disease and host defense against pulmonary infections[J]. Ann Am Thorac Soc, 2015, 12(5): 765-774. |
| [12] | Ariki S, Nishitani C, Kuroki Y. Diverse functions of pulmonary collectins in host defense of the lung[J]. J Biomed Biotechnol, 2012, 2012(2): 1-7. |
| [13] | Garcia Laorden MI, de Castro FR, Sole-Violan J, et al. Influence of genetic variability at the surfactant proteins A and D in community-acquired pneumonia: a prospective, observational, genetic study[J]. Crit Care, 2011, 15(1): 15-27. |
| [14] | LeVine AM, Whitsett JA, Gwozdz JA, et al. Distinct effects of surfactant protein A or D deficiency during bacterial infection on the lung[J]. J Immunol, 2000, 165(7): 3934-3940. |
| [15] | Shu LH, Lu Q, Han LY, et al. SP-D, KL-6, and HTI-56 levels in children with mycoplasma pneumoniae pneumonia[J]. Int J Clin Exp Pathol, 2015, 8(9): 11185-11191. |
| [16] | Douda DN, Jackson R, Grasemann H, et al. Innate immune collectin surfactant protein D simultaneously binds both neutrophil extracellular traps and carbohydrate ligands and promotes bacterial trapping[J]. J Immunol, 2011, 187(4): 1856-1865. |
| [17] | Ampuero S, Luchsinger V, Tapia L, et al. SP-A1, SP-A2 and SP-D gene polymorphisms in severe acute respiratory syncytial infection in Chilean infants[J]. Infect Genet Evol, 2011, 11(6): 1368-1377. |
| [18] | Delgado C, Krotzsch E, Jimenez-Alvarez LA, et al. Serum surfactant protein D (SP-D) is a prognostic marker of poor outcome in patients with A/H1N1 virus infection[J]. Lung, 2015, 193(1): 25-30. |
| [19] | Griese M, Steinecker M, Schumacher S, et al. Children with absent surfactant protein D in bronchoalveolar lavage have more frequently pneumonia[J]. Pediatr Allergy Immunol, 2008, 19(7): 639-647. |
| [20] | Schleh C, Rothen-Rutishauser BM, Blank F, et al. Surfactant Protein D modulates allergen particle uptake and inflammatory response in a human epithelial airway model[J]. Respir Res, 2012, 13(1): 25-35. |
| [21] | Forbes LR, Haczku A. SP-D and regulation of the pulmonary innate immune system in allergic airway changes[J]. Clin Exp Allergy, 2010, 40(4): 547-562. |
| [22] | Liu CF, Rivere M, Huang HJ, et al. Surfactant protein D inhibits mite-induced alveolar macrophage and dendritic cell activations through TLR signalling and DC-SIGN expression[J]. Clin Exp Allergy, 2010, 40(1): 111-122. |
| [23] | 周佳磊, 徐冬新, 李仪, 等. TNF-α、SP-A 在儿童不同程度肺炎中的表达和临床意义[J]. 中国现代医生, 2014, 52(18): 145-147. |
| [24] | 周四芳, 胡向耘, 葛明盖, 等. 伴喘息的肺炎支原体肺炎患儿血清白细胞介素-5和血管内皮生长因子水平变化的意义[J]. 实用儿科临床杂志, 2012, 27(10): 800-801. |
| [25] | Gidaris D, Kanakoudi-Tsakalidou F, Papakosta D, et al. Bronchoalveolar lavage in children with inflammatory and non inflammatory lung disease[J]. Hippokratia, 2010, 14(2): 109-114. |
| [26] | Liu CF, Chen YL, Shieh CC, et al. Therapeutic effect of surfactant protein D in allergic inflammation of mite-sensitized mice[J]. Clin Exp Allergy, 2005, 35(4): 515-521. |
 2016, Vol. 18
2016, Vol. 18