坏死性肺炎的病理过程是肺实质液化坏死,坏死物质排出后形成空腔,其诊断有赖于肺CT,表现为肺实变内多发薄壁或无壁空腔,可相互交通融合,形成较大空腔。坏死性肺炎病情重,进展快,易出现气胸、支气管胸膜瘘等严重并发症而危及生命,但CT诊断坏死的时间平均为17 d [1],这时往往已错过最佳的治疗时机。而且CT检查有辐射损伤,价格高,短期内不宜反复进行。本研究旨在通过儿童坏死性肺炎和大叶性肺炎临床特点的对比分析,探讨儿童坏死性肺炎的早期预测指标,以便早期识别,积极治疗。
1 资料与方法 1.1 研究对象研究对象为2013年1月至2015年3月在吉林大学第一医院儿科住院时间>10 d、资料完整的43例坏死性肺炎患儿及同期住院时间>10 d、资料完整的83例大叶性肺炎患儿。
坏死性肺炎组纳入标准:(1)早期影像学表现为大叶性肺炎,入院治疗1~3周后复查肺CT肺实变内出现多发薄壁或无壁空腔,可相互交通融合,形成较大空腔;(2)排除肺脓肿、肺囊肿合并感染、肺结核等空洞性肺疾病[2],排除入院时CT检查已出现坏死以及入院时已无发热、处于恢复期的病例。大叶性肺炎组纳入标准:早期表现为大叶性肺炎,入院治疗1~3周后复查肺CT,病变吸收好转,没有空腔形成。
1.2 研究方法查阅病历,统计患儿入院前后24 h内在我院所行辅助检查的结果,包括血常规、超敏C-反应蛋白(hs-CRP)、血清白蛋白(ALB)、血清乳酸脱氢酶(LDH)、血培养、肺炎支原体IgM抗体、胸水培养、肺CT(包括入院前72 h内在外院所行肺CT)以及电子支气管镜检查及肺泡灌洗液培养(入院后24~96 h内完成)。
1.3 统计学分析采用SPSS 17.0统计学软件进行分析。符合正态分布的计量资料用均数±标准差(x ±s)表示,两组间比较采用独立样本t检验;不符合正态分布的计量资料用中位数(四分位间距)[P50(P25,P75)]表示,组间比较采用非参数检验。计数资料用百分率(%)表示,组间比较采用卡方检验。
单因素分析显示有统计学意义的指标进行多因素logistic逐步回归分析,得出坏死性肺炎的独立预测指标,再通过ROC曲线分析得出各预测指标诊断价值最大的临界值。P<0.05为差异有统计学意义。
2 结果 2.1 临床和实验室检查结果43例坏死性肺炎患儿中,37例行支气管镜检查,16例行胸腔穿刺术;83例大叶性肺炎患儿中,77例行支气管镜检查,7例行胸腔穿刺术。
坏死性肺炎组肺炎支原体抗体阳性33例(77%);细菌培养阳性9例(21%),其中肺炎链球菌4例(2例为血培养,2例为胸水培养),草绿色链球菌2例(1例血培养、1例胸水培养),凝固酶阴性葡萄球菌1例(血培养),肺炎克雷伯杆菌1例(血培养),大肠埃希菌1例(肺泡灌洗液培养)。
大叶性肺炎组肺炎支原体抗体阳性63例(76%);细菌培养阳性11例(13%),其中肺炎链球菌2例(血培养),草绿色链球菌3例(2例肺泡灌洗液培养,1例胸水培养),表皮葡萄球菌2例(1例血培养、1例肺泡灌洗液培养),凝固酶阴性葡萄球菌、松鼠葡萄球菌各1例(血培养),金黄色葡萄球菌、肺炎克雷伯杆菌各1例(肺泡灌洗液培养)。
两组年龄和细菌培养阳性率比较差异无统计学意义,而坏死性肺炎组女性患儿所占比例、发热天数、WBC、NE%、hs-CRP、ALB、LDH明显高于大叶性肺炎组,见表 1。坏死性肺炎组患儿实验室检查的时间距起病11(8,13)d,CT检查出现坏死时间距起病22±7 d。
2.2 电子支气管镜检查结果所有行支气管镜检查的患儿支气管黏膜均充血,部分管腔内有大量痰,甚至形成痰栓堵塞,需要反复灌洗或用活检钳清除,另有部分患儿支气管管腔出现不同程度狭窄(气管直径内陷≥ 1/3为轻度,≥ 1/2为中度,≥ 4/5接近闭合为重度)[3]。坏死性肺炎组有11例(26%)肺泡灌洗液呈浑浊的米汤样,而大叶性肺炎组无一例。两组痰栓堵塞需要活检钳清除和肺泡灌洗液呈浑浊的米汤样患儿的比例差异有统计学意义,其他方面两组比较差异无统计学意义(表 1)。坏死性肺炎组患儿首次接受支气管镜检查的时间距起病15±6 d。
|
|
表 1 两组患儿临床和辅助检查结果对比 |
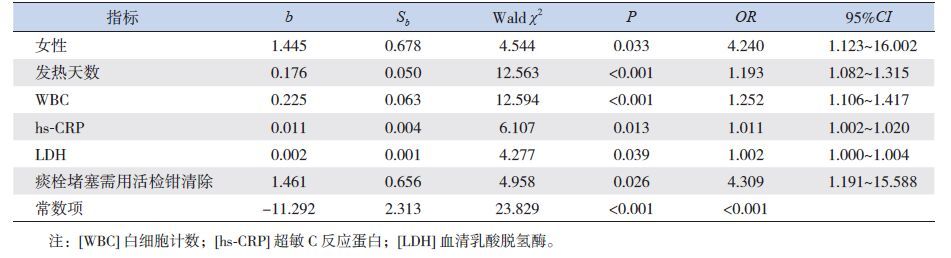
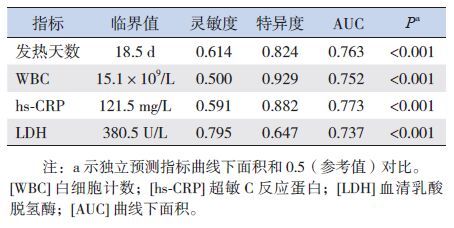
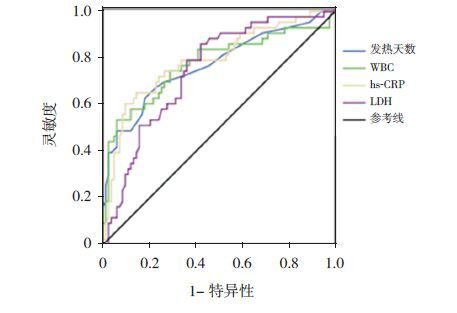
将上述单因素分析有统计学意义的指标,即女性患儿比例、发热天数、WBC、NE%、hs-CRP、ALB、LDH及支气管镜下痰栓堵塞需要活检钳清除,进行多因素logistic逐步回归分析,显示女性患儿、发热天数、WBC、hs-CRP、LDH及支气管镜下痰栓堵塞需要活检钳清除是坏死性肺炎的独立预测因素(表 2)。然后对发热天数、WBC、hs-CRP、LDH绘制ROC曲线(图 1),其预测坏死性肺炎的临界值分别为18.5 d、15.1×109/L、121.5 mg/L、380.5 U/L(表 3)。
|
|
表 2 坏死性肺炎独立预测指标的多因素logistic 回归分析结果 |
|
图 1 发热天数、WBC、hs-CRP、LDH预测坏死性 肺炎的ROC曲线 |
|
|
表 3 坏死性肺炎独立预测指标的ROC 曲线临界值 |
儿童坏死性肺炎是一种严重的空洞性肺炎,近年来发病率有所增加[4, 5, 6]。其早期表现类似大叶性肺炎,但病情重,进展快,容易出现脓胸、气胸、支气管胸膜瘘、急性呼吸衰竭等并发症。通常药物治疗即可,也有学者建议早期行胸腔镜手术[7],出现严重脓毒症、气胸、支气管胸膜瘘者需要肺切除术治疗[8]。从本研究结果可以看出,坏死性肺炎倾向于发生在女孩,以往的一些研究[4, 9]也有类似报道,但原因不明,考虑到坏死性肺炎的研究样本都不是很大,目前尚不宜定论。
本研究中坏死性肺炎患儿年龄以学龄前期为主,而以前报道的一些坏死性肺炎患儿年龄要小一些[4, 9],这可能与病原体不同有关。以往的研究表明,细菌是坏死性肺炎的首要病原,以肺炎链球菌和金黄色葡萄球菌最常见[1, 4, 5],但近年来关于肺炎支原体引起坏死性肺炎的报道越来越多,李素荣等[10]的研究显示在坏死性肺炎中,肺炎支原体感染占58%。本研究中无论是坏死性肺炎组还是大叶性肺炎组,肺炎支原体感染率都很高。需要注意的是,由于抗生素的广泛使用、检测方法有限等原因,细菌培养阳性率并不高,因此明确存在肺炎支原体感染的坏死性肺炎患者是否合并了细菌感染,仍是一个难以回答的问题。但从本研究结果来看,细菌培养阳性对预测坏死性肺炎并没有统计学意义。
坏死性肺炎组发热天数比大叶性肺炎组长,但直到起病18.5 d时特异度才达到0.824,而在本研究中CT诊断坏死性肺炎的时间平均为22±7 d。因此发热天数长对于在疾病早期预测坏死性肺炎的意义不是很大。
实验室检查早期就能体现疾病的严重程度,且易于反复进行。外周血白细胞及分类、hs-CRP是最常用的炎症指标。血清ALB和LDH也是临床常用指标,前者与疾病严重性密切相关[11],后者可反映组织损伤的程度。本研究表明,WBC、hs-CRP和血清LDH是坏死性肺炎的独立预测因素。WBC在15.1×109/L时预测坏死性肺炎的灵敏度是0.5,特异度是0.929,分类通常以中性粒细胞为主。hs-CRP在121.5 mg/L时诊断价值最大,与Hsieh等[12]的报道一致。LDH值为380.5 U/L时诊断价值最大,但此时特异度只有0.647。临床上有时需提高诊断的特异度以决定是否实施胸腔镜手术或选用糖肽类抗生素,此时LDH的值可选为578.5 U/L,特异度可达0.859[7, 9]。
支气管镜技术在大叶性肺炎的诊治中应用广泛。本研究表明,肺泡灌洗液呈浑浊的米汤样对诊断坏死性肺炎的特异度是100%,灵敏度是25.6%。这种肺泡灌洗液含有坏死组织成分,静置后常有分层、沉淀,但此时CT检查不一定出现空腔。此外,支气管镜下出现顽固痰栓堵塞需要活检钳才能清除也是坏死性肺炎的独立预测因素,这样的患儿临床表现、炎症指标及影像学检查往往改变也很明显。支气管镜术不仅有助于早期诊断,同时能够减少炎症介质、清除痰栓、解除支气管狭窄等,对坏死性肺炎患儿的病情恢复很有帮助。
感染中毒症状明显、呼吸困难、外周血不成熟中性粒细胞增多[12]、降钙素原、肺部超声图上出现肺血流灌注减少及低回声区[13]、CT上病变范围等对预测坏死性肺炎可能也有意义,但由于是回顾性研究,一些资料不全,故未纳入研究,这是本研究的不足之处。
总之,当一个大叶性肺炎患儿外周血WBC ≥ 15.1×109/L、hs-CRP ≥ 121.5 mg/L、LDH ≥ 380.5 U/L或支气管镜下见痰栓堵塞需要活检钳才能清除时需高度警惕坏死性肺炎,肺泡灌洗液呈浑浊的米汤样预测价值更大。对于这些患儿,需要及时复查肺CT明确诊断,并给予积极的治疗方案,预防和减少并发症的发生。
| [1] | Hacimustafaoglu M, Celebi S, Sarimehmet H, et al. Necrotizing pneumonia in children[J]. Acta Paediatr, 2004, 93(9): 1172-1177. |
| [2] | 刘帅帅, 宋丽君. 16 例儿童坏死性肺炎临床分析[J]. 中国当代儿科杂志, 2014, 16(10): 993-996. |
| [3] | 江沁波, 刘玺诚, 江载芳, 等. 小儿气管支气管软化症临床表现及纤维支气管镜诊断研究[J]. 中国实用儿科杂志, 2002, 17(5): 277-279. |
| [4] | Lemaître C, Angoulvant F, Gabor F, et al. Necrotizing pneumonia in children: report of 41 cases between 2006 and 2011 in a French tertiary care center[J]. Pediatr Infect Dis J, 2013, 32(10): 1146-1149. |
| [5] | Sawicki GS, Lu FL, Valim C, et al. Necrotizing pneumonia is an increasingly detected complication of pneumonia in children[J]. Eur Res Pir J, 2008, 31(6): 1285-1291. |
| [6] | Krenke K, Sanocki M, Urbankowska E, et al. Necrotizing pneumonia and its complications in children[J]. Adv Exp Med Biol, 2015, 857: 9-17. |
| [7] | Macedo M, Meyer KF, Oliveira TC. Necrotizing pneumonia in children submitted to thoracoscopy due to pleural empyema: incidence, treatment and clinical evolution[J]. J Bras Pneumol, 2010, 36(3): 301-305. |
| [8] | Westphal FL, Lima LC, Netto JC, et al. Surgical treatment of children with necrotizing pneumonia[J]. J Bras Pneumol, 2010, 36(6): 716-723. |
| [9] | 刘金荣, 徐保平, 李惠民, 等. 肺炎链球菌坏死性肺炎20 例诊治分析[J]. 中华儿科杂志, 2012, 50(6): 431-434. |
| [10] | 李素荣, 牟京辉, 常丽, 等. 肺炎支原体感染所致儿童坏死性肺炎30 例肺CT 表现及转归[J]. 中华儿科杂志, 2013, 51(3): 211-215. |
| [11] | 钱娟, 王莹, 李璧如, 等. 小婴儿肺炎血清白蛋白浓度检测临床意义探讨[J]. 中国当代儿科杂志, 2004, 6(2): 139-140. |
| [12] | Hsieh YC, Hsueh PR, Lu CY, et al. Clinical manifestations and molecular epidemiology of necrotizing pneumonia and empyema caused by Streptococcus pneumoniae in children in Taiwan[J]. Clin Infect Dis, 2004, 38(6): 830-835. |
| [13] | Lai SH, Wong KS, Liao SL. Value of lung ultrasonography in the diagnosis and outcome prediction of pediatric communityacquired pneumonia with necrotizing change[J]. PLoS One, 2015, 10(6): e0130082. |
 2016, Vol. 18
2016, Vol. 18