2. 南京医科大学附属南京儿童医院肾脏科, 江苏 南京 210008
支气管哮喘是一种由嗜酸性粒细胞、中性粒细胞等多种炎症细胞参与的气道慢性炎症,嗜酸性粒细胞在哮喘发病机制中的作用已引起广泛关注,而中性粒细胞的作用并不十分明了、也常常被忽视[1]。哮喘患者急性发作时气道中性粒细胞增多,中性粒细胞活化产生的中性粒弹性蛋白酶(neutrophil elastase,NE)诱导气道粘液腺增生、粘液分泌增多、气道平滑肌细胞增殖,参与哮喘的病理过程[2, 3]。受试者工作特征曲线(receiveroperator characteristic curve,ROC)可用来表达灵敏度与特异度的关系,常用于临床疾病检测指标的评价。哮喘的发病可起始于学龄前,而有关学龄前儿童哮喘诊断和评估的手段有限,缺乏客观评价指标和生物标记物[4]。通过对学龄前哮喘患儿NE水平的检测及其ROC曲线分析,有助于了解NE在学龄前儿童哮喘发病机制中的作用,为学龄前儿童哮喘的诊断提供新的依据。
1 资料与方法 1.1 研究对象选择2008年1月至2010年1月无锡市儿童医院诊断为哮喘的门诊或住院的学龄前儿童85例,年龄3.1~6.0岁,分为急性发作组(急性组,44例)和非急性发作组(非急性组,41例)。诊断符合学龄前儿童支气管哮喘诊断与管理指南标准[4]。对照组35例来源于同期门诊体检的健康儿童,排除既往有喘息及慢性咳嗽病史、近4周有呼吸道感染病史、以及个人及家族过敏史者。3组在年龄(H=1.9832,P=0.3710)、性别 (χ2=0.3351,P=0.8458)构成比差异无统计学意义(P>0.05)。本研究获医院伦理委员会批准和家长知情同意。
1.2 实验室检测抽取静脉血、分离血清,储存于-70 ℃冰箱待测。ELISA法检测血清NE和白细胞介素8(interleukin-8,IL-8)水平(试剂来源:上海西唐生物科技有限公司),操作按说明书进行。
1.3 统计学分析采用SAS 9.3统计软件进行统计学处理。计量资料数据先采用Shapiro-Wilk法进行正态检验,不符合正态分布的以中位数(四分位间距)[P50(P25,P75)]表示。组间比较采用Kruskal-Wallis秩和检验,多组间两两比较采用Nemenyi法;相关分析采用Spearman等级相关分析;绘制ROC曲线判断最佳的诊断值。P<0.05为差异有统计学意义。
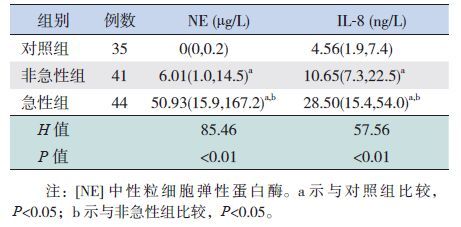
2 结果 2.1 各组血清NE和IL-8水平的比较对照组、哮喘非急性发作和急性发作组3组间血清NE水平比较差异具有显著性(H=85.46,P<0.01),其中急性组和非急性组均高于对照组(χ2=84.45、23.59,P<0.05),急性组高于非急性组(χ2=19.71,P<0.05)。见表 1。
|
|
表 1 3组患儿的血清NE和IL-8水平[P50(P25,P75)] |
急性组和非急性组IL-8水平均高于对照组(χ2=57.44、19.73,P<0.05),而急性组高于非急性组(χ2=10.24,P<0.05),见表 1。
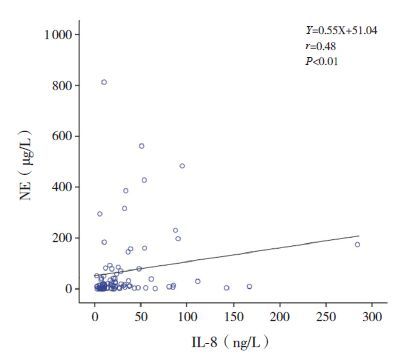
2.2 血清NE和IL-8水平的相关分析哮喘患儿血清NE与IL-8水平呈正相关(r=0.48,P<0.01),见图 1。
|
图 1 血清NE和IL-8水平的相关性分析 |
选择ROC曲线上最靠近左上角的截断点(即灵敏度与特异度均最高为临界点)作为判断标准,即以血清NE水平>27.73 μg/L作为判断哮喘急性发作的界值,具有较好的灵敏度(65.9%)和特异度(95.1%),ROC曲线下面积为0.87(95%CI:0.78~0.93,Z=9.28,P<0.01,见图 2。

|
图 2 血清中性粒细胞弹性蛋白酶ROC曲线 |
儿童哮喘可始于学龄前,导致气道损伤。由于学龄前哮喘儿童不能配合传统的肺功能检测,也缺乏可靠的生物标记物等评价指标,预后判断具有不确定性[4]。因此,寻找适于学龄前儿童哮喘急性发作的判断与评估指标,有助于学龄前哮喘儿童的个体化治疗。
哮喘的气道炎症具有异质性,包括白细胞介素-5介导的嗜酸性粒细胞炎症和白细胞介素-8介导的中性粒细胞炎症,而气道的中性粒细胞炎症有可能引起全身播散,导致“溢出效应”,即循环中炎症介质升高,因而引起系统性炎症[5]。嗜酸粒细胞阳离子蛋白是由嗜酸粒细胞释放的主要毒性蛋白颗粒,检测血清嗜酸粒细胞阳离子蛋白可直接反映气道内嗜酸性粒细胞的活化程度[6]。而NE是中性粒细胞脱颗粒释放的主要毒性蛋白颗粒,血清NE可反映气道中性粒细胞的活化程度[3]。本研究发现,哮喘急性发作组、非急性发作组血清NE水平均高于对照组。提示哮喘患儿存在非嗜酸粒细胞介导的气道炎症[7, 8]。哮喘急性发作组NE水平高于非急性发作组,提示急性发作期的气道中性粒细胞浸润程度较非急性期严重。
研究表明,哮喘患者病情加重时,气道中性粒细胞数目明显增多[9]。气道中性粒细胞增多是通过中性粒细胞化学趋化因子,诱导中性粒细胞的迁移和活化,持续吸引中性粒细胞至炎症部位,释放炎性介质,参与气道炎症的过程。本研究发现,哮喘急性发作组血清IL-8水平高于非急性组和正常组,血清NE与IL-8水平呈正相关。IL-8是中性粒细胞化学趋化因子,其选择性趋化作用强,能诱导和增强中性粒细胞脱颗粒释放中性粒细胞弹性蛋白酶,导致中性粒细胞浸润所致的气道炎症,参与哮喘的发病过程[10, 11]。
通过对学龄前哮喘患儿血清NE水平的ROC曲线分析发现,以NE水平>27.73 μg/L作为判断哮喘急性发作的界值,其灵敏度为65.9%、特异度为95.1%,ROC曲线下面积为0.87,有中等诊断价值。提示反映气道中性粒细胞活化程度的血清NE水平有助于学龄前儿童哮喘急性发作的诊断。
既然反映气道中性粒细胞活化程度的血清NE检测有助于学龄前儿童哮喘急性发作诊断,反之也提示气道过多的中性粒细胞及其活化产生的NE在哮喘急性发作过程中发挥着特殊的病理作用,相关研究也已证实这一观点[2, 3]。如何对哮喘急性发作时过度活化的中性粒细胞进行干预,阻断这一病理过程,进而减轻哮喘急性发作导致的气道损伤,值得进一步研究。有报道[12, 13],大环内酯类抗生素如克拉霉素、阿奇霉素等具有非特异性的抗炎作用,可减少难治性哮喘、尤其是非嗜酸性粒细胞性哮喘患者痰液内的IL-8水平及中性粒细胞数量,改善哮喘症状评分、提高生活质量。相关研究也证实可采用中性粒细胞弹性蛋白酶的小分子拮抗剂,直接对抗中性粒细胞活性来治疗包括哮喘在内的肺部炎症性疾病[14]。因此,通过对NE水平的检测,不仅有助于哮喘急性发作的诊断,而且随着哮喘中性粒细胞气道炎症研究的深入,针对中性粒细胞的靶向治疗将会日益受到关注并得到临床推广。
| [1] | Nair P, Aziz-Ur-Rehman A, Radford K. Therapeutic implications of 'neutrophilic asthma'[J]. Curr Opin Pulm Med, 2015, 21(1):33-38. |
| [2] | Mann BS, Chung KF. Blood neutrophil activation markers in severe asthma: lack of inhibition by prednisolone therapy[J]. Respir Res, 2006, 7(1): 59. |
| [3] | Baines KJ, Simpson JL, Wood LG, et al. Systemic upregulation of neutrophil α-defensins and serine proteases in neutrophilic asthma[J]. Thorax, 2011, 66(11): 942-947. |
| [4] | Ducharme FM, Dell SD, Radhakrishnan D, et al. Diagnosis and management of asthma in preschoolers: A Canadian Thoracic Society and Canadian Paediatric Society position paper[J]. Can Respir J, 2015, 22(3): 135-143. |
| [5] | Wood LG, Baines KJ, Fu J, et al. The neutrophilic inflammatory phenotype is associated with systemic inflammation in asthma[J]. Chest, 2012, 142(1): 86-93. |
| [6] | Chu YT, Chiang W, Wang TN, et al. Changes in serum eotaxin and eosinophil cationic protein levels, and eosinophil count during treatment of childhood asthma[J]. J Microbiol Immunol Infect, 2007, 40(2): 162-167. |
| [7] | 安淑华, 田文秋, 李金英. 呼出气一氧化氮检测在幼儿支气管哮喘中的应用分析[J]. 中国当代儿科杂志, 2015, 17(2): 134-137. |
| [8] | Yoshihara S, Yamada Y, Abe T, et al. Association of epithelial damage and signs of neutrophil mobilization in the airways during acute exacerbations of paediatric asthma[J]. Clin Exp Immunol, 2006, 144(2): 212-216. |
| [9] | Lee TH, Song HJ, Park CS. Role of inflammasome activation in development and exacerbation of asthma[J]. Asia Pac Allergy, 2014, 4(4): 187-196. |
| [10] | Hosoki K, Ying S, Corrigan C, et al. Analysis of a Panel of 48 Cytokines in BAL Fluids Specifically Identifies IL-8 Levels as the Only Cytokine that Distinguishes Controlled Asthma from Uncontrolled Asthma, and Correlates Inversely with FEV1[J]. PLoS One, 2015, 10(5): e0126035. |
| [11] | Matsuoka H, Niimi A, Matsumoto H, et al. Inflammatory subtypes in cough-variant asthma: association with maintenance doses of inhaled corticosteroids[J]. Chest, 2010, 138(6): 1418-1425. |
| [12] | Simpson JL, Powell H, Boyle MJ, et al. Clarithromycin targets neutrophilic airway inflammation in refractory asthma[J]. Am J Respir Crit Care Med, 2008, 177(2): 148-155. |
| [13] | Brusselle GG, Vanderstichele C, Jordens P, et al. Azithromycin for prevention of exacerbations in severe asthma (AZISAST): a multicentre randomised double-blind placebo-controlled trial[J]. Thorax, 2013, 68(4): 322-329. |
| [14] | Tsai YF, Hwang TL. Neutrophil elastase inhibitors: a patent review and potential applications for inflammatory lung diseases (2010-2014)[J]. Expert Opin Ther Pat, 2015, 25(10): 1145-1158. |
 2016, Vol. 18
2016, Vol. 18