2. 深圳市儿童医院血液肿瘤科, 广东 深圳 518038;
3. 深圳市儿童医院儿科研究所, 广东 深圳 518038;
4. 深圳市儿童医院检验科, 广东 深圳 518038
葡萄糖-6-磷酸脱氢酶(glucose-6-phosphatedehydrogenase,G6PD)缺乏症是最常见的遗传性溶血性红细胞酶缺陷病,全球约4亿人受累[1],已报道有近200种G6PD基因突变[2],但仍有众多G6PD缺乏症患者难以检出任何基因突变[3, 4, 5]。G6PD基因处于受甲基化影响较多的X染色体上,其表达可能为启动子CpG甲基化所调控,导致基因沉默、活性下降[6]。本研究组前期观察发现,G6PD缺乏症人群G6PD mRNA表达水平有下调趋势[7]。为此,本研究拟对G6PD mRNA表达降低的G6PD缺乏症样本的基因启动子甲基化改变情况进行分析,探讨甲基化改变是否在G6PD缺乏症中发挥作用,为G6PD缺乏症的分子诊断提供新的参考。
1 资料与方法 1.1 研究对象收集2013年8月至2014年7月期间,深圳市儿童医院血液专科门诊及儿保科就诊的贫血查因或体检儿童195例。根据其外周静脉血测定的四氮唑蓝G6PD/6GPD比值(改良G6PD定量比值法试剂盒,广州市米基医疗器械有限公司生产),分为G6PD缺乏组(比值<1.00)和对照组(比值≥ 1.00)。其中,缺乏组130例,男117例、女13例,年龄32 d至193个月,中位年龄26个月;对照组65例,男28例、女37例,年龄2个月至192个月,中位年龄28个月。本研究获得到医院医学伦理委员会和研究对象监护人的知情同意。
1.2 DNA、总RNA提取,cDNA获取应用QIAamp RNA Blood Mini Kit和FlexiGeneDNA Kit(QIAGEN,德国)分别提取样本总RNA和DNA。1 μg总RNA采用逆转录试剂盒(TaKaRa,大连)获取cDNA,操作如下:70 ℃10 min,冰上孵育10 min,加入Random primer1 μL、PrimeScript Buffer 4 μL、PrimeScript ReverseTranscriptase 1 μL、Ribonuclease Inhibitor 0.5 μL、dNTP Mixture 1 μL,RNase-free Water补至20 μL,42 ℃ 60 min,90 ℃ 2 min。RNA冻存于-80 ℃,DNA、cDNA冻存于-20℃备用。
1.3 引物设计根据G6PD mRNA序列(NCBI号:BC000337)和DNA序列(NCBI号:L44140.1),采用Prime Premier 5.0软件设计荧光定量PCR引物,MethPrimer软件鉴定 CpG岛并进行甲基化敏感性高分辨率熔解曲线分析(MS-HRM)及重亚硫酸盐PCR测序法(BSP)设计引物,见表 1。
|
|
表 1 Real-time PCR、MS-HRM 及BSP 分析的引物参数 |
应用SYBR Premix Ex Taq Ⅱ试剂盒(TaKaRa,大连),20 μL体系(2×Master Ex Taq Ⅱ 10 μL,上、下游引物各0.8 μL,RNase-free Water 8.2 μL,1st cDNA 0.2 μL)在LightCycler® 480 Ⅱ荧光定量PCR仪(Roche,瑞士)扩增,每份标本均进行3管平行检测(即3管检测内参β-actin基因,3管检测目的基因)。扩增参数如下:95℃30 s,45循环(95℃ 5 s,60℃ 30 s)。扩增后行熔解曲线分析,95℃5 s,60℃60 s,以0.1℃ /s速度升温到95℃,连续监测荧光。用自带软件进行相对定量分析,Ct值≤0.5的样本纳入甲基化分析。
1.5 MS-HRM及直接测序验证按EpiTect Bisulfite Kit(QIAGEN,德国)说明书对500 ng模板DNA进行重亚硫酸盐反应。采用LightCycler 480 High Resolution Melting Master(Roche,瑞士)试剂,20 μL体系(Master Mix1 μL,MgCl2 2 μL,H2O 5.8 μL,上下游引物各0.6 μL,重亚硫酸盐处理后DNA 1 μL)。扩增参数如下:预热95℃ 10 s,65循环(95℃ 10 s,58℃15 s,72℃ 20 s)。扩增后行熔解曲线分析:95℃60 s,40℃ 60 s,65℃ 1 s,以1℃ /s的速度升温到95℃,连续监测荧光,对产物进行特异性分析。通过自带软件Tm Calling或Gene scanning进行甲基化改变分析。实验中加入甲基化阴性和阳性对照DNA(TaKaRa,大连)作参照。MS-HRM筛查出的代表性标本多个,其MS-HRM产物直接送测序(英潍捷基有限公司,上海)验证。
1.6 BSP克隆测序再验证选取经MS-HRM及DNA直接测序验证为甲基化和非甲基化的样本各1个,采用BSP测序引物对其PCR扩增,扩增产物行TA克隆(均参照相关试剂盒操作程序或分子克隆相关程序进行);阳性重组质粒进行测序及数据分析(每种重组质粒至少挑取6个克隆进行测序分析)。
1.7 统计学分析采用SPSS 17.0软件统计分析。计量资料以均数±标准差(x±s)表示,计数资料采用χ2检验进行组间比较。P<0.05为差异有统计学意义。
2 结果 2.1 mRNA表达水平测定对130例G6PD缺乏组的cDNA样本进行Real-time PCR分析,其结果为0.81±0.24(G6PD/β-actin),其中22个样本(男性16例,女性6例)标化后的荧光定量比值(G6PD/β-actin)≤ 0.5,纳入甲基化分析,占比16.9%(22/130)。
2.2 MS-HRM分析及BSP直接测序验证MS-HRM筛查出的代表性标本直接测序与MS-HRM分析结果一致,显示22例G6PD mRNA表达降低的样本中16例男性样本均无甲基化,6例女性样本均存在甲基化(见图 1~2)。由于6例女性样本均存在甲基化,继续分析了G6PD mRNA表达正常的缺乏组和对照组女性样本共44例(7vs 37),检出缺乏组6例、对照组34例女性存在甲基化;由于病例有限,G6PD缺乏组与对照组的女性,非甲基化比例差异无统计学意义(1/7 vs3/37),P>0.05。

|
图 1 G6PD 基因启动子区的MS-HRM 分析图 采用Tm Calling 分析模式,显示:男性样本与阴性对照属于同一种峰形,女性样本的甲基化曲线介于阴性和阳性对照之间,提示为部分甲基化。 |
|
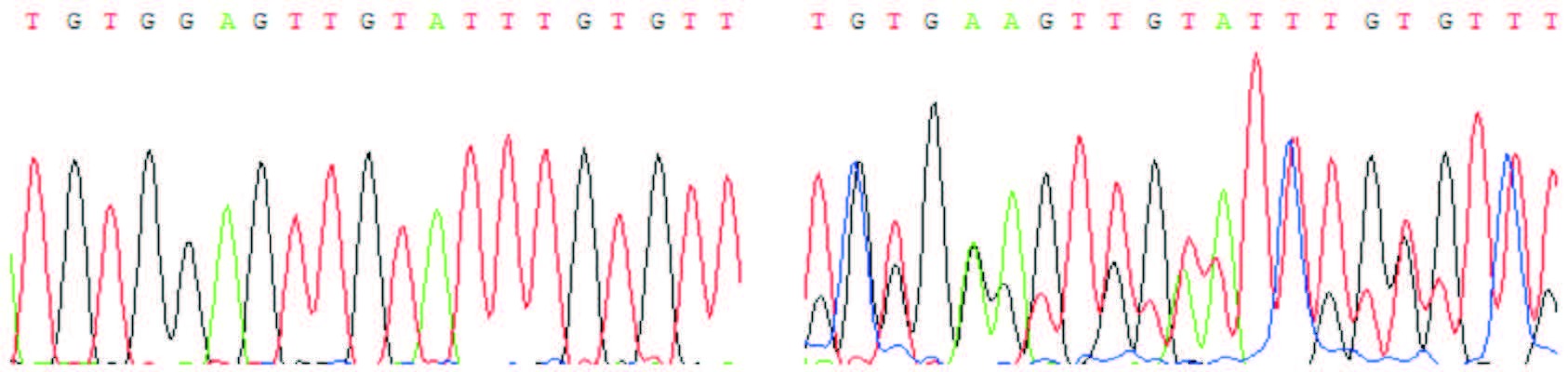
图 2 MS-HRM 产物直接测序图 左图:非甲基化样本;右图:部分甲基化样本。箭头所示为甲基化位点(部分型)。 |
取上述方法检测的非甲基化样本和甲基化样本(均为G6PD缺乏组女性)各1例行TA克隆测序再验证,结果显示非甲基化样本的6个克隆均为非甲基化,而甲基化样本的6个克隆中3个为非甲基化、3个为全甲基化,代表性结果见图 3。

|
图 3 BSP 克隆测序图 左图:非甲基化DNA;右图:甲基化DNA(均为反向测序)。箭头所示为对应的非甲基 |
G6PD缺乏症是最常见的X连锁不完全显性遗传性红细胞酶缺陷病,主要为G6PD基因编码区单个碱基突变导致酶活性改变,目前仍有众多G6PD缺乏症患者难以检出任何基因突变[3, 4, 5]。基于G6PD基因处于受甲基化影响较多的X染色体上,而DNA甲基化主要通过启动子区CpG岛胞嘧啶甲基化来抑制转录,从而影响mRNA的表达及翻译,导致蛋白功能活性的改变。本研究发现22例G6PD mRNA表达降低的样本中,男性的G6PD基因均为非甲基化状态,女性则均为部分甲基化。这与男性仅一条X染色体,而女性两条X染色体可能存在随机失活现象基本一致,即“莱昂假说”:哺乳动物为保证两性之间转录水平平等,通过雌性个体随机失活一条X染色体,并在随后的细胞增殖和分化过程中得以维持和传递。X染色体失活维持则主要依靠启动子区甲基化[8]。据此,本研究组推测G6PD基因启动子的甲基化与男性患儿无关,但与女性患儿的关系不知是否仅与X染色体失活相关。因此,我们对G6PD mRNA表达正常的缺乏组以及对照组的女性进行了G6PD基因启动子甲基化分析,发现大部分存在部分甲基化(40/44),小部分(4/44)为非甲基化状态;由于病例有限,G6PD缺乏组与对照组的非甲基化比例差异无显著性,无法评估两个等位基因均非甲基化在G6PD缺乏中的独特意义。而本研究发现,女性两个等位G6PD基因均无甲基化现象即均不失活,与“莱昂假说”相矛盾。为此进一步查阅相关文献,有研究报道某些基因存在X染色体失活逃逸,即女性X染色体上某些基因逃脱X染色体而失活,在失活和有活性的X染色体均有表达[9]。另有多项研究显示失活基因在男性未甲基化,在女性则为部分甲基化,这反映出女性失活X染色体上启动子CpG处于甲基化,未失活X染色体上启动子CpG处于非甲基化,而失活逃逸基因则在失活与未失活X染色体上均非甲基化[10, 11]。一项基于第二代测序技术的RNA测序研究分析了欧洲和西非约鲁巴正常人群的B淋巴细胞系,发现G6PD基因存在X染色体失活逃逸现象[12],这是目前报道G6PD基因存在X染色体失活逃逸现象的唯一文献。据此,我们推测本次研究发现的女性样本非甲基化状态很可能与X染色体失活逃逸有关。由于女性G6PD基因存在X染色体失活与失活逃逸,而甲基化改变是其主要分子机制,因此可以说甲基化改变对女性G6PD缺乏症可能有一定的影响。
另外,值得一提的是,本研究采用的MSHRM技术是基于HRM分析的新技术,具有高通量、快速、低成本、可同时检测甲基化的优势[13, 14, 15]。HRM技术是一种近年来兴起的用于突变扫描、甲基化分析、基因型分型的最新遗传学分析方法,根据DNA序列的长度,GC含量及碱基互补性差异,应用HRM对样品进行分析,其极高的温度均一性和温度分辨率可以区分单个碱基的差异。重亚硫酸盐处理后的DNA样本其甲基化和未甲基化PCR产物存在C和T碱基的差异,从而可利用HRM原理进行是否甲基化识别。有研究报道HRM方法检测MGMT启动子区域内的甲基化状态,可检测到低达0.1%的甲基化程度,与焦磷酸测序结果基本一致并且可以根据已经甲基化程度的标准曲线对未知样品的甲基化百分比进行测定[13]。另外,结合MS-HRM产物直接测序则可对相关标本进行快速验证。本次研究的MS-HRM筛查分析结果高效地将甲基化与非甲基化区分开来,为该方法提供了佐证,其产物直接测序以及BSP克隆测序也证实了该方法的有效性。本研究组认为该方法在单基因甲基化检测中具有较大应用价值,值得进一步推广应用。
| [1] | Cappellini MD, Fiorelli G . Glucose-6-phosphate dehydrogenase deficiency[J]. Lancet, 2008, 371(9606): 64-74. |
| [2] | Minucci A, Moradkhani K, Hwang MJ, et al. Glucose-6-phosphate dehydrogenase(G6PD) mutations database: review of the "old" and update of the new mutations[J]. Blood Cells Mol Dis, 2012, 48(3): 154-165. |
| [3] | 潘美晨, 蔡应木. G6PD 缺乏症基因型检测新方法的建立及分子流行特征分析[J]. 分子诊断与治疗杂志, 2012, 4(4): 222-226. |
| [4] | Jiang W, Yu G, Liu P, et al. Structure and function of glucose-6-phosphate dehydrogenase-deficient variants in Chinese population[J]. Hum Genet, 2006, 119(5): 463-478. |
| [5] | Yan JB, Xu HP, Xiong C, et al. Rapid and reliable detection of glucose-6-phosphate dehydrogenase (G6PD) gene mutations in Han Chinese using high-resolution melting analysis[J]. J Mol Diagn, 2010, 12(3): 305-311. |
| [6] | Portela A, Esteller M. Epigenetic modifications and human disease[J]. Nat Biotechnol, 2010, 20(8): 1057-1068. |
| [7] | 李长钢, 陈小文, 陈运生, 等. 葡萄糖-6-磷酸脱氢酶缺乏症患儿G6PD mRNA 表达的研究[J]. 中国当代儿科杂志, 2006, 8(5): 385-387. |
| [8] | Gendrel AV, Heard E. Fifty years of X-inactivation research[J]. Development, 2011, 138(23): 5049-5055. |
| [9] | Carrel L, Willard HF. X-inactivation profile reveals extensive variability in X-linked gene expression in females[J]. Nature, 2005, 434(7031): 400-404. |
| [10] | Cotton AM, Lam L, Affleck JG, et al. Chromosome-wide DNA methylation analysis predicts human tissue-specific X inactivation[J]. Hum Genet, 2011, 130(2): 187-201. |
| [11] | Cotton AM, Avila L, Penaherrera MS, et al. Inactive X chromosome-specific reduction in placental DNA methylation[J]. Hum Mol Genet, 2009, 18(19): 3544-3552. |
| [12] | Zhang Y, Castillo-Morales A, Jiang M, et al. Genes that escape X-inactivation in humans have high intraspecific variability in expression, are associated with mental impairment but are not slow evolving[J]. Mol Biol Evol, 2013, 30(12): 2588-2601. |
| [13] | Wojdacz TK, Dobrovic A. Methylation-sensitive high resolution melting (MS-HRM): a new approach for sensitive and highthroughput assessment of methylation[J]. Nucleic Acids Res, 2007, 35(6): e41. |
| [14] | Mastoraki S, Chimonidou M, Dimitrakopoulos L, et al. A rapid and accurate closed-tube Methylation-Sensitive High Resolution MeltingAnalysis assay for the semi-quantitative determination of SOX17 promoter methylation in clinical samples[J]. Clin Chim Acta, 2015, 444: 303-309. |
| [15] | Candiloro IL, Mikeska T, Dobrovic A. Assessing combined methylat ion-sensit ive high resolu t ion me l ting and pyrosequencing for the analysis of heterogeneous DNA methylation[J]. Epigenetics, 2011, 6(4): 500-507. |
 2016, Vol. 18
2016, Vol. 18



