2. 苏州大学附属儿童医院儿科研究所, 江苏 苏州 215123
新生儿高胆红素血症是新生儿最常见的疾病,发病率近年有上升趋势,大约60%的足月儿和80%的早产儿在生后一周可出现黄疸,母乳喂养的婴儿在生后一个月时仍然可能存在黄疸[1]。而造成高胆红素血症的原因中新生儿血型不合溶血病(hemolytic disease of the newborn,HDN)占28%~30%[2]。新生儿血型不合溶血病主要因母婴血型不合引起,包括ABO血型和 Rh血型以及其他血型不合[3]。溶血可发生在胎儿期和新生儿早期,严重者可引起胎儿死亡,发生血型不合者出生后黄疸迅速加深[4]。因胆红素对神经系统具有毒性作用[5],可引起不同程度的脑损伤,严重者可引起胆红素性脑病,造成死亡或伤残,给家庭和社会造成极大的痛苦和经济负担。
为更加深入地研究HDN的病理生理改变以及治疗策略,制作相关疾病模型模拟病理生理过程是一种有效的方法。但目前广泛应用于黄疸研究的大多是体外细胞模型[6],动物模型多是采用注射四氯化碳、酒精、对乙酰氨基酚等造成肝细胞坏死形成黄疸[7, 8, 9, 10, 11],或者结扎/堵塞胆总管制成梗阻性黄疸模型[12],更有甚者直接采用胆红素静脉注射来进行研究[13]。大部分都是围绕肝细胞性或者梗阻性黄疸来进行,并且都是针对成年人的疾病模型。这些模型和方法均不能够体现HDN和新生儿黄疸的真正病理生理特点。
有鉴于此,我们通过制备和注射兔抗猪红细胞血清引发新生猪溶血、高胆红素血症。经检索Elsevier Science Direct、Ovid、中国知网、万方数据等数据库,证实这是国内外首次采用免疫学方法制备新生猪溶血性黄疸模型、模拟溶血性黄疸的病理生理过程,为更进一步研究HDN提供良好的生物物质基础。
1 材料与方法 1.1 实验动物7日龄纯种大约克白猪12只,雌雄不限,体重2 600~3 760 g,由苏州市太仓国家级种猪场提供(YY-TCZZC-14),随机分成实验组和对照组,每组6只。成年新西兰大白兔,体重2 650 g,由苏州大学动物中心提供,用于制备抗血清。
1.2 实验设备及试剂台式低温高速离心机(Labofuge 400R,德国Heraeus公司),TGL-16B台式离心机(上海安亭科学仪器厂),超低温冰箱(-60℃日本SANYO公司),移液器(Eppendorf公司)。ACD全血保存液,由苏州市中心血站提供。
1.3 实验方法新生猪红细胞抗原制备:通过股静脉采取15 mL猪全血置于ACD全血保存液中,4℃冰箱保存。免疫前取适量抗凝血于离心管中,200转/min离心10 min,弃去上清,加入约8倍的无菌生理盐水悬起红细胞,2 000转/min离心10 min,吸去上清液。连续洗涤3次后制成终浓度为2%~5%的红细胞悬液,检查无溶血现象后即可用于免疫。
兔抗猪红细胞血清的制备:通过兔耳缘静脉注射制备的猪红细胞悬液,第1天0.5 mL,以后逐日递增0.5 mL,第5天达2.5 mL,共5次。第13天从兔的耳静脉或心脏采血,分离血清,作免疫溶血试验,滴定抗血清,效价达到1 : 16以上为合格。达到要求后在无菌条件下从心脏采集全部血液,4 000转/min离心20 min,分离血清。将抗血清小量分装,-60℃冻存。
新生猪溶血病模型的制备和验证:实验组新生猪静脉注射制备的兔抗猪红细胞血清5 mL,观察皮肤颜色变化,并每6 h采静脉血送检血常规及肝功能,以验证体内红细胞及胆红素的变化。对照组予以静脉注射5 mL生理盐水,常规喂养,与实验组在相同时间点采血送检血常规及肝功能。
1.4 统计学分析采用SAS 9.3统计软件进行分析处理。所有数据用均数±标准差(x±s)表示,组间比较采用t检验。P<0.05为差异有统计学意义。
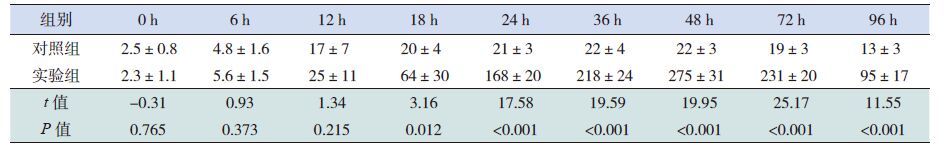
2 结果实验组在注射兔抗猪红细胞血清约8 h后出现肉眼可见黄疸、尿色变黄,18 h起血清胆红素水平高于对照组(64±30 μmol/L vs 20±4 μmol/L),差异有统计学意义(P<0.05);48 h达到高峰(275±31 μmol/L),72 h胆红素逐渐下降(231±20 μmol/ L),96 h明显降低(95±17 μmol/ L),均高于对照组(P<0.05)。整个过程中对照组未出现肉眼黄疸。见表 1
|
|
表 1 各组不同时间点胆红素水平 |
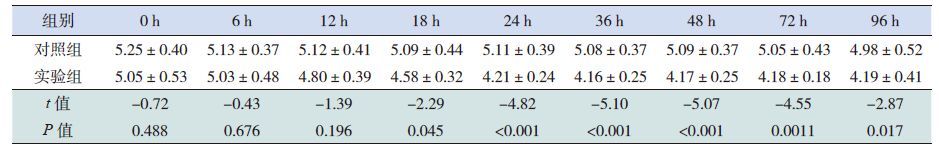
注射抗血清后18 h实验组红细胞降至(4.6±0.3)×1012/L,低于对照组[(5.1±0.4)×1012/L],差异有统计学意义(P<0.05);但两组间血红蛋白差异无统计学意义(93±3 g vs99±6 g),P>0.05。24 h实验组RBC [(4.21±0.24)×1012/L]和HB(87±3 g)进一步降低,低于对照组[(5.1±0.4)×1012/L,97±6 g] ,P<0.05;二组间的红细胞、血红蛋白差异在36~48 h达高峰。见表 2~3。
|
|
表 2 各组不同时间点红细胞水平(n=6,x±s,×1012/L) |
|
|
表 3 各组不同时间点血红蛋白水平(n=6,x±s,g/L) |
新生儿溶血病是由于母子血型不合所致。ABO-HDN常发生在第一胎的新生儿,Rh-HDN多发生在第二胎或第二胎以后的新生儿。孕妇与胎儿依靠胎盘之间绒毛膜的合体细胞层分隔,当分隔层有小的渗漏时,胎儿红细胞就会由胎盘直接进入并刺激母体,产生相应的血型抗体。该抗体再由胎盘进入到胎儿体中,从而引起胎儿或新生儿体内出现特异性抗原抗体反应,使红细胞致敏,在单核-吞噬细胞系统内破坏而溶血[14, 15]。
在自然界中,猪、羊、牛等偶蹄类哺乳动物也会发生溶血病[16]。根据文献,7日龄猪处于新生期[17],体重约2.5~4 kg,与人类足月新生儿接近;且新生猪来源易得,品系稳定,故选用7日龄新生猪作为模型的制作载体。根据HDN的发病机制,我们采用免疫学方法,通过给成年新西兰大白兔注射提纯的猪红细胞刺激兔的免疫系统,产生兔抗猪红细胞抗体。分离出含大量兔抗猪红细胞抗体的血清,注射至新生猪体内,引发抗原抗体反应,造成新生猪溶血和黄疸。为尽量减少种属差异,我们在分离猪红细胞时严格进行洗涤,制备出抗血清后也尽可能分离纯化。根据前期预实验结果,发现5 mL兔抗猪红细胞血清即可引起明显的溶血反应,但又不至于因溶血过重死亡。
结果显示,注射抗血清后,新生猪8 h开始出现肉眼黄疸,48 h黄疸达高峰;由于猪的胆红素处理能力比较强大[18],体内胆红素水平在72 h即开始降低,至96 h已降至高峰值的约1/3。故我们建议,应用本模型进行研究时以注射抗血清后48 h作为窗口期为宜。随着溶血的发生,实验组新生猪的红细胞以及血红蛋白在18 h就有降低,36~48 h降低最为明显。本实验结果提示,新生猪静脉注射兔抗猪红细胞血清后发生了黄疸和贫血,与人类HDN的病理过程相似,符合新生儿溶血病的特点,是一个稳定可靠的HDN动物模型。
目前临床上对于新生儿溶血病的治疗主要采取光照疗法、静脉注射丙种球蛋白以及换血治疗等。光疗需通过胆红素的光异构作用才能将胆红素从胆汁和尿液排出,起效慢,对于重症黄疸疗效不佳,还可能出现青铜症、DNA损伤等副作用;免疫球蛋白只能结合血中游离抗体,对于已致敏的红细胞无效,且不能直接降低血清中胆红素水平;而换血治疗操作复杂,受血源供给限制,还可出现感染、心力衰竭、心跳骤停、坏死性小肠结肠炎及肠穿孔等并发症[19]。近来有报道采用血液灌流等手段治疗新生儿溶血病,但是也存在灌流后血小板减少、血清Ca2+降低等副作用[20]。因此,仍需探寻新生儿溶血病得更好的治疗方法,而本模型较好地模拟了溶血性黄疸的病理生理过程,为更进一步研究HDN及探索新的治疗手段提供了良好的生物物质基础。
| [1] | Rennie J, Burman-Roy S, Murpy S. Neonatal jaundice: summary of NICE guidance[J]. BMJ, 2010, 340: c2409. |
| [2] | 吴仕孝. 新生儿溶血病的研究进展[J]. 中国实用儿科杂志, 1999, 14(2): 72-74. |
| [3] | Altuntas N, Yenicesu I, Himmetoglu O, et al. The risk assessment study for hemolytic disease of the fetus and newborn in a university hospital in Turkey[J]. Transfus Apher Sci, 2013, 48(3): 377-380. |
| [4] | Markham KB, Rossi KQ, Nagaraja HN, et al. Hemolytic disease of the fetus and newborn due to multiple maternal antibodies[J]. Am J Obstet Gynecol, 2015, 213(1): 68.e1. |
| [5] | 裴进升, 张华. 胆红素神经毒性机制及早期监测的研究进展[J]. 华夏医学, 2011, 24(5): 619-622. |
| [6] | 陈敏, 陈昌辉, 刘会领, 等. 胆红素对新生儿脐血单核细胞 NF-κB 表达的影响[J]. 中华临床医师杂志(电子版), 2012, 6(3): 635-638. |
| [7] | Sabreen S, Khan MR, Khan RA. Hepatoprotective effects of methanol extract of Carissa opaca leaves on CCl4-induced damage in rat[J]. BMC Complement Altern Med, 2011, 11: 48. |
| [8] | 朱强, 王科, 钱晓锋, 等. 改良小鼠酒精性肝损伤模型的建立[J]. 中华临床医师杂志(电子版), 2010, 4(9): 1532-1536. |
| [9] | van Swelm RPL, Laarakkers CM, van der Kuur EC,et a1. Identification of novel translational urinary biomarkers for acetaminophen induced acute liver injury using proteomic profiling in mice[J]. PLoS One,2012,7(11):e49524. |
| [10] | Luyendyk JP, Flanagan KC, Wtliams CD, et al. Tissue factor contributes to neutrophil CD11b expression in alphanaphthylisothiocyanate-treated mice[J]. Toxicol Appl Pharmol, 2011, 250(3): 256-262. |
| [11] | 欧巧群, 钱新华, 黄笑群, 等. ANIT 诱导大鼠亚急性肝内胆汁淤积的生化和病理变化[J]. 胃肠病学和肝病学杂志, 2015, 24(4): 463-465. |
| [12] | 张春兴, 王芳, 廖彩仙, 等. 梗阻型黄疸小鼠模型构建及相关指标观察[J]. 大连医科大学学报, 2014, 36(1): 23-26. |
| [13] | Sun XM, Kang P, Tao K. Causes of immune dysfunction in hyperbilirubinemia model rats[J]. Asian Pac J Trop Med, 2015, 8(5): 382-385. |
| [14] | 詹影影. ABO 血型系统诊断新生儿溶血病的实验研究[J]. 中国卫生检验杂志, 2010, 20(6): 1421-1422. |
| [15] | 陈玫, 毕晓琳, 叶萍, 等. 孕妇血清中抗-A(B)IgG 亚类与新生儿溶血病关系的研究[J]. 中国输血杂志, 2005, 18(6): 484-486. |
| [16] | 包亚双, 吴树林, 张红艳, 等. 关于新生仔猪溶血症防治探讨[J]. 畜禽业, 2013, 5: 84. |
| [17] | 金龙, 蒋智, 夏渝东, 等. 猪不同年龄段骨骼肌的甲基化组比较分析[C]. 四川省畜牧兽医学会2014学术年会论文集. 成都: 四川省畜牧兽医学会, 2014: 33-43. |
| [18] | 张世昌, 王英杰, 陈志, 等. 乳猪肝细胞的生物学特性观察[J]. 第三军医大学学报, 2007, 29(24): 2307-2310. |
| [19] | 朴梅花, 王庆红. 新生儿黄疸的治疗[M]// 邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学. 第4版. 北京: 人民卫生出版社, 2011: 300-306. |
| [20] | 李波. 血液灌流治疗新生儿重症高胆红素血症19例疗效及安全性观察[J]. 实用医院临床杂志, 2011, 8(5): 145-147. |
 2016, Vol. 18
2016, Vol. 18