流行病学资料显示我国有近600万癫癎患者,每年新发癫癎人数有65~70万,儿童患病率在1%~2%[1]。目前,癫癎的治疗仍以抗癫癎药物为主,20%~30%的癫癎患者即便经过正规、合理的药物治疗仍控制不佳,最终发展为难治性癫癎(refractoryepilepsy,RE)。RE患者致残率和病死率均很高,给患儿家庭造成极大的经济和心理负担。因此,寻找新的有效治疗靶点已经成为RE治疗领域新的研究热点。已有动物实验研究表明[2],癫癎发作会启动炎性信号通路,导致神经元及胶质细胞上促炎性细胞因子表达增加,如前列腺素及环氧化酶-2(cyclooxygenase-2,COX-2)系统、Toll样受体家族、单核细胞趋化蛋白促炎性因子等,这些炎性因子表达的增加可造成神经元损伤。另外,COX-2与多药耐药转运体(multi-resistant transporters,MRTs)介导的多药耐药有一定的相关性[3]。MRTs是外排性转运体,其依赖 ATP分解释放的能量,将底物逆向泵出细胞,降低底物在细胞内的浓度,包括 P-糖蛋白(P-glycoprotein,P-gp)、多药耐药相关蛋白(multidrug resistance associated protein,MRP)、主穹窿蛋白(major vault protein,MVP)等。国外有研究发现[4]慢性癫癎大鼠MVP的表达可能导致癫癎耐药的发生,MVP作为一种MRTs,在癫癎耐药中的作用已经越来越受到人们的关注。有研究指出多药耐药的机制至少有一部分是通过COX-2/蛋白激酶/P-gp途径介导的[5]。关于MVP介导的耐药机制是否存在COX-2/蛋白激酶/MVP的通路仍不明确。本研究采用免疫组织化学法和免疫印迹杂交法探讨COX-2选择性抑制剂塞来昔布对氯化锂-匹鲁卡品诱发Sprague-Dawley大鼠癫癎持续状态后大鼠海马和皮质中的MVP的表达的影响,并对其可能的机制进行讨论。
1 材料与方法 1.1 动物及分组5~7周Sprague-Dawley雄性健康成年大鼠60只,体重180~230 g,购于西安交通大学医学院实验动物中心(生产批号:20111116),饲养于西安交通大学医学院SPF级动物实验室。将实验动物按照随机数字表法随机分为空白对照组(n=16)、癫癎模型组(n=22)和塞来昔布干预组(n=22)。
1.2 模型建立及处理癫癎持续状态模型建立过程参照李丹等[6]的实验方法:先将氯化锂(购于生物工程上海公司)0.15 mg/kg腹腔注射,14~17 h后按1 mg/kg腹腔注射硫酸阿托品(购于无锡市第七制药有限公司),30 min后大鼠腹腔注射匹鲁卡品(购于美国Sigma公司)10 mg/kg,若注射40 min后仍无癫癎发作,可重复给一次匹鲁卡品(按10 mg/kg),癫癎发作持续90 min后腹腔注射0.22 mmol/L水合氯醛300 mg/kg(西安交通大学第二附属医院药剂科提供)终止发作;空白对照组的各项处理均以生理盐水替代。实验动物癫癎发作分级参照Racine[7]分级标准:0级:正常(无抽搐发作);Ⅰ级:呆立不动或湿狗样抖动,伴随面部痉挛抽动、眨眼、动须、咀嚼等面部自动症;Ⅱ级:节律性点头、咀嚼;Ⅲ级:单侧前肢痉挛;Ⅳ级:全身性强直-阵挛抽搐,伴站立和跌倒、后退;Ⅴ级:持续站立和倾倒,失平衡,伴全身强直-阵挛,甚至抽搐致死。大鼠诱发出Ⅳ级以上认为造模成功。造模成功后,各组取16只大鼠纳入实验。
造模成功后,每组均喂食米粉直到大鼠可以自己进食普通饲料,每日给每只大鼠5 mL生理盐水2次。塞来昔布干预组采用灌胃法连续3 d给予塞来昔布(20 mg/kg),空白对照组和癫癎模型组则给予等体积的生理盐水替代。
1.3 免疫组织化学法检测MVP表达成功诱发癫癎持续状态3 d后,各组随机取8只大鼠,用605 mmol/L水合氯醛(3 mL/kg)腹腔注射麻醉后,将注射针头插入左心室,迅速剪开右心耳灌注100~200 mL生理盐水,再注入300~400 mL的4%多聚甲醛固定液后断头取脑并固定,常规脱水、透明、浸蜡、包埋、连续切片(厚度约5 μm)。免疫组织化学染色法检测MVP(一抗选用美国Santa Cruze公司生产)。
结果的判断即阳性标记强度特征,依照阳性细胞着色程度(抗原含量),可分为弱阳性(+)标记1分;中等阳性(2+)标记2分;强阳性(3+)标记3分,3个等级所对应的免疫酶标记表现为淡黄色细颗粒、棕黄色颗粒和褐黄色粗颗粒。依照阳性细胞数量可分为:弱阳性(+,指阳性细胞总数在25%以下);中等阳性(2+,指阳性细胞总数在25%~49%);强阳性(3+,指阳性细胞总数在50%以上)。采用积分综合计量,计算公式:(+)%×1+(2+)%×2+(3+)%×3;总数值<1.0者为(+),1.01~1.5者为(2+),>1.5者为(3+)。每个标本随机取3张切片,每张切片随机观察5~10个高倍镜视野。
1.4 Western-blot法检测表达各组另选取剩余的8只大鼠,用605 mmol/L水合氯醛(3 mL/kg)腹腔注射麻醉成功后,立即断头取脑,分别留取海马和额叶皮质,提取蛋白质并使其变性后用于蛋白上样。使用Western-blot法检测MVP,经过制胶、灌胶、上样、电泳、切胶、转膜(采用半干转)、凝胶染色、封闭、抗体孵育、发光等步骤后,将晾干的X-光片用扫描仪转换成图像文件,黑白条带的亮暗与大小显示目的蛋白表达量的高低,使用美国国立卫生院推出的分子生物分析软件Image J的图像处理功能计算出每个条带的灰度值,计算样本目的条带与内参照β-actin的光密度比值进行比较分析。
1.5 统计学分析应用SPSS 13.0统计软件对数据进行统计学分析,计量资料采用均数±标准差(x±s)表示,各组间比较采用完全随机设计的单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果 2.1 造模后各组大鼠基本情况腹腔注射匹鲁卡品15~39 min后大鼠先后出现生物行为的改变:首先出现竖毛、流涎、流血泪、点头、探索样行为、目光呆滞、腹泻等,继而出现面肌痉挛,咀嚼样运动,点头,单、双侧肢体痉挛,最后身体向后摔倒。空白对照组16只大鼠均无癫癎发作,建模结束后全部存活进入实验;癫癎模型组中有19只出现癫癎持续状态发作,其中3只在腹腔注射10%水合氯醛后5~15 min死亡,余16只纳入实验;塞来昔布干预组中18只出现癫癎持续状态发作,其中1只在抽搐发作28 min时死亡,1只在水合氯醛终止发作后4 min死亡,余下16只大鼠纳入下一步实验。
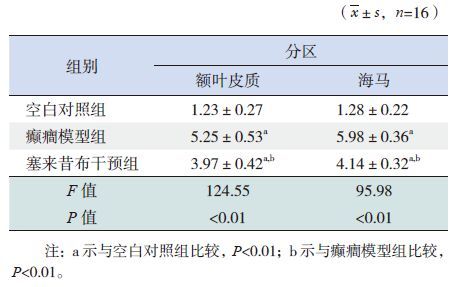
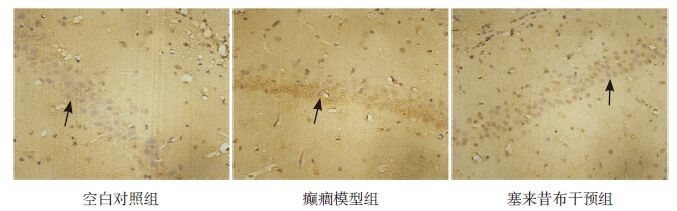
2.2 大鼠脑组织MVP蛋白表达的免疫组织化学结果分析在癫癎模型组和塞来昔布干预组大鼠脑组织切片中均可看到额叶皮质和海马 CA1区中MVP免疫染色阳性细胞,主要位于神经胶质细胞,在一些毛细血管内皮细胞以及血管周围的星型胶质细胞中也有表达(图 1~2)。癫癎模型组额叶皮质区和海马区MVP的免疫阳性细胞强度高于塞来昔布干预组和空白对照组,且塞来昔布干预组MVP的免疫阳性细胞强度高于空白对照组(P<0.01)(表 1)。

|
图 1 各组大鼠额叶皮质中MVP 阳性细胞的表达情况(免疫组化,×400) 在大鼠的额叶皮质层,癫癎模型组MVP 表达明显高于空白对照组和塞来昔布干预组,塞来昔布干预组MVP 表达高于空白对照组。MVP 阳性细胞呈黄褐色(箭头所示)。 |
|
图 2 各组大鼠海马中MVP 阳性细胞的表达情况(免疫组化,×400) 癫癎模型组MVP 表达在大鼠的海马区域明显高于空白对照组和塞来昔布干预组,塞来昔布干预组MVP 表达高于空白对照组。MVP 阳性细胞呈黄褐色(箭头所示)。 |
|
|
表 1 各组大鼠脑组织中MVP 阳性细胞表达情况比较 |
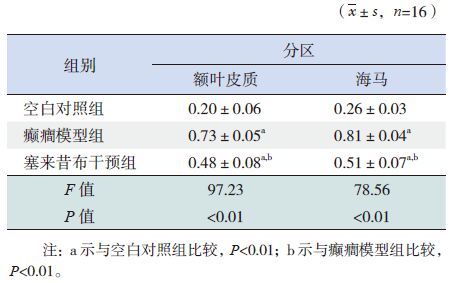
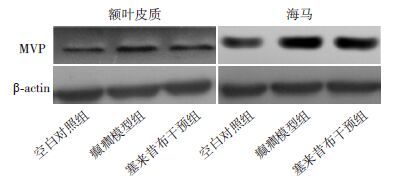
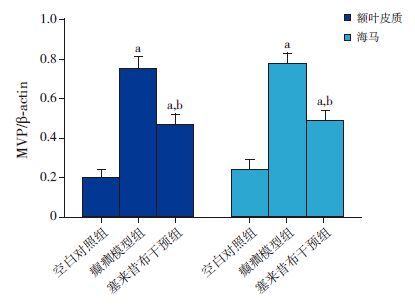
结果分析与免疫组织化学结果相呼应,癫癎模型组额叶皮质区和海马区的MVP/β-actin灰度比值明显高于空白对照组及塞来昔布干预组,且塞来昔布干预组MVP/β-actin灰度比值高于空白对照组(P<0.01),见图 3~4,表 2。
|
图 3 Western blot 法检测各组大鼠额叶皮质及海马中MVP 表达水平电泳图 |
|
图 4 Western blot 法检测各组大鼠额叶皮质区及海马中MVP 蛋白表达量 a 示与空白对照组比较,P<0.01;b 示与癫癎模型组比较,P<0.01。 |
|
|
表 2 各组大鼠脑组织中MVP 表达水平比较 |
目前关于MRTs的研究报道主要有ABC家族P-gp,另一种与耐药关系密切的MRTs是MVP,亦称肺耐药相关蛋白[8]。国内外均有研究发现,MVP在局灶性癫癎患者的脑组织切片中表达升高,MVP可能参与RE的多药耐药[8, 9]。MVP是由Kedersha等[10]在1986年首次从大鼠肝组织标本中发现的一种胞浆蛋白颗粒,与P-gp和MRP1同属膜转运蛋白超家族成员。MVP分子量约为110 kD,存在于人类的肺、肝、肠、骨骼肌、脑组织等,在人类多种肿瘤细胞系中(包括实体瘤、血液系统肿瘤)也均有表达,其95%存在于胞浆中,余5%位于细胞核的核膜及核孔,且在肿瘤的化疗中参与诱导多药耐药[11]。其耐药机制与其特殊的结构有关,由MVP、次穹隆蛋白、端粒末端转移酶相关蛋白所组成弯隆体具有核-质转运的作用,每两个完全对称的穹窿壳可组成穹窿蛋白复合物,呈独特的中空桶状结构,可以将以胞核为靶点的药物泵出细胞核;也可以将胞质内的药物通过胞吐排出细胞外,从而降低药物在细胞内的浓度而造成多药耐药。国内研究发现RE患者脑组织中神经元的核内及细胞质中MVP表达明显升高,而在胶质细胞中未有变化,故推论MVP可能参与了RE的多药耐药现象[12]。
有研究提出脑内炎性反应所致的脑组织损伤及包括COX-2在内的多种炎性相关因子的表达上调可能参与RE的病理生理过程[13]。2010年Auvin等[14]发现脂多糖(可引起大脑的炎性反应)能够加重出生14 d大鼠的氯化锂-匹鲁卡品大鼠癫癎持续状态模型的发作程度。由于反复癫癎发作所造成的中枢神经系统损伤及自身免疫性疾病、感染等可导致大脑神经元的激活,在所谓的癫癎发作易感区域这些激活的神经元细胞过度释放炎症介质导致神经炎性反应,从而诱发一连串的下游病理生理效应,可能伴随癫癎发作同时发生的炎性反应过程也参与神经系统损害,最终结果会降低癫癎发作的阈值,造成病态的恶性循环,导致反复癫癎发作。持续的癎性发作可造成脑内炎症反应,炎症反应过程中产生的大量炎性介质(TNF-α、IL-1β、COX-2、INF-γ等)促进谷氨酸激活,在激活的神经元中谷氨酸可通过细胞膜中NMDA受体的信号传导使细胞功能发生变化,进而上调P-gp在脑组织中的表达,在一定程度上限制了脑组织对抗癫癎药物的摄取吸收,降低了脑内药物浓度,影响药物到达作用靶点从而造成耐药[15]。MVP与P-gp均为多药耐药蛋白家族,因此,本研究假设,癫癎发作产生的炎性反应可能也上调了MVP的表达,参与了多药耐药的产生。
不同数据显示癫癎的发病机制包括特定炎性通路的参与,COX可催化生成促炎因子前列腺素,其可能在癫癎诱发的神经炎性反应及神经元过度兴奋中扮演重要角色。COX-2在癫癎发作时及发作后在颅内的表达水平升高,COX-2抑制剂可能降低颅内损伤所导致的炎性反应。Citraro等[16]研究发现,COX-2、前列腺素等所致的神经炎性反应可能参与了癫癎的失神发作过程,长期使用非甾体类抗炎药选择性COX-2抑制剂依托昔布治疗失神癫癎大鼠模型可以减少或控制其失神发作。新的研究发现抑制一些特定炎性分子的药物成为改善癫癎耐药及控制癫癎发作的目标,这些药物通过干扰疾病的发展机制,可能改善疾病的治疗[17]。
本课题组既往通过免疫组织化学研究发现,空白对照组大鼠海马区有少量血管内皮细胞及胶质细胞中有MVP的表达,而癫癎持续状态后大鼠海马中MVP在上述细胞中的表达水平均明显上调。本实验通过免疫组织化学和免疫蛋白印迹方法同时检测到癫癎持续状态大鼠和COX-2选择性抑制剂干预后的癫癎持续状态大鼠大脑皮质与海马中MVP的表达情况,结果发现癫癎持续状态大鼠脑内MVP表达明显增加,添加COX-2抑制剂干预后MVP的表达有所下降。既往有研究提出COX-2抑制剂在一定程度上降低了P-gp的表达,增加了脑组织神经元细胞内抗癫癎药物浓度,从而改善RE的多药耐药现象。本课题在此基础上,提出COX-2抑制剂改善RE的作用可能与其抑制了多药耐药相关蛋白MVP的表达有关的假设。通过对COX-2选择性抑制剂塞来昔布干预的癫癎持续状态大鼠脑组织中MVP的检测发现,大鼠额叶皮质区及海马中MVP的表达水平均较干预前显著降低。因此我们有理由认为癫癎反复发作产生的炎性反应,启动了体内COX-2炎性反应信号通路,最终激活核转录因子转录MVP,最终导致MVP的表达增加。传统的COX-2抑制剂如非甾体类抗炎药有较严重的胃肠道副作用,另外一种选择性COX-2抑制罗非昔布等虽然胃肠道副作用较小,但临床证实心血管事件的发生率较高,而塞来昔布与罗非昔布相比较在胃肠道副作用及临床疗效方面相同,但流行病学资料显示其并不增加心血管事件的风险[18]。塞来昔布是一种高选择性COX-2抑制剂,属于非甾体类抗炎药,其靶向性强,美国食品药物管理局批准用于预防家族性肠息肉病的恶性变。既往研究指出[13]发现长期服用COX-2选择性抑制剂塞来昔布的癫癎持续状态模型大鼠可以减轻海马神经元损伤,也有作者指出COX-2抑制剂具有神经元保护,减轻癫癎发作后炎性损伤作用[19],但不具备抗癫癎作用,故目前认为COX-2抑制剂可防止癫癎和脑创伤后的神经损伤,具有神经保护作用。
综上所述:本文通过两种途径来半定量检测MVP在空白对照组、癫癎模型组以及塞来昔布干预组之间的差别。用两种检测方法均发现在癫癎持续状态的大鼠脑组织中MVP表达水平明显高于空白对照组;塞来昔布可降低MVP在癫癎持续状态大鼠脑组织中的表达。两种方法结论基本一致,说明结论较为可靠,塞来昔布为选择性COX-2抑制剂,其胃肠道副作用较小,且不增加心血管事件的发生率,有望为治疗RE提供新方法。
| [1] | 张刚. 小儿难治性癫癎的外科治疗及术前评估[J]. 儿科药学杂志, 2010, 16(4): 58-60. |
| [2] | Vezzani A, Aronica E, Mazarati A, et al. Epilepsy and brain inflammation[J]. Exp Neurol, 2013, 244: 11-21. |
| [3] | Schlichtiger J, Pekcec A, Bartmann H, et al. Celecoxib treatment restores pharmacosensitivity in a rat model of pharmacoresistant epilepsy[J]. Br J Pharmacol, 2010, 160(5): 1062-1071. |
| [4] | 王海燕, 任艳霞, 杜宁. 海人酸致痫大鼠中多药耐药相关蛋白1 和主穹窿蛋白的表达及作用[J]. 黑龙江医药科学, 2011, 34(3): 1-2. |
| [5] | Sun Q, Li Y. The inhibitory effect of pseudolaric acid B on gastric cancer and multidrug resistance via Cox-2/PKC-α/P-gp pathway[J]. PLoS One, 2014, 9(9): e107830. |
| [6] | 李丹, 黄绍平, 马伟军, 等. 氯化锂-匹鲁卡品癫癎动物模型的建立[J]. 陕西医学杂志, 2006, 35(1): 15-17. |
| [7] | Racine RJ. Modification of seizure activity by electrical stimulation. II. Motor seizure[J]. Electroencephalogr Clin Neurophysiol, 1972, 32(3): 281-294. |
| [8] | Liu B, Wang T, Wang L, et al. Up-regulation of major vault protein in the frontal cortex of patients with intractable frontal lobe epilepsy[J]. J Neurol Sci, 2011, 308(1-2): 88-93. |
| [9] | Balan S, Radhab SK, Sathyan S, et al. Major vault protein (MVP) gene polymorphisms and drug resistance in mesial temporal lobe epilepsy with hippocampal sclerosis[J]. Gene, 2013, 526(2): 449-453. |
| [10] | Kedersha NL, Rome LH. Isolation and characterization of a novel ribonucleoprotein particle: large structures contain a single species of small RNA[J]. J Cell Biol, 1986, 103(3): 699-709. |
| [11] | Gotovdorj T, Lee E, Lim Y, et al. 2,3,7,8-Tetrachlorodibenzop-dioxin induced cell-specific drug transporters with acquired cisplatin resistance in cisplatin sensitive cancer cells[J]. J Korean Med Sci, 2014, 29(9): 1188-1198. |
| [12] | 郭效东, 刘备, 张华, 等. 难治性癫癎患者脑组织穹隆体主蛋白表达的研究[J]. 临床神经病学杂志, 2013, 26(3): 161-164. |
| [13] | Rojas A, Jiang J, Ganesh T, et al. Cyclooxygenase-2 in epilepsy[J]. Epilepsia, 2014, 55(1): 17-25. |
| [14] | Auvin S, Shin D, Mazarati A, et al. Inflammation induced by LPS enhances epileptogenesis in immature rat and may be partially reversed by IL1RA[J]. Epilepsia, 2010, 51 Suppl 3: 34-38. |
| [15] | van Vliet EA, Zibell GA, Schlichtiger J, et al. COX-2 inhibition controls P-glycoprotein expression and promotes brain delivery of phenytoin in chronic epileptic rats[J]. Neuropharmacology, 2010, 58(2): 404-412. |
| [16] | Citraro R, Leo A, Marra R, et al. Antiepileptogenic effects of the selective COX-2 inhibitor etoricoxib, on the development of spontaneous absence seizures in WAG/Rij rats[J]. Brain Res Bull, 2015, 113: 1-7. |
| [17] | Annamaria V. Anti-inflammatory drugs in epilepsy: does it impact epileptogenesis? [J]. Expert Opin Drug Saf, 2015, 14(4): 583-592. |
| [18] | 王宁, 秦明照. 选择性环氧化酶-2 抑制剂与心血管事件风险[J]. 心血管病学进展, 2013, 34(2): 170-173. |
| [19] | Polascheck N, Bankstahl M, Löscher W. The COX-2 inhibitor parecoxib is neuroprotective but not antiepileptogenic in the pilocarpine model of temporal lobe epilepsy[J]. Exp Neurol, 2010, 224(1): 219-233. |
 2016, Vol. 18
2016, Vol. 18