2.重庆医科大学附属儿童医院呼吸中心,重庆 401122
呼吸道合胞病毒(respiratory syncytial virus,RSV)是引起5岁以下儿童呼吸道病毒感染最常见与最重要的病原,婴幼儿两岁前几乎100%感染过RSV[1]。RSV感染与反复喘息及哮喘的发生密切相关,约90%的RSV感染住院患儿将经历至少2次以上喘息发作,其中50%在6岁时被诊断为哮喘[2, 3]。研究报道:RSV感染后易继发肺炎链球菌、金黄色葡萄球菌、流感病毒、鼻病毒等感染,导致喘息及哮喘发生风险显著增加[4, 5]。RSV再感染时气道炎症增强、气道粘液分泌增多,气道反应性(airway hyperresponsiveness,AHR)也明显增高[6]。而RSV感染后期再感染其他病毒与气道炎症及气道高反应状态的机制目前尚不清楚。
病毒在复制及转录时产生dsRNA可激活固有免疫反应介导炎症的发生[7]。Poly(I:C)是人工合成的 dsRNA,被广泛用于模拟病毒感染的各类实验研究。本研究拟通过建立RSV感染后期暴露于Poly(I:C)的动物模型,探讨RSV感染后再发呼吸道病毒感染时诱发气道炎症及反复喘息的致病机制。
1材料与方法 1.1 RSV病毒繁殖RSV A2标准株的培养及繁殖参见于文献[8]。空斑实验进行病毒滴度测定(7.2×107 PFU/mL)。
1.2实验动物分组64只6~8周龄雌性BALB/c小鼠购于重庆医科大学实验动物中心,随机分为 4组(n=16)。对照组:细胞培养上清液100 μL滴鼻后第35天PBS(50 μL)滴鼻;Poly(I:C)组:PBS滴鼻后第35天Poly(I:C)(LMW,tlrl-picw,Invivogen)10 μg/50 μLPBS滴鼻;RSV感染组:RSV 100 μL滴鼻后第35天PBS(50 μL)滴鼻;RSV+Poly(I:C)组:RSV滴鼻后第35天给予Poly(I:C)10 μg/50 μL PBS滴鼻。3天后检测AHR、采集肺组织及肺泡灌洗液(bronchoalveolar lavage fluid,BALF)标本。
1.3气道反应性测定将清醒状态小鼠(n=8)先后置于雾化罐及记录罐中,通过小鼠肺功能仪描记监测AHR。基础值(Baseline)为小鼠在未进行乙酰胆碱(Sigma)雾化前的记录值,体积描记仪器(EMKA)记录气道阻力(enhanced pause,Penh)值。待检测的小鼠分别用生理盐水及不同质量浓度(3.125~50 mg/mL)的乙酰胆碱雾化激发后记录读数。激发3 min,休息2 min,读数5 min。气道反应性曲线表示在不同质量浓度乙酰胆碱雾化后的气道阻力值(Penh=PEP/PIF×Pause)。
1.4肺泡灌洗液中炎症细胞总数及分类计数气道反应性测定后麻醉处死小鼠(n=8),进行有创气管插管,用预冷的PBS灌洗肺脏(每次0.5 mL)并收集,回收率大于90%,共6次。BALF于4 ℃离心后(2 500转/min,5 min),将上清液在冰上收集、分装,快速存于-80℃冰箱待测。细胞沉渣用1 mL PBS重悬混匀后细胞计数机计数;余液再次离心,细胞沉渣涂片,瑞姬氏染液(南京建成科技有限公司)染色后,油镜下进行细胞计数。
1.5肺组织病理切片小鼠(n=8)处死后将左侧肺取出,置于10%甲醛固定24 h,行组织脱水,石蜡包埋。组织蜡块切片(5 μm)后苏木精-伊红(HE)染色,光镜下观察肺组织炎症浸润情况,根据文献[9]分别进行细支气管周围炎症、血管周围炎症及肺泡炎症病理评分。评分由两位实验者分别进行,2人评分平均值作为病理评分结果。
1.6 BALF中细胞因子及基质金属蛋白酶9、基质金属蛋白酶抑制物水平检测ELISA方法检测小鼠BALF中干扰素γ(IFN-γ)、白介素4(IL-4)、白介素13(IL-13)水平及基质金属蛋白酶9(matrixmetalloproteinases-9,MMP-9)和基质金属蛋白酶抑制物-1(tissue inhibitor of matrix metalloprotease-1,TIMP-1)含量,操作按试剂盒(博士德)说明书进行。
1.7统计学分析采用Graphpad Prim 5.03软件进行统计学分析,计量资料采用均数±标准差(x±s)表示,两组均数比较采用t检验;多个样本均数比较采用One-Way ANOVA分析,以Newman-Keuls检验进行两两比较。P<0.05为差异有统计学意义。
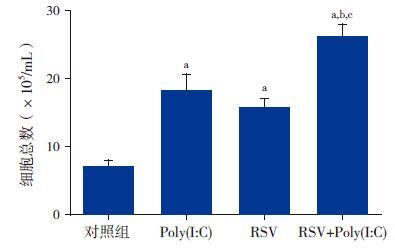
2结果 2.1 BALF中炎性细胞总数及分类计数Poly(I:C)组、RSV组及RSV+Poly(I:C)组BALF中细胞总数均较对照组显著增多(P<0.01),同时RSV+Poly(I:C)组细胞总数也明显高于RSV组及Poly(I:C)组(P<0.01),RSV组与Poly(I:C)组的细胞总数差异无统计学意义(P>0.05)。见图 1。其中RSV组以淋巴细胞增高为主,Poly(I:C)组和RSV+Poly(I:C)组以巨噬细胞为主。
|
图 1各组小鼠BALF细胞总数比较(n=8) a示与对照组比较,P<0.01;b示与Poly(I:C)组比较,P<0.01;c示与RSV组比较,P<0.01。 |
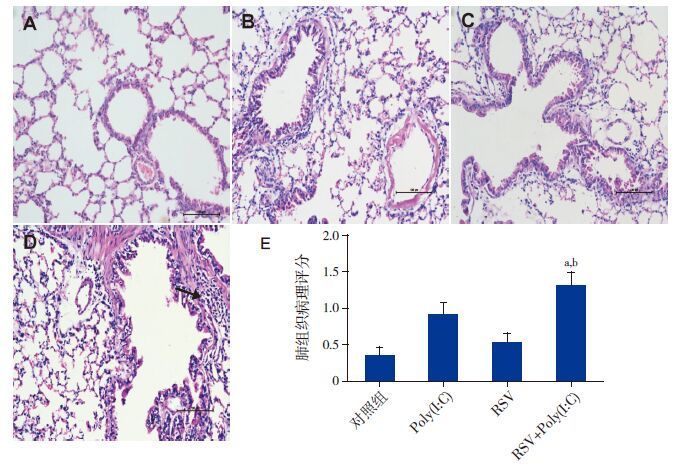
对照组小鼠肺泡壁薄,结构清楚,无炎症细胞浸润。Poly(I:C)组、RSV组及RSV+Poly(I:C)组均存在肺泡壁增厚,气管周围、血管周围不同程度炎症细胞浸润。RSV+Poly(I:C)组病理评分明显高于对照组及RSV组(P<0.01),与Poly(I:C)组差异无统计学意义(P>0.05)。见图 2。
|
图 2肺组织炎症浸润情况(HE染色,×200,n=8) A~D依次为对照组、Poly(I:C)组、RSV组及RSV+ Poly(I:C)组小鼠肺组织病理改变,E为肺组织病理评分。a示与对照组比较,P<0.01;b示与RSV组比较,P<0.01。 |
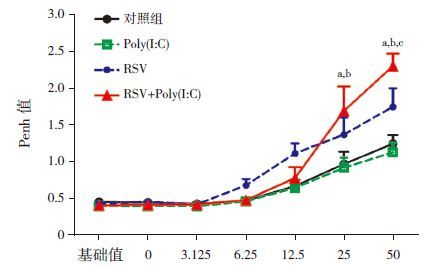
Poly(I:C)组和RSV组小鼠Penh值与对照组比较,差异无统计学意义(P>0.05),而RSV+Poly(I:C)组Penh值在乙酰胆碱浓度为25 mg/mL及50 mg/mL时均显著高于Poly(I:C)组和对照组(P<0.01),与RSV组差异无统计学意义(P>0.05);在50 mg/mL浓度时,RSV+Poly(I:C)组小鼠Penh值明显高于另外3组(P<0.05)。见图 3。
|
图 3乙酰胆碱激发呼气阻力(Penh值)(n=8) a示与对照组比较,P<0.01;b示与Poly(I:C)组比,较P<0.01;c示与RSV组比较,P<0.05。 |
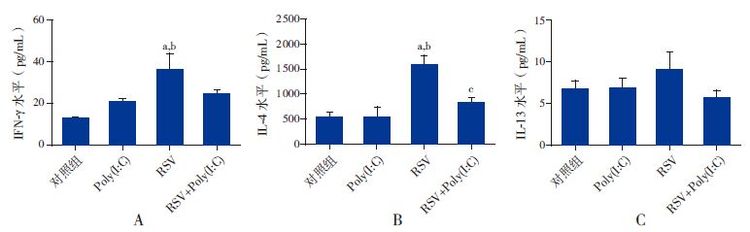
单纯Poly(I:C)刺激后,BALF中IFN-γ及IL-4表达较对照组差异无统计学意义(P>0.05);RSV感染后IFN-γ水平及IL-4水平均较对照组和Poly(I:C)组明显升高(P<0.05);RSV+Poly(I:C)组小鼠BALF中IL-4表达较RSV组明显降低(P<0.01);4组BALF中IL-13表达差异无统计学意义(P>0.05)。见图 4。
|
图 4各组小鼠BALF中细胞因子水平(n=8) A~C依次为各组小鼠BALF中IFN-γ、IL-4及IL-13表达水平比较。a示与对照组比较,P<0.05;b示与Poly(I:C)组比较,P<0.01;c示与RSV组比较,P<0.05。 |
Poly(I:C)组及RSV组BALF中MMP-9以及MMP-9/TIMP-1比值较对照组差异无统计学意义(P>0.05);RSV+Poly(I:C)组MMP-9及MMP-9/TIMP-1比值较其余3组均有升高(P<0.05);RSV+Poly(I:C)组TIMP-1的表达较RSV组下降(P<0.05),但其余3组的TIMP-1表达差异无统计学意义(P>0.05)。见图 5。
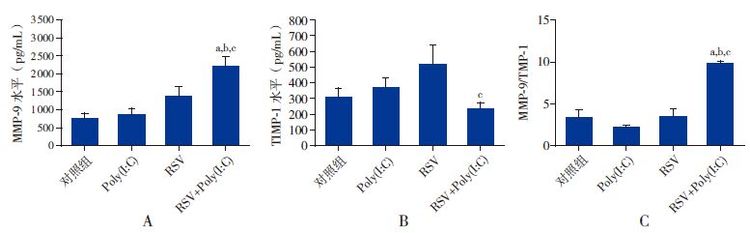
|
图 5各组小鼠BALF中MMP-9及TIMP-1水平(n=8) A、B分别为各组BALF中MMP-9及TIMP-1表达情况,C为各组的MMP-9/TIMP-1。a示与对照组比较,P<0.01;b示与Poly(I:C)组比较,P<0.01;c示与RSV组比较,P<0.05。 |
RSV感染后再发生病毒感染是儿童喘息发生高风险因素。Poly(I:C)是人工合成的dsDNA,可以与TLR3结合,刺激靶细胞产生细胞因子和趋化因子,模拟活病毒感染的病理状态。本研究发现,RSV感染后期再遇到Poly(I:C)刺激气道炎症细胞增多,肺部病理损伤加重,气道反应性增高,BALF中MMP-9水平升高,同时TIMP-1及Th2类因子降低。
研究表明卵白蛋白(ovalbumin,OVA)致敏后用Poly(I:C)处理小鼠,气道反应性升高,支气管和血管周围有较多炎症细胞浸润,BALF中炎症细胞总数显著增多同时伴有IL-5及IL-13水平上调[10]。Choi等[11]用Poly(I:C)增敏建立病毒相关过敏性哮喘模型,发现肺组织IL-4及IFN-γ水平较单纯OVA致敏显著升高并参与气道炎症的致病。本研究发现 RSV+ Poly(I:C)组小鼠BALF中IL-4表达水平均较单纯RSV感染组小鼠降低。提示在RSV感染后Poly(I:C)刺激所诱发的肺部炎症反应及气道高反应不是由传统的细胞因子介导,可能存在其他机制参与。
MMP-9被公认为与哮喘关系密切的蛋白酶,活化后参与维持细胞外基质的稳定;其表达受多种机制调控,细胞因子、生长因子及激素等可以上调MMP-9的表达,而TIMP-1则与其特异性结N-端反应域合使之失活及降解[12]。MMP-9及TIMP-1通过调节胶原蛋白、弹性蛋白和蛋白多糖等的降解及合成,维持细胞外基质和基底膜正常结构及功能;病理情况下可以趋化炎性细胞,调节表皮、成纤维细胞增殖,上调纤维蛋白表达,参与气道炎症反应及气道重塑[13]。动物实验表明哮喘组小鼠肺组织MMP-9水平明显高于对照组[14]。而TIMP-1在OVA诱发哮喘动物模型中具有保护作用,TIMP-1基因敲除鼠则会出现肺部炎症、AHR及促进细胞因子产生[15]。MMP-9与TIMP-1之间的平衡可能决定了疾病的发展方向。哮喘患者气道狭窄与MMP-9/TIMP-1比值升高相关[16]。本研究发现RSV+Poly(I:C)组小鼠BALF中MMP-9/TIMP-1比例显著升高,提示RSV感染后病毒再感染可能通过影响MMP-9/TIMP-1的平衡加重气道炎症及AHR。
综上所述,RSV感染后病毒再感染可能通过MMP-9/TIMP-1表达失衡参与气道炎症反应及AHR的致病机制。因此,本研究为RSV感染后再发生病毒感染所致的气道炎症及反复喘息提供了可能的干预靶点。
| [1] | Nair H, Nokes DJ, Gessner BD, et al. Global burden of acute lower respiratory infections due to respiratory syncytial virus in young children: a systematic review and meta-analysis[J]. Lancet, 2010, 375(9725): 1545-1555. |
| [2] | Bacharier LB, Cohen R, Schweiger T, et al. Determinants of asthma after severe respiratory syncytial virus bronchiolitis[J]. J Allergy Clin Immunol, 2012, 130(1): 91-100. |
| [3] | Feldman AS, He Y, Moore ML, et al. Toward primary prevention of asthma. Reviewing the evidence for early-life respiratory viral infections as modifiable risk factors to prevent childhood asthma[J]. Am J Respir Crit Care Med, 2015, 191(1): 34-44. |
| [4] | Stark JM, Stark MA, Colasurdo GN, et al. Decreased bacterial clearance from the lungs of mice following primary respiratory syncytial virus infection[J]. J Med Virol, 2006, 78(6): 829-838. |
| [5] | Thomas AO, Lemanske RF Jr, Jackson DJ. Infections and their role in childhood asthma inception[J]. Pediatr Allergy Immunol, 2014, 25(2):122-128 |
| [6] | You D, Marr N, Saravia J, et al. IL-4Rα on CD4+ T cells plays a pathogenic role in respiratory syncytial virus reinfection in mice infected initially as neonates[J]. J Leukoc Biol, 2013, 93(6): 933-942. |
| [7] | Kimura G, Ueda K, Eto S, et al. Toll-like receptor 3 stimulation causes corticosteroid-refractory airway neutrophilia and hyperresponsiveness in mice[J]. Chest, 2013, 144(1): 99-105. |
| [8] | 李伟,龙晓茹,谢军,等.呼吸道合胞病毒感染断乳期小鼠后再感染的细胞因子变化及致病机制[J].免疫学杂志, 2014, 31(4): 288-292. |
| [9] | Zang N, Li S, Li W, et al. Resveratrol suppresses persistent airway inflammation and hyperresponsivess might partially via nerve growth factor in respiratory syncytial virus-infected mice[J]. Int Immunopharmacol, 2015, 28(1): 121-128. |
| [10] | Torres D, Dieudonné A, Ryffel B, et al. Double-stranded RNA exacerbates pulmonary allergic reaction through TLR3: implication of airway epithelium and dendritic cells[J]. J Immunol, 2010, 185(1): 451-459. |
| [11] | Choi JP, Kim YS, Kim OY, et al. TNF-alpha is a key mediator in the development of Th2 cell response to inhaled allergens induced by a viral PAMP double-stranded RNA[J]. Allergy, 2012, 67(9): 1138-1148. |
| [12] | Vandooren J , Van den S teen PE, Opdenakker G . Biochemistry and molecular biology of gelatinase B or matrix metalloproteinase-9 (MMP-9): the next decade[J]. Crit Rev Biochem Mol Biol, 2013, 48(3): 222-272. |
| [13] | Meyer M, Jaspers I. Respiratory protease/antiprotease balance determines susceptibility to viral infection and can be modified by nutritional antioxidants[J]. Am J Physiol Lung Cell Mol Physiol, 2015, 308(12): L1189-L1201. |
| [14] | Felsen CN, Savariar EN, Whitney M, et al. Detection and monitoring of localized matrix metalloproteinase upregulation in a murine model of asthma[J]. Am J Physiol Lung Cell Mol Physiol, 2014, 306(8): L764-L774. |
| [15] | Sands MF, Ohtake PJ, Mahajan SD, et al. Tissue inhibitor of metalloproteinase-1 modulates allergic lung inflammation in murine asthma[J]. Clin Immunol, 2009, 130(2): 186-198. |
| [16] | Chaudhuri R, McSharry C, Brady J, et al. Low sputum MMP-9/ TIMP ratio is associated with airway narrowing in smokers with asthma[J]. Eur Respir J, 2014, 44(4): 895-904. |
 2016, Vol. 18
2016, Vol. 18


