2. 暨南大学附属第一医院影像科, 广东 广州 510630 ;
3. 广东省妇幼保健院新生儿科, 广东 广州 510010
随着新生儿重症监护技术的快速发展,极早早产儿和极低出生体重儿的生存率大大提高。但伴随着早产儿生存率的提高,神经系统后遗症发生率却居高不下,容易导致认知、行为、感知以及运动的障碍 [1-5]。这些神经系统后遗症常常与脑白质损伤相关。因此,早期识别脑白质损伤及成熟异常,对于精准制定危重早产儿的预防、保护和康复方案非常重要。
磁共振弥散张量成像(diffusion tensor imaging,DTI)技术可以用来无创观察和定量描述脑白质纤维束。相对于常规 MRI的 T1、T2、DWI序列,DTI在判断早产儿脑白质的髓鞘化发育及脑白质细微结构变化方面有明显优势 [6]。该技术在国外已经广泛应用于早产儿的脑发育及脑损伤的检查及研究,但国内对 DTI在极低出生体重儿和极早早产儿的应用报道相对较少。
目前 DTI常用的参数有部分各项异性(fractional anisotropy,FA)和表观弥散系数(apparentdiffusion coefficient,ADC)。FA值与髓鞘的完整性、纤维致密性以及平行性呈正相关,能定量评估白质纤维髓鞘发育及损伤情况,FA值在脑损伤时降低,并且随着早产儿胎龄的增大逐渐升高,反映的是脑白质髓鞘化程度。ADC值反映的是水分子的弥散能力,主要由组织含水量决定。而细胞外间隙的减小或水分子含量的减少可以导致 ADC值减小,脑损伤时 ADC值会升高。对于大多数脑白质纤维束,ADC值随着生后周龄的增加而降低,但其降低程度并不如 FA值的增加显著。
本研究分析极低出生体重早产儿至纠正胎龄足月时,在常规头颅 MRI序列的基础上,利用DTI的 FA值及 ADC值对脑白质髓鞘及灰质核团的发育成熟程度进行定量评价,并与正常足月新生儿进行比较,以了解早产儿脑白质髓鞘发育的特点。
1 资料与方法 1.1 研究对象及分组选取 2011年 1月至 2013年 12月广州华侨医院住院治疗的胎龄≤ 32周、出生体重 <1500 g的早产儿 31例,于纠正胎龄 37~40周完成常规头颅MRI检查及 DTI检查。根据 MRI结果将之分为早产无脑损伤组(n=19,胎龄 212±14 d,其中适于胎龄儿 12例、小于胎龄儿 7例,MRI检查时纠正胎龄为 274±13 d;出生体重 1.28±0.21 kg,检查时体重为 2.10±0.33 kg)和早产脑损伤组(n=12,胎龄 216±15 d,其中适于胎龄儿 7例、小于胎龄儿 5例,MRI检查时纠正胎龄 272±10 d;出生体重 1.35±0.12 kg,检查时为体重 2.06±0.23 kg)。脑损伤均为局灶性脑白质损伤:侧脑室前后角、半卵圆中心白质有单个或多个(<3处)局灶性损伤,但在 DTI选取的感兴趣区结构完整;共有 19个病灶,左侧侧脑室前角 4个,右侧侧脑室前角 3个,右侧半卵圆中心 5,左侧半卵圆中心 4个,右侧侧脑室后角 2个,左侧侧脑室后角 1个;其中单个病灶有 5例,2个病灶有 7例。另外选取 24例产前超声诊断为侧脑室或透明隔增宽、后颅窝积液的足月儿作为对照组(出生体重 3.45±0.22 kg,胎龄 273±7 d),均在生后 1周内完成 DTI检查(出生后 MRI检查仅示透明隔间腔)。两组早产儿行MRI检查时的纠正胎龄与足月对照组检查时的日龄相当(P>0.05)。
1.2 MRI检查及 DTI图像处理分析所有研究对象自然入睡后或 10%水合氯醛灌肠(0.5 mL/kg)入睡后接受头颅常规 MRI及 DTI检查,头部采用海绵垫固定,外耳道置入棉球以减低扫描时产生的噪音。成像仪器为 1.5T GE HDMR扫描仪,梯度场强度 23 mT/m,梯度切换率是每毫秒 120 mT/m,线圈为 8通道头颈联合线圈,成像序列依次为 T1 flair(TR 1475 ms/TE 22 ms/TI750 ms),矩阵是 320×224,激发次数为 2;T2WI(TR 3 800 ms/TE 120 ms),矩阵 448×448,激发次数(number of excitation,NEX)1.5;DTI采用单次激发自旋回波-平面回波技术,TR 8 000 ms,TE 114 ms,矩阵 128×128,NEX为 1,弥散加权系数 b=0、b=1 000(s/mm2),DTI弥散敏感梯度方向:15;上述成像序列的成像方位均为横轴位,视野 20 cm×20 cm,层厚 5 mm,各成像序列的扫描基线为前-后联合连线。
将采集的 MRI数据传送至影像后处理工作站(GE AW4.2版本);DTI图像后处理:Functool软件处理,经过图像校准、平滑,拟合 T1 flair图,严格选择同一层面上相对应解剖结构作为感兴趣区(region of interest,ROI),所选择的 ROI小于所分析的解剖结构大小,以避免邻近组织的影响,选择基底节层面双侧内囊后肢、豆状核、额叶白质及枕叶白质作为感兴趣区,并运用 Functool软件自动计算出各感兴趣区的 FA、ADC值。
1.3 统计学分析以 SPSS13.0统计软件进行处理,各参数值用均数 ±标准差(x±s)表示。组间比较采用单因素方差分析(SNK法)。 P<0.05为差异有统计学意义。
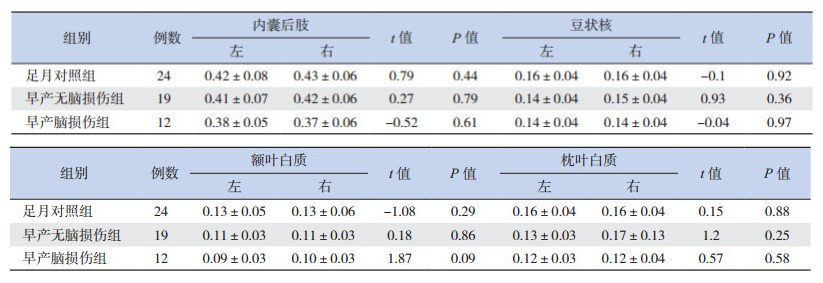
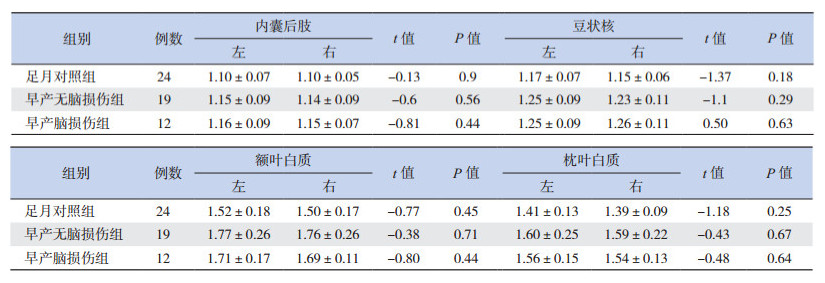
2 结果 2.1 各组左右大脑半球相应感兴趣区的 ADC、FA值比较各组双侧大脑半球相对应感兴趣区的 FA、ADC值差异均无统计学意义(P>0.05),见表 1~2。
| 表 1 3 组左右大脑半球相应感兴趣区的 FA 值比较 (x±s) |
| 表 2 3 组左右大脑半球相应感兴趣区的 ADC 值比较 (x±s,10-3 mm2/s) |
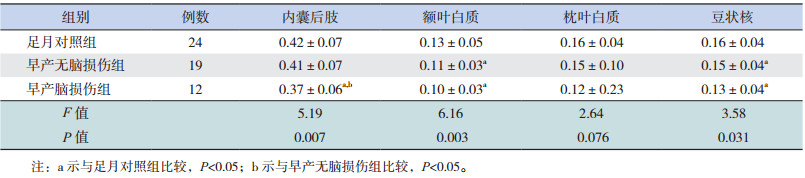
2.2 3组间不同部位感兴趣区的 FA值、ADC值比较
内囊后肢的 FA值,早产脑损伤组明显低于早产无脑损伤组及足月对照组(P<0.05),早产无脑损伤组与足月对照组之间的差异无统计学意义(P>0.05);额叶白质和豆状核的 FA值,早产脑损伤组与早产无脑损伤组均低于足月对照组(P<0.05),而早产脑损伤组与早产无脑损伤组之间差异无统计学意义(P>0.05);枕叶白质的 FA值在 3组间的差异无统计学意义(P>0.05)。见表 3。
| 表 3 3 组间不同部位感兴趣区的 FA 值比较(x±s,10-3 mm2/s) |
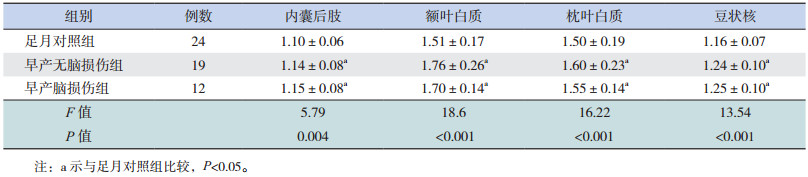
内囊后肢、豆状核、枕叶白质、额叶白质的ADC值在早产脑损伤组、无脑损伤组均高于足月对照组(P<0.05),但早产脑损伤组与无脑损伤组之间差异无统计学意义(P>0.05),见表 4。
| 表 4 3 组间不同部位感兴趣区的 ADC 值比较(x±s,10-3 mm2/s) |
3 讨论
DTI能够通过施加弥散敏感梯度磁场来观察水分子的弥散各向异性程度,并能用多个参数值来定量表达,是目前唯一能够观察活体组织结构髓鞘发育、成熟及退变的无创性检查方法。DTI不仅能观察髓鞘成熟后的脑结构,对髓鞘化之前的脑结构同样可以进行定量评价,因此特别适于早产儿脑发育的研究 [7-14]。
本研究选择的 ROI为内囊后肢、额叶白质和枕叶白质、豆状核,包括了灰质结构、深部白质、以及周围白质。足月新生儿的内囊后肢在出生时已表现出髓鞘成熟的典型 MRI信号,其中内囊后肢的小斑片髓鞘化信号往往被认为是足月新生儿的常规 MRI标志 [15],因此本研究选择了内囊后肢作为 ROI之一。此外,脑髓鞘的发育顺序为由尾端向头端,从下向上,从后部向前部顺序发展,近端的通路早于远端,感觉系统早于运动系统。额叶、枕叶分别位于脑组织的前、后份;而且额叶白质和枕叶白质为周围白质,分别选择额叶白质、枕叶白质反映早产儿前部、后部脑结构的发育程度。豆状核是灰质核团,为新生儿代谢旺盛的区域之一,其髓鞘发育亦非常活跃。而组成内囊的纤维也来自于几乎所有大脑皮层的下行纤维,在豆状核的上方组成了巨大的白质纤维束—放射冠。因此,分析上述 ROI区域的参数值变化,可以初步了解早产儿灰质、白质结构的发育特征,以及灰质、白质结构之间的联系信息。
FA值主要受到弥散物理屏障的大小、形态和组成成分影响,完整的细胞膜是最大的影响因素,而髓鞘、轴突的快速转运、细胞骨架(神经微丝和微管)以及局部的磁敏感梯度场似乎并没有对水分子的各向异性弥散产生重要的影响。FA值在脑损伤时降低,并且随着早产儿胎龄的增大逐渐升高,反映的是脑白质髓鞘化程度。
而细胞外间隙的减小或水分子含量的减少可以导致 ADC值减小,脑损伤时 ADC值会升高。对于大多数脑白质纤维束,FA值随着生后周龄的增加而明显升高,ADC值则随着生后周龄的增加而降低,但其降低程度并不如 FA值的增加显著。
本研究发现内囊后肢、额叶白质、枕叶白质及豆状核的 FA、ADC值均存在双侧对称性,与大多数文献报道相符 [16-18]。内囊后肢的 FA值明显高于豆状核和枕叶的 FA值,额叶 FA值最低。这与脑白质髓鞘化发育的规律相符,即从中心向周围、从后向前逐渐成熟。而 ADC值则是内囊后肢 <豆状核 <枕叶 <额叶。
本研究发现至纠正胎龄足月时,早产儿脑损伤组内囊后肢 FA值比无脑损伤组明显要低;虽然无脑损伤的早产儿 FA值比足月儿低,但是差异无统计学意义;而内囊后肢的 ADC值早产脑损伤组与早产无脑损伤组之间无差异,均高于足月对照组。上述结果与 Hüppi等的研究结果相同,他们对于有脑白质损伤和无脑白质损伤的早产儿研究发现,前者在足月期间内囊后肢水平以下的白质纤维束 FA值降低了约 20%,而 ADC值在两者间没有差异 [19]。这可能与早产儿脑白质受损的常见部位是侧脑室周围内囊附近有关,更明显地影响内囊后肢纤维束的髓鞘化发育,对脑组织的含水量影响不大。
有脑损伤的早产儿及无脑损伤的早产儿额叶白质的 FA值、ADC值差异均无统计学意义;而所有早产儿无论有无脑损伤,其额叶白质 FA值均比足月儿低、ADC值比足月儿高。提示即使常规MRI未发现病灶的早产儿,其额叶白质髓鞘化发育过程中也可能存在宫外发育迟缓的现象。
有脑损伤早产儿、无脑损伤早产儿以及足月对照组的枕叶白质 FA值均无差异,这可能是由于脑白质髓鞘发育通常遵循从足侧向头侧(脑干-小脑-大脑)、从背侧向腹侧、从中央向周围的规律。枕叶位于背侧,髓鞘化发生较早,足月时已经完成髓鞘化,故而 3组之间无明显差异。
由于内囊后肢、额叶白质和枕叶白质为单纯的白质纤维结构,FA值主要受髓鞘成熟的影响;而豆状核为深部灰质核团,包括苍白球与壳核。壳核的神经元有树突和轴突,树突的分支表面无髓鞘而仅仅附有大量的细刺状棘突,但轴突上有髓鞘包被;苍白球的有髓神经纤维甚至集结成束。因此,豆状核的 FA值仍然会受到髓鞘成熟的影响 [20]。对于极早早产儿的 DTI研究也表明随着神经纤维的有序性增加,皮层等灰质的各向异性也增加。有文献认为,神经元的密度增加或其排列方向不同可能会影响到灰质的 FA值 [21]。本研究中脑损伤早产儿、无脑损伤早产儿的豆状核 FA值及ADC值差异均无统计学意义,但两组早产儿 FA值均低于对照组、ADC值则高于对照组,提示早产儿无论是否存在脑损伤,深部灰质核团的成熟依然与足月儿存在差异。
本研究的结果提示,早产儿脑损伤后内囊后肢的深部脑白质髓鞘化出现成熟障碍;无论是否合并早产儿脑损伤,早产儿的额叶白质髓鞘化均延迟。提示早产儿存在宫外的白质髓鞘发育延迟,脑损伤会加重髓鞘发育延迟。MRI、DTI适于早产儿脑白质髓鞘发育研究的临床运用。
| [1] | Marlow N, Wolke D, Bracewell MA, et al. Neurologic and developmental disability at six years of age after extremely preterm birth[J]. N Engl J Med,2005, 352 (1) :9–19 . |
| [2] | Saigal S, Doyle LW. An overview of mortality and sequelae of preterm birth from infancy to adulthood[J]. Lancet,2008, 371 (9608) :261–269 . |
| [3] | Bhutta AT, Cleves MA, Casey PH, et al. Cognitive and behavioral outcomes of school-aged children who were born preterm: a meta-analysis[J]. JAMA,2002, 288 (6) :728–737 . |
| [4] | Larroque B, Ancel PY, Marret S, et al. Neurodevelopmental disabilities and special care of 5-year-old children born before 33 weeks of gestation (the EPIPAGE study): a longitudinal cohort study[J]. Lancet,2008, 371 (9615) :813–820 . |
| [5] | Williams J, Lee KJ, Anderson PJ. Prevalence of motor-skill impairment in preterm children who do not develop cerebral palsy: a systematic review[J]. Dev Med Child Neurol,2010, 52 (3) :232–237 . |
| [6] | Pandit AS, Ball G, Edwards AD, et al. Diffusion magnetic resonance imaging in preterm brain injury[J]. Neuroradiology,2013, 55 (Suppl 2) :65–95 . |
| [7] | Partridge SC, Mukherjee P, Henry RG, et al. Diffusion tensor imaging: serial quantitation of white matter tract maturity in premature newborns[J]. Neuroimage,2004, 22 (3) :1302–1314 . |
| [8] | Anjari M, Srinivasan L, Allsop JM, et al. Diffusion tensor imaging with tract-based spatial statistics reveals local white matter abnormalities in preterm infants[J]. Neuroimage,2007, 35 (3) :1021–1027 . |
| [9] | Arzoumanian Y, Mirmiran M, Barnes PD, et al. Diffusion tensor brain imaging findings at term-equivalent age may predict neurologic abnormalities in low birth weight preterm infants[J]. AJNR Am J Neuroradiol,2003, 24 (8) :1646–1653 . |
| [10] | Sundgren PC, Dong Q, Gomez-Hassan D, et al. Diffusion tensor imaging of the brain: review of clinical applications[J]. Neuroradiology,2004, 46 (5) :339–350 . |
| [11] | Hüppi PS, Murphy B, Maier SE, et al. Microstructural brain development after perinatal cerebral white matter injury assessed by diffusion tensor magnetic resonance imaging[J]. Pediatrics,2001, 107 (3) :455–460 . |
| [12] | 王淑霞. 3.0 T MRI、扩散加权成像和扩散张量成像在早产儿脑病的应用研究[D]. 武汉: 华中科技大学, 2012. |
| [13] | Arfanakis K, Haughton VM, Carew JD, et al. Diffusion tensor MR imaging in diffuse axonal injury[J]. AJNR Am J Neuroradiol,2002, 23 (5) :794–802 . |
| [14] | Ling X, Tang W, Liu G, et al. Assessment of brain maturation in the preterm infants using diffusion tensor imaging (DTI) and enhanced T2 star weighted angiography (ESWAN)[J]. Eur J Radiol,2013, 82 (9) :E476–E483 . |
| [15] | Liauw L, Palm-Meinders IH, van der Grond J, et al. Differentiating normal myelination from hypoxic-ischemic encephalopathy on T1-weighted MR Images: a new approach[J]. AJNR Am J Neuroradiol,2007, 28 (4) :660–665 . |
| [16] | Dudink J, Buijs J, Govaert P, et al. Diffusion tensor imaging of the cortical plate and subplate in very-low-birth-weight infants[J]. Pediatr Radiol,2010, 40 (8) :1397–1404 . |
| [17] | de Bruine FT, van Wezel-Meijler G, Leijser LM, et al. Tractography of developing white matter of the internal capsule and corpus callosum in very preterm infants[J]. Eur Radiol,2011, 21 (3) :538–547 . |
| [18] | Gilmore JH, Lin W, Corouge I, et al. Early postnatal development of corpus callosum and corticospinal white matter assessed with quantitative tractography[J]. AJNR Am J Neuroradiol,2007, 28 (9) :1789–1795 . |
| [19] | Hüppi PS, Murphy B, Maier SE, et al. Microstructural brain development after perinatal cerebral white matter injury assessed by diffusion tensor magnetic resonance imaging[J]. Pediatrics,2001, 107 (3) :455–460 . |
| [20] | Wang Q, Xu X, Zhang M. Normal aging in the basal ganglia evaluated by eigenvalues of diffusion tensor imaging[J]. AJNR Am J Neuroradiol,2010, 31 (3) :516–520 . |
| [21] | Pfefferbaum A, Adalsteinsson E, Rohlfing T, et al. Diffusion tensor imaging of deep gray matter brain structures: effects of age and iron concentration[J]. Neurobiol Aging,2010, 31 (3) :482–493 . |
 2016, Vol. 18
2016, Vol. 18