随着产科技术及新生儿重症监护技术的发展,极低出生体重(出生体重 <1500 g)或者超低出生体重(出生体重 <1 000 g)早产儿生存率明显提高,美国极低出生体重早产儿的存活率已经达到 90%以上 [1]。但是高危儿由于宫内储备不足,加之出生后易遭受如新生儿坏死性小肠结肠炎、重症感染、新生儿呼吸窘迫综合症等并发症的打击,导致生长发育迟缓、远期神经认知行为受到影响 [2-7]。国外研究发现该群体的生长发育迟缓及认知行为问题发生率高于足月儿 [8-11],胎龄 <35周早产儿神经系统发育受损的风险更是明显提高 [12]。目前认为出生胎龄和出生体重与神经系统后遗症的发生密切相关 [13]。而我国关于极低出生体重早产儿的生长发育及神经运动发育的临床研究有限,因此,本研究对我院出生的极低出生体重早产儿进行出生后第一年的生长发育随访,为探索极低出生体重早产儿的管理模式提供临床资料。
1 资料与方法 1.1 研究对象选取 2013年 7月至 2014年 6月我院产科出生、新生儿科收治并出院的极低出生体重早产儿 61例(胎龄 27~35周,出生体重 860~1 499 g)。排除标准:有外科手术史,或合并先天性畸形、遗传代谢性疾病。出院后进行为期 1年的生长发育监测:半岁以内每月 1次,以后每 2个月 1次。
1.2 营养指导根据中国新生儿营养支持临床应用指南 [14]制定个体化的营养强化方案:纯母乳喂养的病例至少使用母乳强化剂(营养成分补充添加剂)至纠正胎龄 40周或 52周;部分母乳喂养者添加早产儿配方奶,当生长曲线达到纠正年龄的第 25~50百分位过渡到普通配方奶;补充维生素 D及铁剂。
1.3 体格测量及发育筛查体格测量由专业护士操作,测量 3次取均值。神经发育筛查采用丹佛发育筛查测验(Denverdevelopment screen test,DDST)进行:发育商(development quotient,DQ)<70分为异常,70分~为可疑,≥85分为正常。脑瘫诊断参照小儿脑瘫康复专业委员会标准 [15]。
1.4 评价标准研究对象分为小于胎龄儿(small for gestationalage,SGA)和适于胎龄儿(appropriate for gestationalage,AGA) [16]。生长发育评价采用 Z评分法 [17],Z=(个体实测值 -参考值均数)/标准差,低于同年龄同性别的 2个标准差为生长落后。年龄别体重 Z积分(weight-for-age Z-score,WAZ)<-2 SD为低体重,年龄别身长 Z积分(height-for-age Z-score,HAZ)<-2 SD为生长迟缓,身长别体重 Z积分(weight-for-height Z-score,WHZ)<-2 SD为消瘦,年龄别头围 Z积分(headcircumference-for-ageZ-score,HCZ)<-2 SD为小头畸形。体质指数(bodymass index,BMI)为体重(kg)/身长 2(m2),位于同年龄同性别曲线的第 85~95百分位为超重,>第 95百分位为肥胖 [17]。年龄别 BMI的 Z积分(BMI-for-age,BAZ)>-1 SD表明体质指数达到了同年龄同性别人群的中等水平。
1.5 统计学分析使用 SPSS 20.0软件进行统计分析。连续变量采用均数 ±标准差(x±s)或中位数(四分位区间)表示,二分类变量采用百分比表示。连续变量间的比较采用非参数检验(Mann-Whitney U-test),二分类变量比较采用卡方检验,危险因素分析采用二元 logistic回归分析。 P<0.05为差异有统计学意义。
2 结果 2.1 病例基本特征病例中男 30例(49%)、女 31例(51%)。平均胎龄 30.3±1.8周(27~35周):27周 ~6例(9.8%),28周~42例(68.9%),32~35周 13例(21.3%)。出生体重平均 1 245±175 g:860 g~6例(9.8%);1 000~1 500 g 55例(90.2%)。SGA 27例(44.3%)、AGA 34例(55.7%)。双胎14例(23%),单胎 47例(77%)。诊断为新生儿呼吸窘迫综合症 24例(39.3%),新生儿坏死性小肠结肠炎 2例(3.3%),支气管肺发育不良 8例(13.1%),新生儿窒息 13例(21.3%):轻度窒息 11例、重度窒息 2例,余 14例(23%)诊断为新生儿颅内出血(Ⅱ级或Ⅲ级)。母亲合并妊娠高血压 10例(18.5%)、妊娠糖尿病 8例(14.8%)。
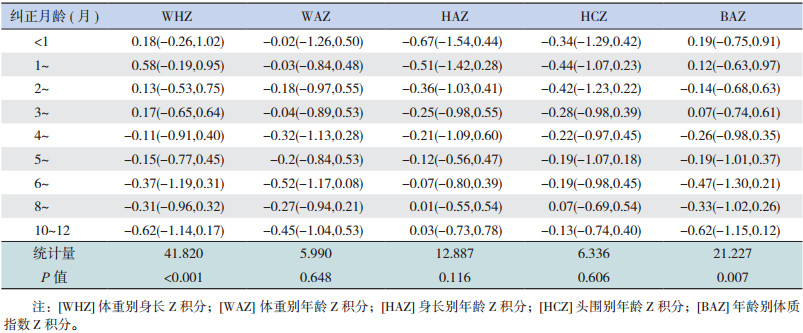
2.2 各年龄段生长发育评价各年龄段 WAZ、HAZ、HCZ、WHZ中位数均>-1 SD,BAZ以及 WHZ的高峰在纠正龄 1个月,见表 1。
| 表 1 不同纠正月龄早产儿的体格指标 Z 积分 [M(P25,P75)] |
2.3 各年龄段生长偏移情况
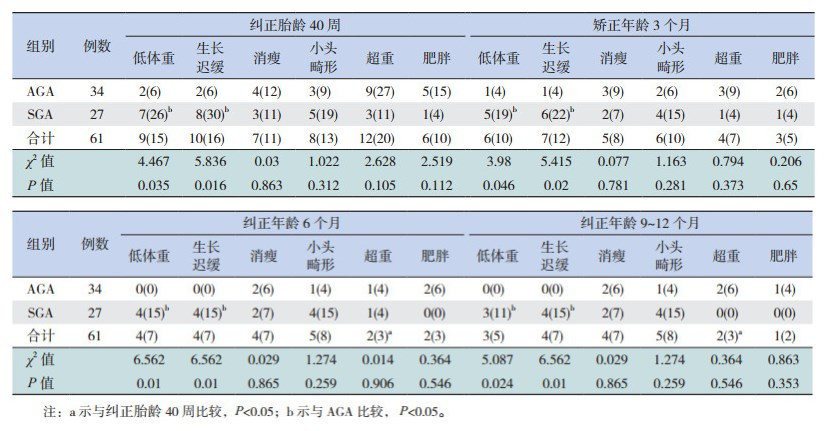
纠正胎龄 40周时,低体重、生长迟缓、消瘦、小头畸形、超重和肥胖的发生率分别为 15%、16%、11%、13%、20%和 10%。与纠正胎龄 40周比,纠正年龄 3个月的各种生长偏离发生率降低,但是差异无统计学意义;纠正龄 6个月及 9~12个月的超重发生率明显降低(P<0.05)。纠正龄 3个月、6个月龄及 9~12个月龄之间,生长偏离的发生率差异无统计学意义(P>0.05)。SGA组各年龄段的低体重和生长迟缓发生率均高于 AGA组(P<0.05),而两组间消瘦、小头畸形、超重和肥胖的发生率差异无统计学意义(P>0.05)。见表 2。
| 表 2 61 例早产儿不同年龄段生长偏离发生情况 [例(%)] |
2.4 神经发育筛查结果
研究对象随访至生后第一年,DQ异常的有25%(15/61),DQ可疑的 26%(16/61),DQ正常的 49%(30/61)。SGA组 DQ异常及可疑(20/27,74%)的发生率高于 AGA组(11/34,32%),差异有统计学意义(χ2=8.795,P=0.003)。4例(4/61,7%)患儿在 12~18个月时诊断为脑性瘫痪:3例痉挛型脑瘫、1例不随意运动型脑瘫。
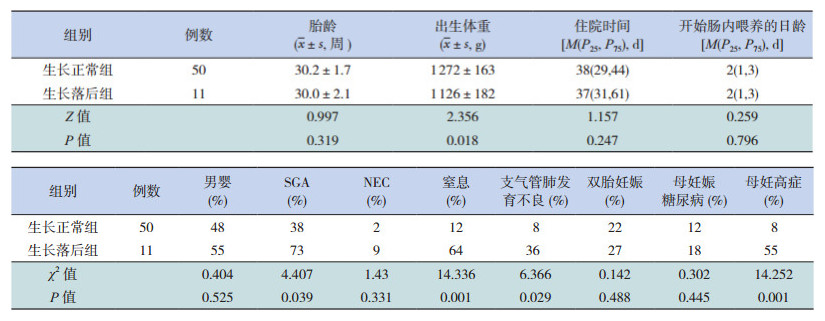
2.5 极低出生体重早产儿生长落后危险因素分析极低出生体重早产儿第一年生长正常组的出生体重高于生长落后组(P<0.05);生长落后组的SGA、出生窒息、支气管肺发育不良的几率以及母亲妊高症的几率高于生长正常组(P<0.05)。见表 3。将这些因素纳入到 Logistic回归方程,显示小于胎龄是极低出生体重早产儿生后第一年体格生长落后的独立危险因素 [OR=15.268,95%CI(2.249,103.662),P=0.005]。
| 表 3 极低出生体重早产儿生长落后的影响因素分析 |
3 讨论
极低出生体重早产儿是一个特殊的群体,出生体重明显低下,各器官系统发育不成熟,且其小于胎龄发生的风险明显高于足月儿 [18]。极低出生体重早产儿生后早期的追赶生长不仅影响了其体格、神经运动发育,还与成年期慢性病的发生风险相关,因此需要对他们予以更多的关注 [19]。Sharma及 Mukhopadhyay等 [20-21]对极低出生体重早产儿进行一年的随访发现,纠正胎龄至 40周时生长偏离的发生率可高达 50%;即使至生后第一年,生长偏离的发生率仍可高达 30%。我们的资料显示,61例研究对象随访至纠正胎龄 40周时,低体重、生长迟缓、消瘦和小头畸形的发生率分别为 15%、16%、11%、13%;而随访至生后 1年时,各种生长偏离的发生率降至 5%、7%、7%、8%。与国外研究相比,生长偏离率较低,可能为Sharma及 Mukhopadhyay等纳入的极低出生体重早产儿中超低出生体重早产儿的比例较高(30%和15%) [20-21],而本研究仅 9.8%。超低出生体重早产儿生长落后的风险是极低出生体重早产儿的 3.45倍 [21];另外,Sharma及 Mukhopadhyay[20]的研究中,50%的极低出生体重早产儿单纯母乳喂养。目前的研究表明,纯母乳喂养满足不了极低出生体重早产儿快速追赶生长的需求。
本研究 61例极低出生体重早产儿各年龄段WAZ、HAZ、HCZ、WHZ均 >-1 SD,表明大部分极低出生体重早产儿体格生长达到了中等水平;在纠正胎龄 40周时肥胖和超重的发生率分别为20%和 10%,而随访至生后第一年,肥胖和超重的发生率下降至 2%和 3%。这与生后营养强化使体重出现早期快速增长,而身长的追赶生长较体重晚,随着身长追赶生长的出现,BMI在生后 1年逐渐达到生长发育的适宜水平。近年来,关于体重的追赶生长可能诱发成年期心血管及代谢相关疾病的争议较多。部分研究 [22-23]认为,生后第一年体重的过快增长可能增加成年后胰岛素抵抗及高血压的发病风险,提出了早产儿“缓慢追赶生长”的观点,认为早产儿追赶生长应平稳持续到学龄前期。而 Finken等 [24]研究认为,成年期慢性疾病的风险源于青春期体质指数及体脂成分,与婴儿期体重的快速追赶生长无关,婴幼儿体重的快速追赶生长不会增加成年后代谢性疾病的风险。本次研究仅观察到生后一年,对于远期是否会导致心血管疾病及代谢性疾病如高血压、糖尿病等还需要长期的随访观察。
我们发现与体质量相关的 BAZ及 WHZ高峰出现在纠正年龄前 3个月内,而与身长及头围相关的 HCZ及 HAZ高峰出现在其后,与童梅玲 [25]及 Mukhopadhyay等 [21]的研究相似,提示体重、身长、头围的追赶生长模式存在差异。
刘维民等报道的极低出生体重早产儿脑瘫的发生率为 6.17%[13],与本研究的脑瘫发生率相近。而本研究的 DQ异常发生率低于欧阳小琳报道 [26],可能得益于营养支持、定期儿保监测和行为干预指导。目前国内外的文献均显示低出生体重儿早期干预组的神经运动发育优于未干预组 [27]。已有多项研究表明极低出生体重早产儿出生后的生长落后与认知、运动发育落后密切相关 [2-7],而积极的营养强化有助于追赶生长和促进精神运动发育 [19, 27]。值得注意的是,SGA组 DDST筛查的异常几率明显高于 AGA组。Guerra[28]对低出生体重早产儿随访 2年,SGA的精神运动发育迟缓的比例更高,Kato等 [29]进行的极低出生体重早产儿 3年随访也得出类似的结果。我们的研究也显示,在纠正胎龄 40周和纠正年龄 3个月、6个月、9~12个月,SGA组的低体重、生长迟缓的发生率都明显高于 AGA组。Sharma[20]和 Westerberg[30]等均在极低出生体重早产儿生后第一年的随访研究中有类似的报道。原因尚不十分清楚,可能与 SGA早产儿体内胰岛素样生长因子(insulin-like growthfactor,IGF)轴的功能改变有关。钱玉萍等 [31]发现,小于胎龄早产儿血清 IGF-1水平较适于胎龄早产儿明显降低。而 IGF-1与糖、脂、蛋白质代谢,促进细胞的增值、分化,促进生长密切相关。因此,在关注小于胎龄的极低出生体重早产儿追赶生长时还应监测 IGF-1水平。
另外,本研究 Logistic回归分析发现小于胎龄为极低出生体重早产儿生长落后的独立危险因素。曹玮等 [4]也发现小于胎龄是 34周以下早产儿宫外发育迟缓的独立危险因素。因此,小于胎龄的极低出生体重早产儿出现生长落后及神经运动发育落后的风险更大,需要更严密的随访和定期的神经运动发育监测,并且做好围生期保健,降低小于胎龄极低出生体重早产儿的比例。
目前国内关于极低出生体重早产儿生长发育随访的资料极为有限。我们的研究采用 Z评分法对体格生长进行了客观的评价,并对他们的神经运动发育进行了较长期随访,为极低出生体重早产儿的生长发育评价和监测管理模式提供了有价值的探索。但本研究也存在样本量偏少,随访时间较短的不足,还需要后续扩大样本量并追踪长期随访的结果。
| [1] | Glass HC, Costarino AT, Stayer SA, et al. Outcomes for extremely premature infants[J]. Anesth Analg,2015, 120 (6) :1337–1351 . |
| [2] | Beck S, Wojdyla D, Say L, et al. The worldwide incidence of preterm birth: a systematic review of maternal mortality and morbidity[J]. Bull World Health Organ,2010, 88 (1) :31–38 . |
| [3] | Patel RM, Kandefer S, Walsh MC, et al. Causes and timing of death in extremely premature infants from 2000 through 2011[J]. N Engl J Med,2015, 372 (4) :331–340 . |
| [4] | 曹玮, 张永红, 赵冬莹, 等. 34周以下早产儿宫外生长发育迟缓发生的影响因素[J]. 中国当代儿科杂志,2015,17 (5) :453–458. |
| [5] | 郭明明, 庄思齐, 李易娟. 早产儿宫外生长发育迟缓及相关因素分析[J]. 中国妇幼保健,2010,25 (12) :1644–1647. |
| [6] | Rüegger C, Hegglin M, Adams M, et al. Population based trends in mortality, morbidity and treatment for very preterm-and very low birth weight infants over 12 years[J]. BMC Pediatr,2012, 12 :17. |
| [7] | Cooke RW. Are there critical periods for brain growth in children born preterm?[J]. Arch Dis Child Fetal Neonatal Ed,2006, 91 (1) :F17–20 . |
| [8] | Pierrat V, Marchand-Martin L, Guemas I, et al. Height at 2 and 5 years of age in children born very preterm: the EPIPAGE study[J]. Arch Dis Child Fetal Neonatal Ed,2011, 96 (5) :F348–354 . |
| [9] | Horemuzova E, Åmark P, Jacobson L, et al. Growth charts and long-term sequelae in extreme preterm infants-from full-term age to 10 years[J]. Acta Paediatr,2014, 103 (1) :38–47 . |
| [10] | Niklasson A, Engström E, Hard AL, et al. Growth in very preterm children: a longitudinal study[J]. Pediatr Res,2003, 54 (6) :899–905 . |
| [11] | Allin M, Walshe M, Fern A, et al. Cognitive maturation in preterm and term born adolescents[J]. J Neurology Neurosurg Psychiatry,2008, 79 (4) :381–386 . |
| [12] | Murray E, Fernandes M, Fazel M, et al. Differential effect of intrauterine growth restriction on childhood neurodevelopment: a systematic review[J]. BJOG,2015, 122 (8) :1062–1072 . |
| [13] | 刘维民, 鲍秀兰, 马磊, 等. 早期干预降低极低出生体重儿脑瘫发生率的临床研究[J]. 中国儿童保健杂志,2015,23 (4) :360–363. |
| [14] | 蔡威, 汤庆娅, 王莹, 等. 中国新生儿营养支持临床应用指南[J]. 临床儿科杂志,2013,31 (12) :1177–1182. |
| [15] | 中国康复医学会儿童专业委员, 中国残疾人康复协会小儿脑瘫康复专业委员会. 小儿脑瘫的定义分型和诊断条件[J]. 中华物理医学与康复杂志,2007,29 (5) :309. |
| [16] | 中国15城市体格发育科研协作组. 我国不同胎龄新生儿体格发育的现状[J]. 临床儿科杂志,1991,9 (2) :72–77. |
| [17] | 毛萌.生长发育[M]//王卫平,毛萌,李延玉,等. 儿科学. 第 8 版.北京: 人民卫生出版社, 2013: 8-22. |
| [18] | 王庆红, 杨于嘉, 魏克伦, 等. 我国小于胎龄儿现状分析[J]. 中国实用儿科杂志,2009,24 (3) :177–180. |
| [19] | 王丹华. 关注早产儿的营养与健康—国际早产儿喂养共识解读[J]. 中国当代儿科杂志,2014,16 (7) :664–669. |
| [20] | Sharma PK, Sankar MJ, Sapra S, et al. Growth and neurosensory outcomes of preterm very low birth weight infants at 18 months of corrected age[J]. Indian J Pediatr,2011, 78 (12) :1485–1490 . |
| [21] | Mukhopadhyay K, Mahajan R, Louis D, et al. Longitudinal growth of very low birth weight neonates during first year of life and risk factors for malnutrition in a developing country[J]. Acta Paediatr,2013, 102 (3) :278–281 . |
| [22] | Fewtrell MS, Lucas A, Cole TJ, et al. Prematurity and reduced body fatness at 8-12y of age[J]. Am J Clin Nutr,2004, 80 (2) :436–440 . |
| [23] | Hovi P, Andersson S, Eriksson JG, et al. Glucose regulation in young adults with very low birth weight[J]. N Eng J Med,2007, 356 (20) :2053–2063 . |
| [24] | Finken MJ, Inderson A, Van Montfoort N, et al. Lipid profile and carotid intima-media thickness in a prospective cohort of very preterm subjects at age19 years: effects of early growth and current body composition[J]. Pediatr Res,2006, 59 (4 Pt 1) :604–609 . |
| [25] | 童梅玲, 张敏, 池霞, 等. 84 例早产适于胎龄儿第一年体格追赶生长纵向评估[J]. 中国当代儿科杂志,2011,13 (1) :12–15. |
| [26] | 欧阳小琳, 林希平. 极低出生体重儿的婴幼儿时期生长发育情况调查[J]. 中华儿科杂志,2000,38 (5) :296–298. |
| [27] | 田新新, 冉霓. 早产儿低出生体重对神经精神发育远期预后影响研究进展[J]. 中国实用儿科杂志,2011,26 (2) :154–156. |
| [28] | Guerra CC, Barros MC, Goulart AL, et al. Premature infants with birth weights of 1500-1 999 g exhibit considerable delays in several developmental areas[J]. Acta Paediatr,2014, 103 (1) :e1–6 . |
| [29] | Kato T, Mandai T, Iwatani S, et al. Extremely preterm infants small for gestational age are at risk for motor impairment at 3 years corrected age[J]. Brain Dev,2016, 38 (2) :188–195 . |
| [30] | Westerberg AC, Henriksen C, Ellingvag A, et al. First year growth among very low birth weight infants[J]. Acta Pædiatr,2010, 99 (4) :556–562 . |
| [31] | 钱玉萍. 早产小于胎龄儿血清 Ghrelin, 胰岛素样生长因子-1, 胰岛素水平及其与生长发育关系[D]. 合肥: 安徽医科大学, 2013. |
 2016, Vol. 18
2016, Vol. 18